
第一作者:Roman Kleinmans, Tobias Pinkert
通訊作者:Frank Glorius
通訊單位:明斯特大學(xué)
光化學(xué)[2+2]環(huán)加成合成環(huán)丁烷被人們研究了長達(dá)一個(gè)世紀(jì),這個(gè)反應(yīng)通過兩個(gè)烯烴分子的π電子生成C-C σ鍵從而實(shí)現(xiàn)環(huán)加成,得到環(huán)丁烯。目前[2+2]環(huán)加成反應(yīng)主要關(guān)注于[2π+2π]體系。
有鑒于此,明斯特大學(xué)Frank Glorius等報(bào)道發(fā)展了通過雙環(huán)[1.1.0]丁烷作為2σ電子反應(yīng)物,進(jìn)行分子間[2π+2σ]光催化環(huán)加成反應(yīng)。該反應(yīng)通過應(yīng)力釋放的方式,實(shí)現(xiàn)了[2π+2σ]光化學(xué)環(huán)加成,反應(yīng)通過三重態(tài)能量轉(zhuǎn)移進(jìn)行光催化。以香豆素、黃酮和吲哚等雜環(huán)烯烴作為反應(yīng)物,通過簡單、模塊、對映選擇性的方式,合成雙環(huán)[2.1.1]己烷(BCH,bicyclo[2.1.1]hexanes)。
由于BCH在生物領(lǐng)域能夠作為生物電子等排體(bioisosteres),因此可能用于制藥等方面,因此發(fā)展此類分子的合成方法學(xué)具有重要意義。同時(shí),該反應(yīng)將分子間[2+2]光化學(xué)環(huán)加成反應(yīng)的范疇拓展至σ鍵,能夠合成現(xiàn)有方法學(xué)無法構(gòu)建的結(jié)構(gòu)。
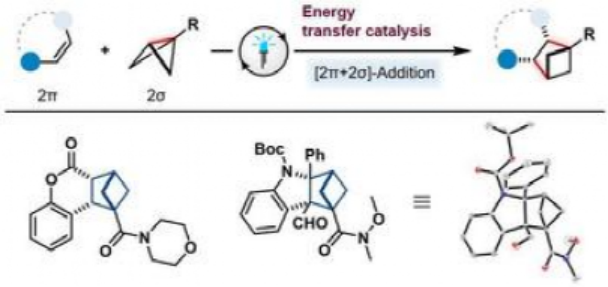
圖1. 分子間三重態(tài)能量轉(zhuǎn)移[2π+2σ]反應(yīng)
背景
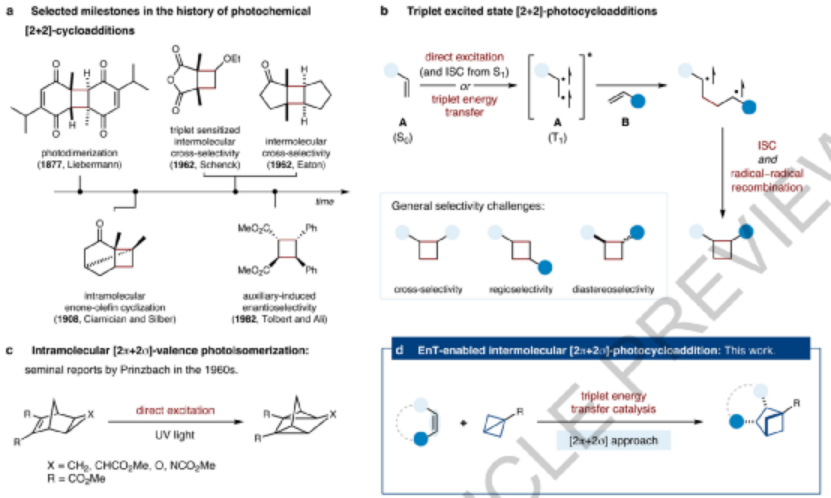
圖2. (a) [2+2]環(huán)加成反應(yīng)的發(fā)展歷程 (b) [2+2]環(huán)加成的三重態(tài)激發(fā)機(jī)理 (c) 1960年代發(fā)展的分子內(nèi)[2π+2σ]反應(yīng) (d) 新發(fā)展的三重態(tài)能量轉(zhuǎn)移分子間[2π+2σ]反應(yīng)
[2+2]光化學(xué)環(huán)加成是有機(jī)化學(xué)領(lǐng)域合成張力環(huán)丁烷結(jié)構(gòu)最重要的方法,這種反應(yīng)過程中能夠一步生成兩個(gè)σ-C-H化學(xué)鍵,最多能夠同時(shí)形成4個(gè)立體結(jié)構(gòu)碳原子,因此是一種步驟經(jīng)濟(jì)的合成方法。1877年,Liebermann首次報(bào)道暴露在太陽光中,百里醌(thymoquinone,5-異丙基-2-甲基-1,4-苯醌)的二聚反應(yīng)能夠進(jìn)行[2+2]光化學(xué)環(huán)加成反應(yīng),后來劃時(shí)代的重要工作是分子內(nèi)的二聚反應(yīng)、以及構(gòu)建立體結(jié)構(gòu)。
此外,交叉選擇性的分子間[2+2]光化學(xué)環(huán)加成反應(yīng)是個(gè)非常引人注意的工作,相對于二聚或分子內(nèi)[2+2]環(huán)加成,分子間交叉環(huán)加成通過對烯烴分子結(jié)構(gòu)設(shè)計(jì),能夠快速構(gòu)建復(fù)雜的分子結(jié)構(gòu)。交叉選擇性光化學(xué)[2+2]環(huán)加成反應(yīng)過程一般選擇性的活化烯烴A,隨后活化的烯烴A與烯烴B反應(yīng)。從機(jī)理上看,該反應(yīng)中最有效的方法是將底物活化為三重激發(fā)態(tài)(T1),然后通過三重態(tài)使得分子間形成更好的相互作用。這種三重態(tài)底物分子能夠通過底物分子直接激發(fā)再進(jìn)行系間竄越得到,或者通過從光敏劑分子進(jìn)行三重態(tài)能量轉(zhuǎn)移(EnT)間接得到。
由于大多數(shù)有機(jī)分子直接激發(fā)需要嚴(yán)苛的離子化UV紫外光才能夠?qū)崿F(xiàn),較高的能量導(dǎo)致反應(yīng)過程中較多副反應(yīng)。因此,通過更加溫和的可見光以EnT方式活化底物分子得到更加廣泛的關(guān)注。
新發(fā)展
在1960年前后Prinzbach等發(fā)現(xiàn)的三環(huán)分子分子內(nèi)[2π+2σ]光異構(gòu)反應(yīng)的基礎(chǔ)上,作者認(rèn)為通過應(yīng)力釋放方式可能實(shí)現(xiàn)分子間[2π+2σ]光化學(xué)環(huán)加成反應(yīng)。因此,發(fā)現(xiàn)通過具有張力的雙環(huán)[1.1.0]丁烷作為底物能夠進(jìn)行[2π+2σ]反應(yīng)。
該反應(yīng)過程生成雙環(huán)[2.1.1]己烷,該結(jié)構(gòu)分子在生物等電子體系中具有越來越重要的生物活性,可能在醫(yī)藥領(lǐng)域具有重要作用。
實(shí)驗(yàn)優(yōu)化
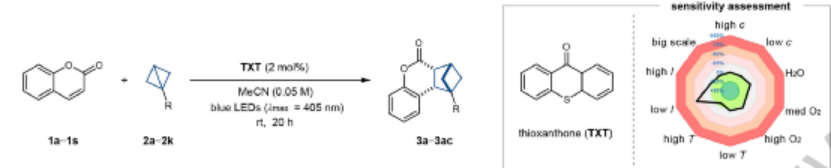
圖3. 反應(yīng)條件
首先使用[Ir(dF(CF3)ppy)2(dtbbpy)]PF6作為光敏劑(ET=61.8 kcal/mol),藍(lán)光LED作為光源,MeCN作為溶劑,香豆素作為匹配的烯烴反應(yīng)物(ET=62.1 kcal/mol)。
作者進(jìn)一步發(fā)現(xiàn),將[Ir]光敏劑替換為硫雜蒽酮TXT(thioxanthone, ET=65.5 kcal/mol)能夠改善反應(yīng)產(chǎn)率,而且反應(yīng)能夠避免使用貴金屬光催化劑,在光化學(xué)反應(yīng)過程中,只觀測發(fā)現(xiàn)生成cis順式立體結(jié)構(gòu)的產(chǎn)物。
反應(yīng)兼容性
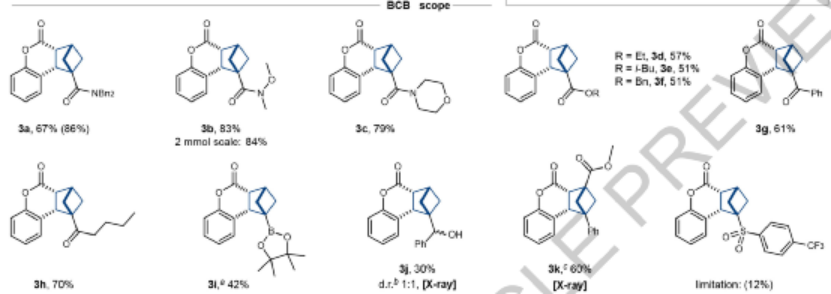
圖4. 反應(yīng)兼容性(1)
底物兼容性。在優(yōu)化的反應(yīng)條件中,首先考察BCB(雙環(huán)[1.1.0]丁烷)的兼容性。在BCB上安裝Weinreb酰胺、嗎啉酰胺能夠在反應(yīng)過程中獲得較高的產(chǎn)率,在底物上安裝烷基酯(乙基、異丁基、芐基)分別能夠以中等收率得到相應(yīng)的產(chǎn)物,芳基/烷基酮官能團(tuán)修飾同樣得到較好的收率,修飾BPin的BCB能夠以合成上可接受的產(chǎn)率(~42 %)得到對應(yīng)的產(chǎn)物。當(dāng)BCB底物中沒有缺電子官能團(tuán)時(shí),同樣能夠得到對應(yīng)產(chǎn)物,當(dāng)BCB底物中的1,3位點(diǎn)安裝位阻型官能團(tuán)同樣能夠生成目標(biāo)產(chǎn)物。但是該反應(yīng)無法兼容含有亞砜的底物。
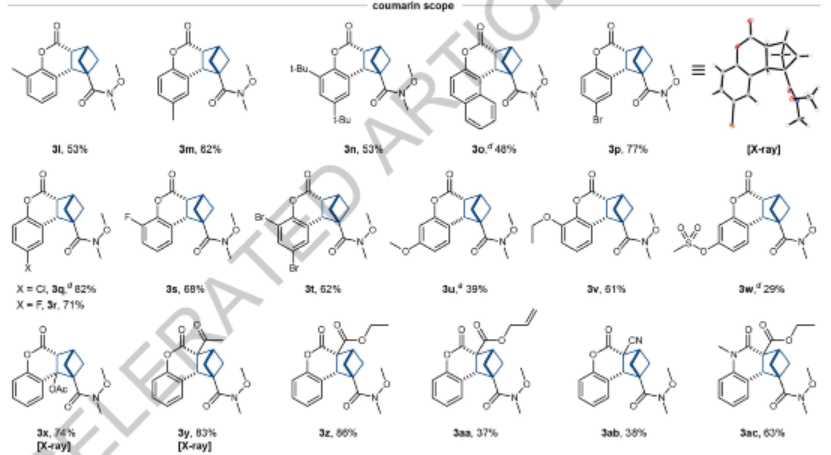
圖5. 反應(yīng)兼容性(2)
香豆素底物兼容性。在芳環(huán)上含有甲基取代基的底物能夠兼容反應(yīng),甚至立體位阻效應(yīng)非常高的底物同樣具有兼容性,能夠得到較好的產(chǎn)率,而且底物兼容不同鹵素(Br, Cl, F)。π體系更大的苯并香豆素同樣兼容。供電子官能團(tuán),比如烷氧基、甲磺酸基、乙酰基、醇基、酮基、酯基、栓系烯烴、氰基等官能團(tuán)具有兼容性。香豆素的氮雜環(huán)衍生物(2-喹諾酮類)同樣兼容,其他的吲哚、黃酮等雜環(huán)烯烴分子同樣能夠很好的參與反應(yīng)。
反應(yīng)機(jī)理
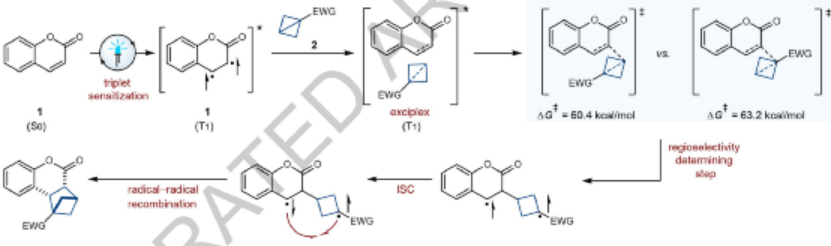
圖6. 反應(yīng)機(jī)理
反應(yīng)機(jī)理。可見光激發(fā)TXT光敏劑通過EnT過程實(shí)現(xiàn)激發(fā)底物分子香豆素,將香豆素分子激發(fā)生成T3三重態(tài),并且與BCB分子生成激發(fā)態(tài)復(fù)合物,并且實(shí)現(xiàn)生成一個(gè)C-C化學(xué)鍵。(DFT計(jì)算結(jié)果顯示,反應(yīng)過渡態(tài)由熱力學(xué)控制,在香豆素底物的α-羰基位點(diǎn)與BCB分子中的3位點(diǎn)生成的過渡態(tài)具有最好的熱力學(xué)穩(wěn)定性。)隨后,生成的1,5-雙自由基三重激發(fā)態(tài)復(fù)合物通過順式選擇性自由基-自由基復(fù)合反應(yīng),以立體選擇性方式生成環(huán)加成產(chǎn)物。
參考文獻(xiàn):
Kleinmans, R., Pinkert, T., Dutta, S. et al. Intermolecular [2π+2σ]-photocycloaddition enabled by triplet energy transfer. Nature (2022)
DOI: 10.1038/s41586-022-04636-x
https://www.nature.com/articles/s41586-022-04636-x











