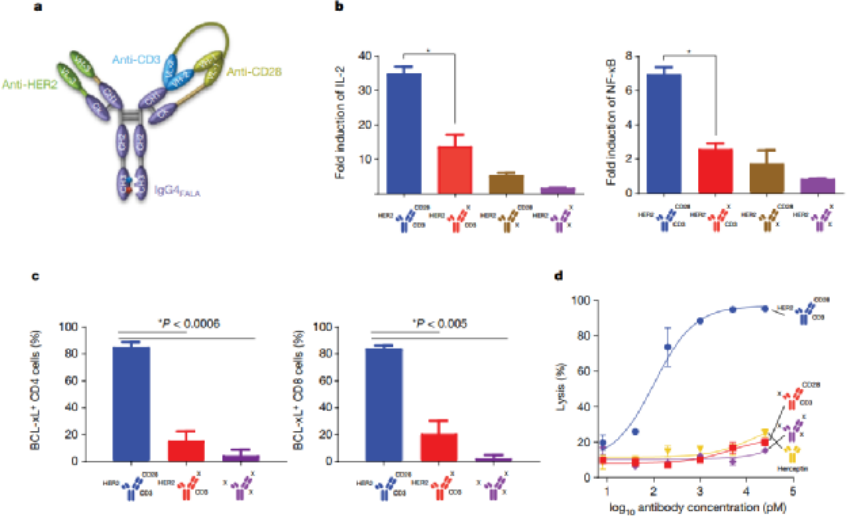
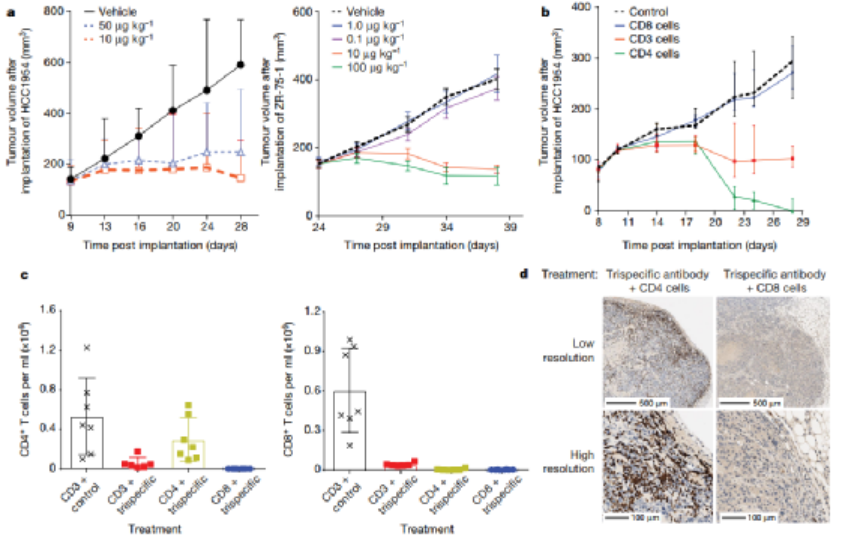
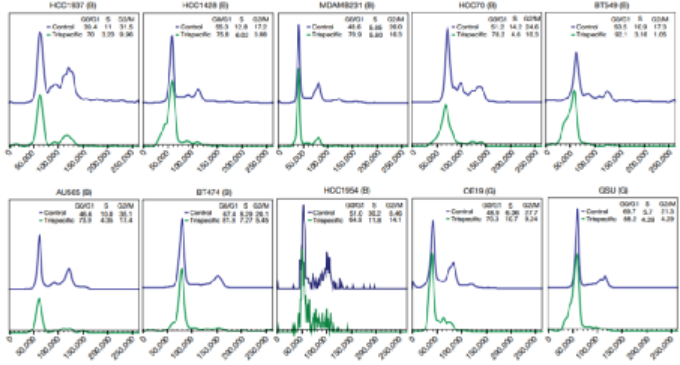
免疫治療的最新進展徹底改變了癌癥治療的臨床試驗����。在成功的免疫療法中,已獲批準的雙特異性抗體(如blinatumomab)激發了人們對其他多特異性抗體療法的興趣。HER2是人類表皮生長因子受體酪氨酸激酶家族的成員,在乳腺癌、胃癌和其他癌癥中高度表達。例如三陰性乳腺癌表達生理水平的HER2�����,并且對HER2靶向單克隆抗體治療具有抗性��。為了開發針對此類惡性腫瘤的高效療法�,賽諾菲公司Gary J. Nabel��、Zhi-yong Yang和Lily Pao等人首先通過分析抗體結合位點����、位置和雙特異性結合臂接頭來確定三特異性抗體的成分����,之后通過瞬時轉染制備三特異性抗體,得到了一種由HER2、CD3和CD28組成的三特異性抗體(圖1)���。1)三特異性抗體不但能夠與腫瘤相關抗原和激活T細胞相結合,還能夠結合T細胞表面的另一個,延長T細胞的抗腫瘤效果。2)該研究證實了CD4細胞通過在G1/S阻斷癌細胞周期進程發揮抗增殖作用�����,這是一種以前未被認識的惡性腫瘤免疫控制機制�。圖 1. 三特異性抗體對HER2體外免疫激活的性能。為了確定T細胞亞群在腫瘤消退中的作用,將純化的CD3、CD4或CD8細胞過繼轉移到植入了HCC1954乳腺癌細胞的人源化小鼠中。純化的CD3或CD4細胞的過繼轉移刺激了幾乎完全的腫瘤消退(圖2)。相比之下,CD8細胞單獨發揮最小的抗腫瘤作用��?���?赡苁怯捎谠跊]有輔助T(TH)細胞的情況下存活率低,因為在CD8 T細胞重組的小鼠中未顯示可檢測到的CD8細胞�。盡管BCL-xL表達�,但激活并擴增的CD8 T細胞的凋亡率增加�,這可能導致在沒有CD4 T細胞幫助的情況下它們的數量很少���。這一結果說明CD4細胞在介導腫瘤消退中的重要性�����。圖 2. 人源化小鼠模型中HER2三特異性抗體對腫瘤生長的影響�����。為了進一步探索這種機制,作者考察了CD4細胞是否對HER2+人類乳腺癌和胃癌細胞系中發揮直接抑制作用(圖3)����。值得注意的是��,所有10種細胞系在細胞周期的G0/G1期均顯示出明顯的積累,處理組的G1/S生長停滯��。相比之下�,在CD8細胞存在下,與三特異性抗體孵育的腫瘤細胞系顯示出細胞周期分布的變化較小��。這些數據表明����,三特異性抗體通過不同且互補的效應機制刺激CD4和CD8細胞裂解人乳腺癌細胞�����。圖 3. 三特異性抗體刺激的CD4 + T細胞抑制HER2 +乳腺癌和胃癌細胞的細胞周期進程和/或增殖。為了表征暴露于T細胞亞群后乳腺癌細胞基因表達的變化�,在三特異性或陰性對照抗體存在下�����,在暴露于CD4或CD8細胞1天后���,通過對HCC1954細胞進行基因表達譜分析(圖4)���。結果表明�����,CD4和CD8 T細胞通過不同的機制發揮其抗腫瘤活性��。而且,CD4細胞直接影響腫瘤細胞周期進程�,這是一種以前未被認識的惡性腫瘤免疫控制機制����。圖 4.三特異性抗體刺激CD4 + T細胞在乳腺癌細胞系HCC1954中抑制細胞周期進程和/或增殖并刺激炎癥反應����。總之,作者證明了HER2��、CD3和CD28的三特異性抗體通過CD4細胞依賴性抑制腫瘤細胞周期�,從而實現乳腺癌的消除。盡管CD8 T細胞在體外直接介導腫瘤消除�����,但CD4 T細胞通過在G1/S阻斷癌細胞進程周期發揮抗增殖作用�,并刺激細胞的炎癥反應。該三特異性抗體技術有助于從多靶點刺激更有效的腫瘤消退�,改善多種人類癌癥的治療����。Edward Seung�,et al. A trispecific antibody targeting HER2 and T cells inhibits breast cancer growth via CD4 cells. Dio: 10.1038/s41586-022-04439-0.全文鏈接:https://www.nature.com/articles/s41586-022-04439-0