眼睛是一個復雜的器官���,具有來自不同原始細胞譜系的高度特化的組成組織����。例如��,視網膜是通過視泡從神經外胚層發育而來的����,角膜上皮是從表面外胚層發育而來的�,而角膜的虹膜和富含膠原蛋白的基質則具有神經嵴起源���。人類的眼表由淚膜覆蓋�,這層淚膜可潤滑、營養和保護眼表組織���,在維持眼的正常生理功能中發揮極其重要的作用�。淚膜主要由淚液形成�����,而淚液大部分由淚腺分泌。淚腺與位于眼瞼內的產生脂質的瞼板腺協同作用��,共同建立和維持健康的淚膜�����,促進良好的視力����。淚腺還通過合成防御蛋白(包括乳鐵蛋白和溶菌酶)來保護眼表。淚腺功能障礙和淚液分泌減少與一系列病因有關�,是最常見的自身免疫性疾病之一干燥綜合征的特征���,導致干眼癥����。哺乳動物胎兒淚腺存在干/祖細胞��,具有再生能力����。然而����,在成年人中,淚腺的再生能力很小�����,并且體外培養受到細胞分離和腺體組織活檢的限制�����。因此,在體外構建具有完整結構和功能的淚腺組織具有重要意義。2013年���,Lancaster在大腦類器官中發現具有人眼視杯類似組織的區域,隨著對培養條件的不斷優化和升級迭代,在體外可以夠構建具有光敏感性的大腦類器官和視網膜類器官,這些進展對人眼發育和人視神經疾病的研究具有重要的意義。然而��,這些類器官構建的方向重點關注視網膜組織�,對于為眼睛起保護性作用的腺體組織的關注相對較少。2021年,Hans Clevers課題組利用分離的小鼠和成人的淚腺組織��,在體外構建出具有分泌功能的淚腺類器官����,極大地推進了為淚腺生物學的研究和淚腺疾病的治療開辟了新的途徑。但是,對于淚腺的發育和成熟過程等卻知之甚少�。2022年4月20日����,日本大阪大學醫學院Ryuhei Hayashi等人基于該實驗室在2016年發表在Nature上所建立的自形成的���、外胚層的����、自主的、多區域(Self-formed,ectodermal,autonomous,multi-zone,SEAM)二維(2D)眼類器官的基礎之上��,以題為Generation of 3D lacrimal gland organoids from human pluripotent stem cells在Nature上發表具有完整淚腺結構和功能的淚腺類器官��,為淚腺的發育研究和移植治療提供了新的研究模型����。


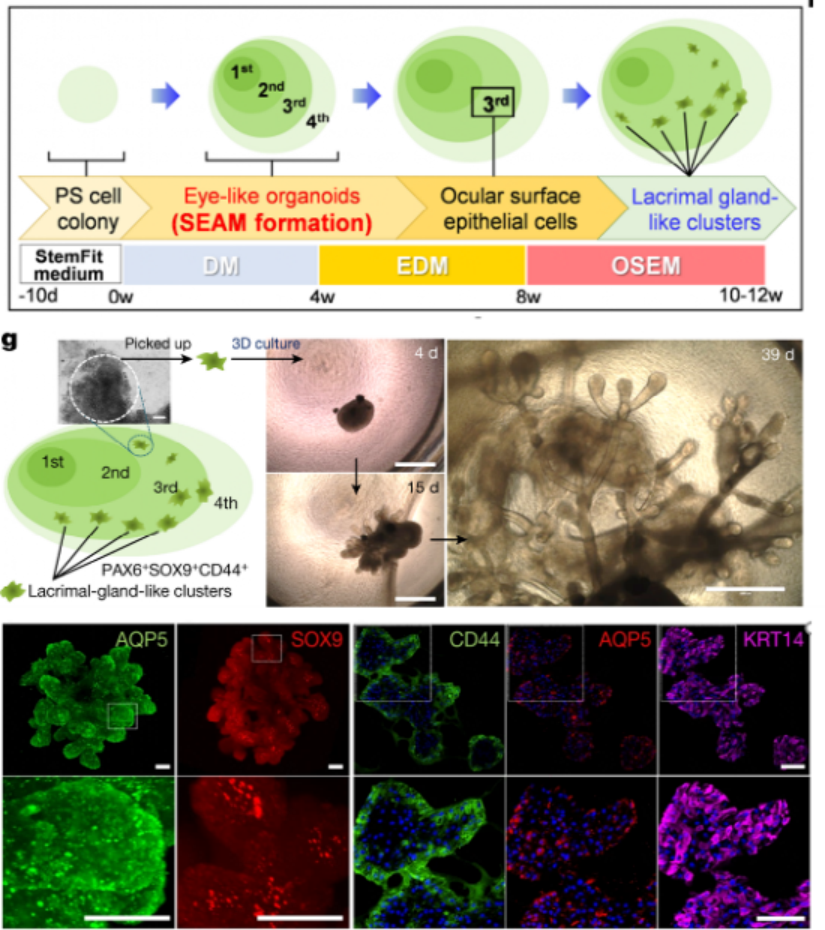
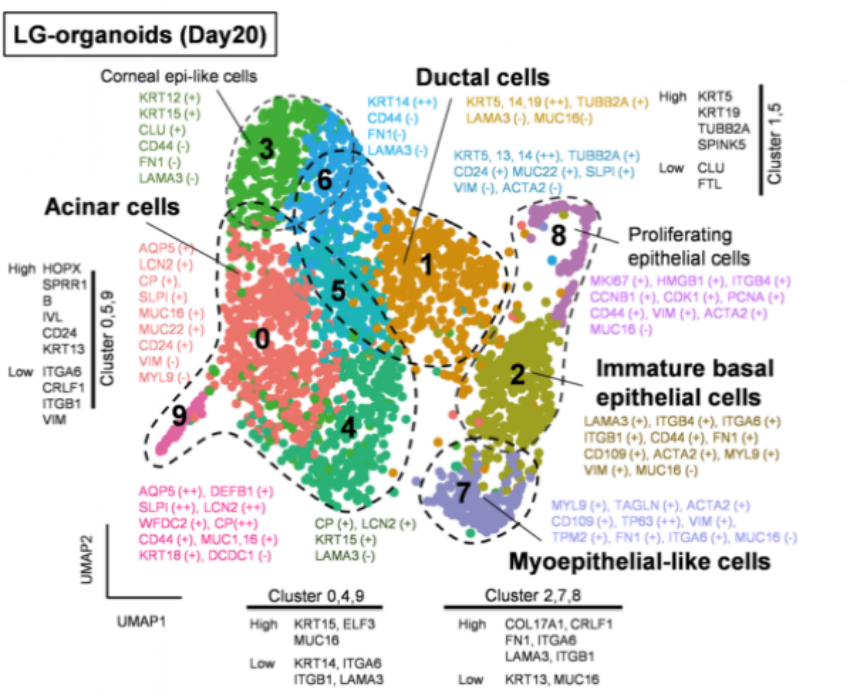
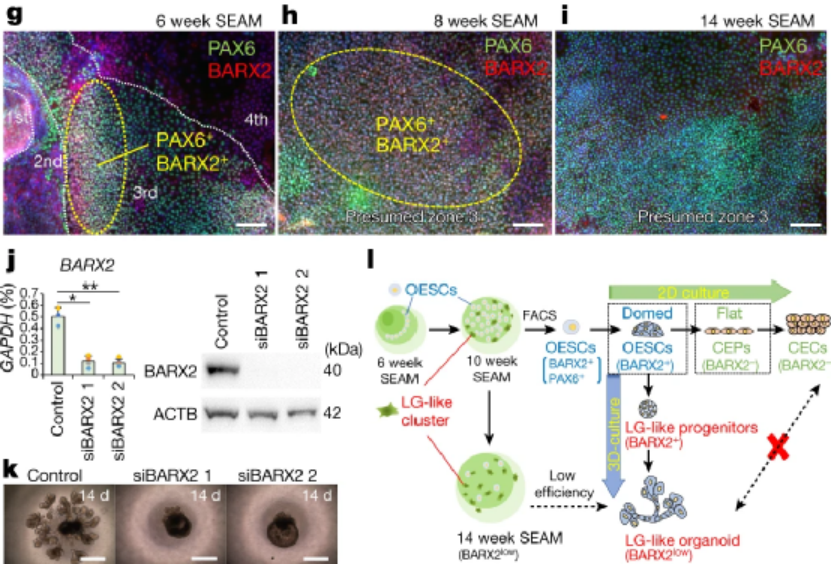
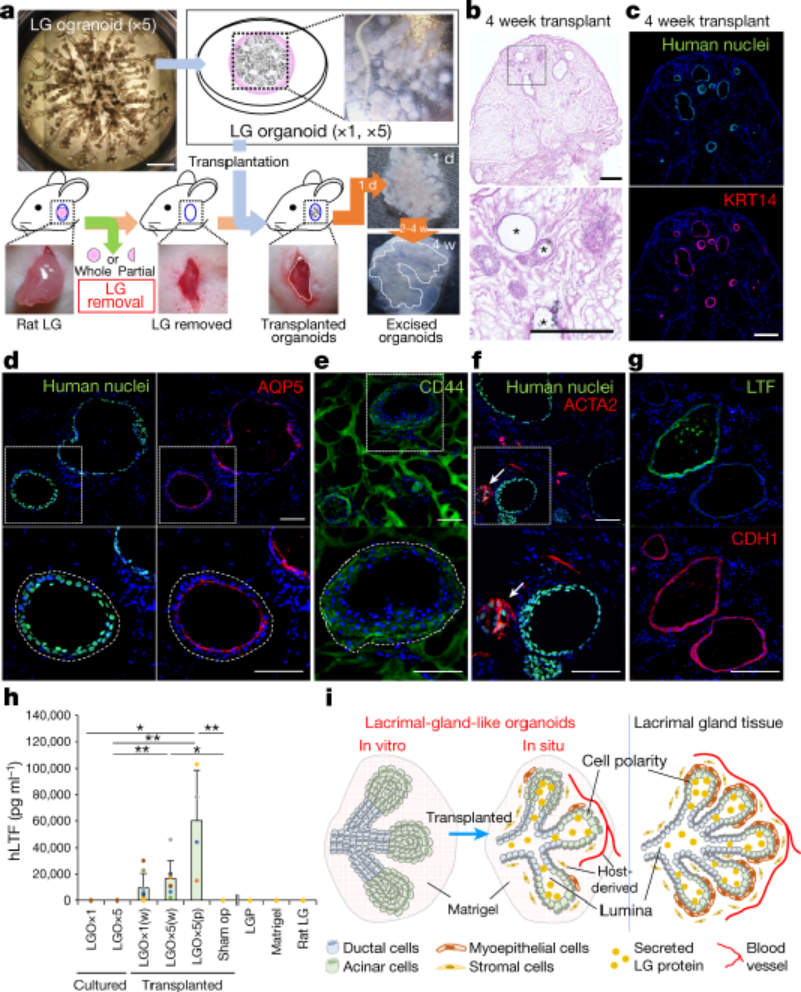
誘導人多能干細胞分化成淚腺類器官�,并優化其培養條件作者基于前期建立的實驗基礎,利用人誘導多能干細胞hiPSC細胞系201B7在體外誘導分化成具有淚腺類器官簇的SEAMs眼狀類器官,并利用免疫熒光等技術手段鑒定了淚腺的關鍵標志物的表達�����。進一步��,作者通過對培養基中的成分進行調整,優化出含有表皮生長因子EGF�����、角化細胞生長因子KGF�、成纖維細胞生長因子FGF10、骨形態發生蛋白BMP7和Y-27632的關鍵因子的培養基�,能定向的誘導多能干細胞分化為芽狀淚腺類器官(圖一)����。隨后作者基于優化的培養基分化了另外兩種多能干細胞系(hiPS細胞YZWJs524和hES細胞KhES-1),均可以形成淚腺類器官����,驗證了該培養基具有普適性��。光片熒光顯微鏡分析淚腺類器官,在一些腺泡細胞的細胞核中鑒定出SOX9以及主要在腺泡細胞上的點狀的AQP5�����。還在細胞內觀察到CDH1�����,在細胞核中觀察到PAX6�����,在大多數細胞的細胞質區域觀察到KRT14,在所有腺泡和導管細胞的整個基底側都發現了CD44。在形態切片中未觀察到清晰的管腔結構����,但在hiPS細胞衍生的淚腺類器官和AQP5和SOX9中存在細胞內CDH1和核內PAX6在一些腺泡細胞中發現。然從人類ES細胞產生的類器官顯示出與其hiPS細胞衍生的淚腺類器官相似的免疫染色模式(圖一)�����。基因表達分析顯示參與淚腺發育的轉錄因子如PAX6�����、SOX9�、BARX2�����、RUNX1����、SIX2和FGFR2IIIb在淚腺分化培養過程中瞬時上調��,并且隨后在淚腺類器官中減少����。單細胞測序結果(scRNA-seq)分析表明�,在3D培養的第10天,淚腺祖細胞瞬時表達增殖標志物MKI67以及上皮間質轉化標志物VIM和FN1�����。這些標志物的表達在第20天下調�,此時AQP5+腺泡細胞已開始分別表達脂質運載蛋白和防御素的功能性淚腺蛋白LCN2和DEFB1。此外�����,第20天的類器官包含主要細胞簇���,包括腺泡���、導管和肌上皮樣細胞(圖二)����。為了進一步探究淚腺祖細胞來源于眼表上皮干細胞的假設���,作者使用延時顯微鏡觀察克隆團的形成���,將其分類為圓頂或扁平(圖3a)����。幾乎所有的克隆團最初都是圓頂形的,但隨著時間的推移,往往會變成扁平的克隆團�,以至于在4周后���,扁平的菌落占主導地位���。在誘導淚腺類器官方面���,圓頂菌落比扁平菌落更有效�。與淚腺發育相關的基因,如BARX2�����、SIX2�����、SOX9和KRT15在圓頂菌落中上調。相比之下,在扁平菌落中���,粘膜上皮角蛋白KRT13和角膜上皮祖細胞標志物CDH2和NGFR占主導地位。在分化的第6周和第8周,BARX2與PAX6在SEAM區的最內側區域共表達。此后��,與KRT12表達相反��,BARX2表達減少��,KRT12表達隨時間增加。此外�����,BARX2在淚腺祖細胞形成的球狀體中強烈表達��,但在淚腺類器官中表達減少���。使用小RNA干擾技術敲低BARX2后��,得出與體內研究相一致的結果----淚腺類器官中的出芽和分支顯著減少。這證實了BARX2是淚腺發育的關鍵分子,并且對由hiPS細胞產生的淚腺類器官的形成有影響�����。最后��,作者為了驗證所建立的淚腺類器官在治療等方面應用的潛能����,將淚腺類器官移植到淚腺剝離的大鼠眼睛附近的結締組織中�����。在移植后,移植的人淚腺類器官在體內可以存活����,并且其中一些表現出管腔樣結構�。這些人類淚腺類器官的細胞中的大多數表達KRT14�����、PAX6和CDH1��,而一部分在頂端表達AQP5,SOX9�����,CD44���,并呈現細胞極性�����。與體外淚腺類器官相比�,植入2周的淚腺類器官顯示出明顯的導管�����。盡管在移植的淚腺類器官周圍積累的大多數大鼠基質細胞ACTA2+細胞���,少數細胞與抗人抗體呈陽性反應���,表明淚腺類器官可能能夠分化為ACTA2+人肌上皮樣細胞�����。在移植的類器官的某些部分也檢測到體外淚腺類器官缺乏的分泌腺細胞,這表明植入后的淚腺類器官進一步分化成熟�����。此外����,ELISA結果顯示,與未移植的類器官或假手術的組織相比���,移植的淚腺類器官中的人乳鐵蛋白和溶菌酶蛋白水平升高。與單個球體相比���,由五個淚腺類器官球體產生的移植淚腺類器官中的蛋白質水平也更高。移植的類器官中的乳鐵蛋白產量大約達到了體內大鼠淚道組織中的乳鐵蛋白產量的一半�。使用人類基因特異性TaqMan探針組對移植后組織的基因表達分析顯示�,在移植的淚腺類器官中����,與未移植的類器官相比,編碼淚膜蛋白溶菌酶和乳鐵蛋白的LYZ和LTF的表達高出3000倍�����。因此��,移植的淚腺類器官的表達表型與淚腺組織的表達表型一致���,但與其他腺體或眼表上皮組織不同��,移植部位的微環境和移植的類器官的數量對于淚腺類器官實現功能成熟都很重要。總之����,本文作者開發出了一種從hiPS細胞和ES細胞構建具有特定結構和功能淚腺類器官的分化方法,同時驗證了其發育路徑和移植后的成熟。這一進展為淚腺發育研究和用于治療干燥綜合征等疾病的再生療法帶來了希望�,為淚腺相關疾病的基礎研究和藥物開發提供了創新性平臺����。目前�,淚腺類器官的來源主要有兩種,一種是本文所介紹的多能干細胞來源的淚腺類器官分化方法;另一種是Hans Clever團隊基于成體細胞構建的淚腺類器官�����,兩者均能在體外構建具有與人體淚腺結構和功能的類器官�,但是兩者也存在一定的優勢和局限性。本文中的淚腺類器官相較于Hans Clever法構建的類器官的成熟度較低,在研究淚腺的發育具有一定的優勢����,而Hans Clever法的淚腺類器官則更加的成熟�,但其來源相對復雜�����。兩者各具優勢�,對于后期的應用具有巨大的潛力���,這也為淚腺相關疾病的治療提供了新的視角�。[1] Cowan C S , Renner M , MD Gennaro, et al. Cell Types of the Human Retina and Its Organoids at Single-Cell Resolution[J]. Cell, 2020, 182(6):1623-1640.e34.[2] M Bannier-Hélaout, Post Y , Korving J , et al. Exploring the human lacrimal gland using organoids and single-cell sequencing[J]. Cell Stem Cell, 2021.[3] Hayashi R , Ishikawa Y , Sasamoto Y , et al. Co-ordinated ocular development from human iPS cells and recovery of corneal function[J]. Nature, 2016, 531(7594):376-380.[4] 丁傳慶. 淚腺解剖和功能的最新研究及其與干眼的關系[J]. 中華實驗眼科雜志, 2020, 38(10):4.[5] Lancaster M A , Renner M , Martin C A , et al. Cerebral organoids model human brain development and microcephaly[J]. Movement Disorders, 2013, 501(7467):373.[6] Hayashi, R., Okubo, T., Kudo, Y. et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature (2022). https://doi.org/10.1038/s41586-022-04613-4