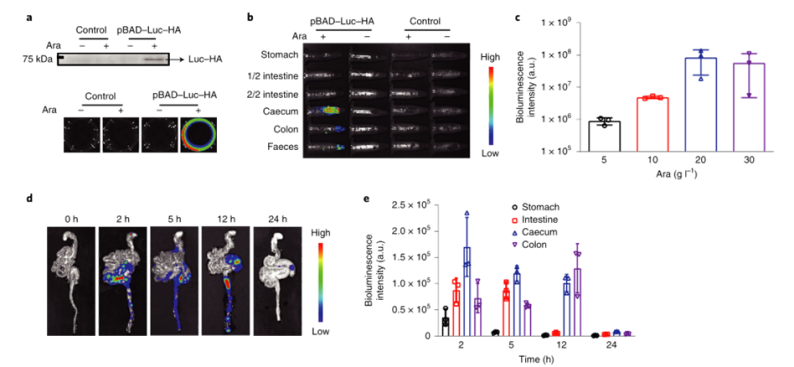
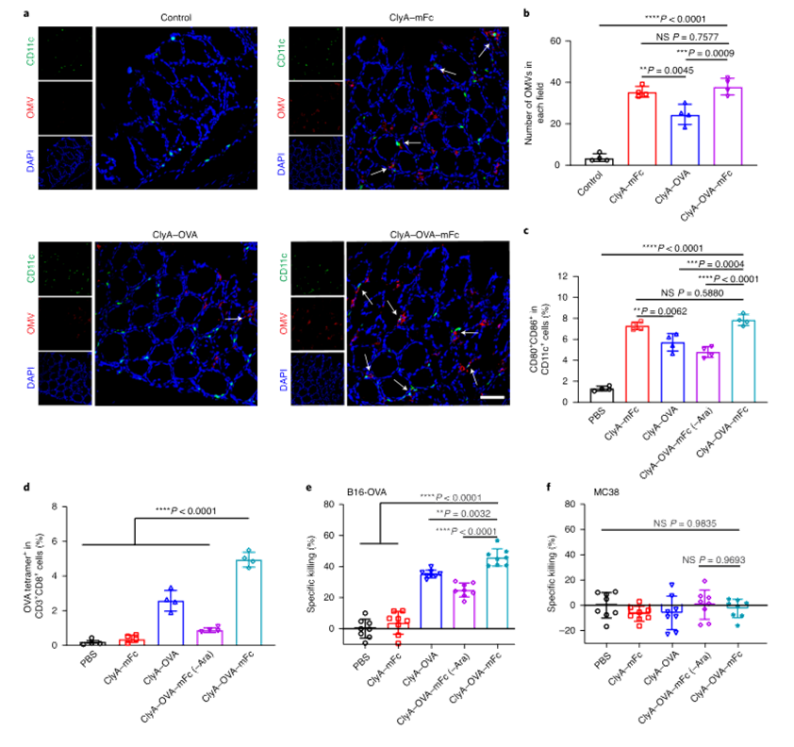
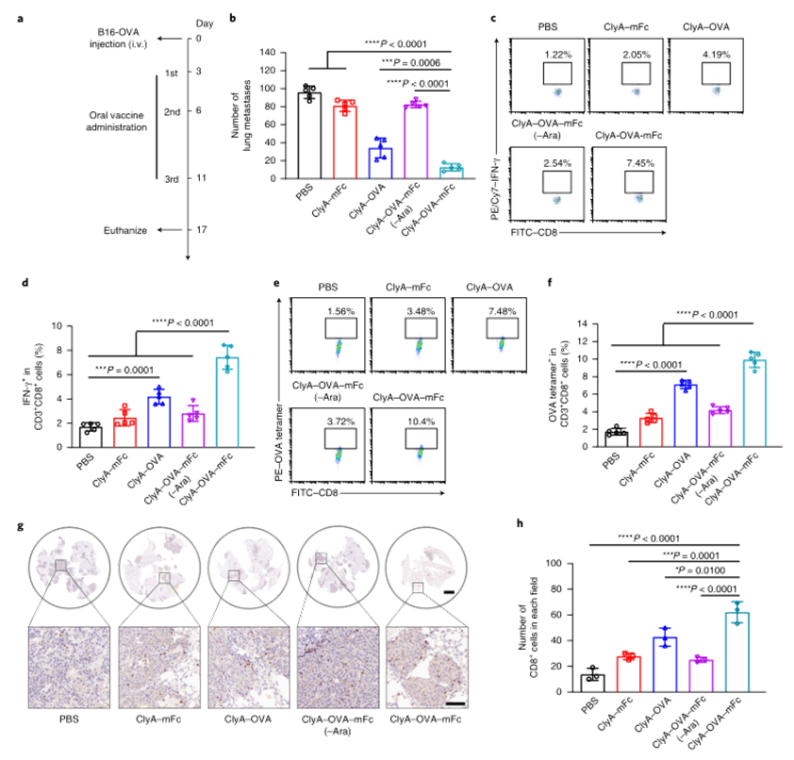
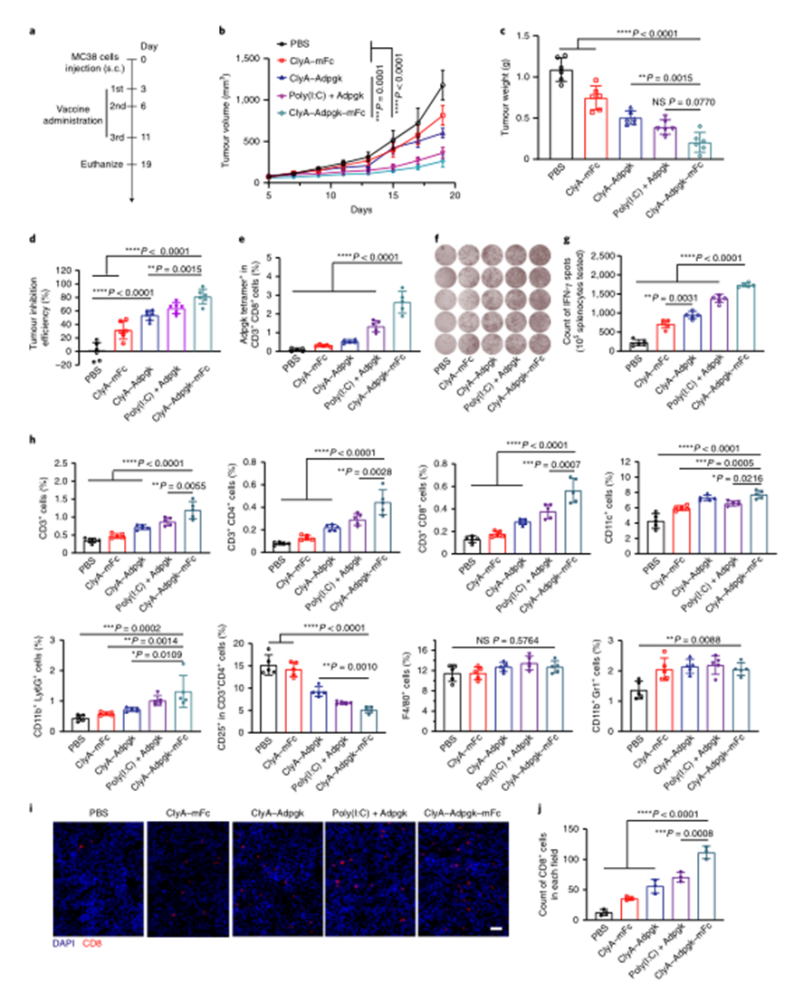
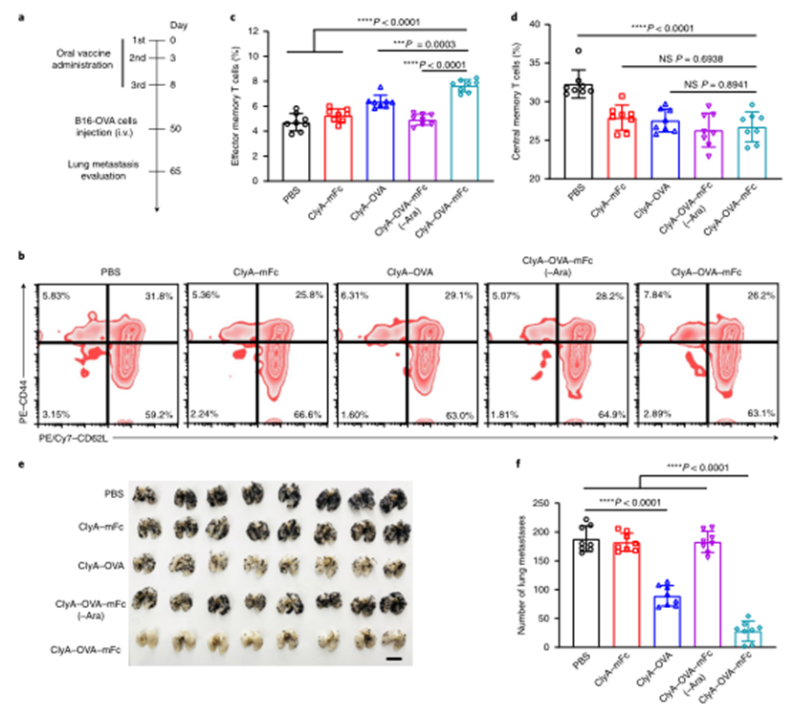
目前,臨床試驗中的大多數腫瘤疫苗通過肌肉注射或皮下注射進行接種,由于抗原呈遞細胞在肌肉組織和皮下層的分布有限,因此需要使用佐劑來提高通過這些途徑接種的疫苗的免疫原性。腸道是最大的免疫器官,含有約70%的人體免疫細胞,口服腫瘤疫苗是激發強大的抗腫瘤免疫反應的一個有希望的替代選擇。然而,由于復雜的胃腸環境和腸上皮屏障的挑戰,口服腫瘤疫苗受到限制。近年來,利用工程微生物輸送治療藥物和治療疾病受到越來越多的關注。之前的研究已經證明,口服程序化細菌或改良益生菌可以識別腸道中的結腸癌組織,并使治療劑能夠局部輸送,從而促進腫瘤消退。腸道細菌釋放的外膜囊泡(OMV)可與宿主免疫系統相互作用。OMV是由革蘭氏陰性細菌分泌的天然納米顆粒,由于其豐富的病原體相關分子模式(PAMP),可以激活先天免疫系統。然而,OMV在體內的功能和代謝的具體機制尚不清楚,關于基因工程菌在腸道原位分泌功能性OMV治療疾病的報道也很少。值得一提的是,腸道細菌釋放的OMV具有穿透腸上皮屏障并與固有層中的免疫細胞,尤其是樹突狀細胞(DC)相互作用的能力,導致免疫調節。針對口服腫瘤疫苗的技術障礙,并利用腸道共生細菌的生物學特性,國家納米中心的聶廣軍和趙瀟團隊報告了一種基因工程細菌衍生的口服腫瘤疫苗。首先,研究人員將小鼠免疫球蛋白G(IgG;mFc)的腫瘤抗原(Ag)和Fc片段融合到OMV(ClyA–Ag–mFc)表面蛋白ClyA的C末端。假設mFc會通過Fc和新生兒Fc受體(FcRn)之間的相互作用,增強DC對OMV的識別和攝取。此外,為了實現嚴格的疫苗接種途徑,避免長期抗原刺激引起的免疫耐受,研究人員引入了阿拉伯糖(Ara)誘導啟動子來控制融合蛋白的表達。通過口服改良細菌和表達誘導劑Ara,在腸道內實現了攜帶腫瘤抗原(OMV–Ag–mFc)的OMV的原位可控生產。這些OMV–Ag–mFc有效地穿過腸上皮屏障,并被固有層中的DC吸收,隨后進行淋巴結引流和腫瘤抗原遞呈。在多種小鼠癌癥模型中,腫瘤抗原特異性免疫激活顯著抑制腫瘤生長和抵抗腫瘤挑戰。為了可視化細菌的生物分布,研究人員首先設計了大腸桿菌(Top10菌株),在araBAD啟動子(pBAD–Luc–HA)的控制下,表達與人流感血凝素標簽(HA標簽;Luc–HA)融合的熒光素酶,araBAD啟動子由Ara激活。接下來,給小鼠口服工程大腸桿菌,然后口服Ara。12h后,收集不同部位的胃腸組織和糞便進行生物發光檢測。在pBAD–Luc–HA大腸桿菌+Ara組的小鼠盲腸、結腸和糞便中觀察到生物發光信號。這些結果表明,口服給藥的工程化大腸桿菌能夠到達腸道并耐受腸道環境,這確保了Ara口服時目標融合蛋白的成功表達。接下來,研究人員評估了工程大腸桿菌的生物分布和藥代動力學。口服pBAD–Luc–HA大腸桿菌和Ara后,生物發光信號在給藥后2小時主要出現在盲腸,并在12小時內逐漸移動到結腸。24小時后,由于細菌的代謝清除,生物發光信號變弱,這對口服疫苗的生物安全性很重要。為了研究口服疫苗是否能夠刺激免疫系統,研究人員融合了卵清蛋白(OVA)的一個表位(O VA257–264(SIINFEKL))或mFc連接到OMV表面蛋白ClyA的C末端,生成ClyA–mFc、ClyA–OV A和ClyA–OV A–mFc,所有這些都用HA標簽標記。并繼續在體外和體內研究OMV穿透腸上皮屏障的能力。為此,研究人員在transwell系統的上腔聯合培養結腸癌Caco-2和HT29細胞21天,以模擬腸上皮屏障。12小時后通過流式細胞術分析成熟DC的百分比。OMV有效穿透上皮屏障并激活下腔中的DC。接下來,研究人員進行了灌腸實驗,以檢測OMV在體內的滲透能力。結果顯示在ClyA–mFc、ClyA–OVA和ClyA–OVA–mFc組中,OMV明顯穿透腸上皮屏障。此外,與不含mFc的OMV相比,含mFc的OMV具有更大的穿透力和DC親和力。綜上所述,工程化大腸桿菌分泌的OMV能夠穿透腸上皮屏障,而ClyA與mFc的融合有利于這一過程。接下來,研究人員又檢測了口服細菌衍生疫苗在體內刺激免疫系統的能力。與口服磷酸鹽緩沖鹽水(PBS)組相比,在所有口服細菌衍生疫苗組中,CD11c+DC中CD80+CD86+細胞的比例顯著增加,口服ClyA–mFc和ClyA–OVA–mFc疫苗組CD80+CD86+細胞的比例高于口服ClyA–OVA疫苗組,這可能是由于mFc介導的上皮滲透增強。這些結果表明,小鼠固有層中的免疫細胞耐受固有共生細菌,而口服外源細菌通過OMV介導的機制刺激固有層中的DC。研究人員研究了不同口服細菌源性疫苗(第0、3和8天)三輪免疫后的抗原特異性免疫應答。結果顯示,口服ClyA–OVA–mFc疫苗刺激的CD3+CD8+抗原特異性T細胞數量最高。這種口服細菌衍生疫苗的免疫刺激可以通過口服Ara來控制。研究人員還評估了收集的脾細胞對表達卵清蛋白的黑色素瘤B16(B16-OVA)和結腸癌MC38細胞的細胞毒性作用。與來自ClyA–OVA-mFc疫苗組的脾細胞相比,來自ClyA–OVA-mFc疫苗組的脾細胞對B16-OV A細胞表現出更強的細胞毒性作用,表明mFc修飾增強上皮滲透的重要性。當使用不表達OV A抗原的MC38細胞時,所有組中的細胞毒性效應均消失,因此證明了口服細菌衍生疫苗免疫刺激的抗原特異性。綜上所述,口服疫苗能夠在Ara的控制下在腸道內產生攜帶腫瘤抗原的OMV。OMVs原位疫苗可以穿透腸上皮屏障,激活抗原特異性T細胞對抗腫瘤細胞。為了評估口服疫苗對轉移性黑色素瘤的抗腫瘤效果,研究人員在第0天向小鼠靜脈接種B16-OVA細胞,并在第3、6和11天用各種口服疫苗制劑或PBS(對照)對動物進行口服免疫。與口服PBS組相比,口服ClyA–OVA疫苗可抑制約60%的肺轉移,而口服ClyA–OVA–mFc疫苗組的肺轉移幾乎被消除。在口服ClyA-OVA-mFc疫苗組中,經OVA257-264抗原肽再刺激的脾細胞中IFN-γ+或CD3+CD8+T細胞的比例最高。此外,在口服ClyA–OVA–mFc疫苗組中,肺浸潤性CD8+CTL的水平也最高。這些結果表明,ClyA–OVA–mFc是一種有效的口服腫瘤疫苗,可有效誘導抗腫瘤免疫。研究人員第0天在小鼠皮下注射MC38腫瘤細胞建立皮下MC38腫瘤模型,然后,將來自MC38細胞的特異性抗原Adpgk(ASMTNMELM)引入口服腫瘤疫苗,小鼠接受3次口服PBS、ClyA–mFc、ClyA–Adpgk或ClyA–Adpgk–mFc疫苗治療(第3天、第6天和第11天)。此外,皮下注射佐劑聚肌苷聚胞苷酸(Poly(I:C))和Adpgk肽(Poly(I:C)+Adpgk)的混合物作為陽性對照,結果顯示與其他組小鼠相比,口服ClyA–Adpgk–mFc疫苗組小鼠表現出更強的腫瘤生長抑制。與其他組相比,口服ClyA–Adpgk–mFc疫苗組的腫瘤重量也最低。與口服PBS組相比,口服ClyA–Adpgk–mFc疫苗組的腫瘤抑制率為81.2%。所有這些都表明這些口服疫苗耐受性良好,沒有明顯毒性。口服ClyA–Adpgk–mFc疫苗組和皮下注射聚(I:C)+Adpgk疫苗組發現血液中CD3+CD8+T細胞比例增加;在口服ClyA–Adpgk–mFc疫苗免疫的小鼠中,這種效果更強。正如所料,大多數IFN-γ是由口服ClyA–Adpgk–mFc疫苗免疫的小鼠脾細胞產生的。這些結果進一步證實,這種口服疫苗比臨床試驗中使用的普通配方更強烈地激活抗原特異性免疫應答。接下來,研究人員通過流式細胞術檢測腫瘤組織中浸潤的免疫細胞,口服ClyA–Adpgk–mFc疫苗可顯著抑制腫瘤微環境中的免疫抑制性CD3+CD4+CD25+Treg。與其他疫苗組類似,口服ClyA–Adpgk–mFc疫苗組中存在CD11b+Gr1+MDSCs浸潤,盡管MDSCs的瘤內浸潤不干擾抗腫瘤效果。最后,正如預期的那樣,在口服ClyA–Adpgk–mFc疫苗組中發現了數量最多的浸潤性CD8+T細胞。為了研究口服疫苗制劑治療的長期免疫記憶和益處,研究人員在第0天、第3天和第8天用各種口服疫苗治療健康小鼠三次。在第50天分離脾細胞,并通過流式細胞術分析中央記憶T細胞和效應記憶T細胞的比例結果顯示,效應記憶T細胞(CD3+CD8+CD44+CD62L)的比例在口服ClyA–OVA–mFc疫苗組顯著高于其他口服疫苗組和PBS組。接下來,在第50天通過尾靜脈注射用B16-OVA細胞刺激免疫小鼠,并在第65天收集肺部并成像,口服ClyA–OVA疫苗組和口服ClyA–OVA–mFc疫苗組的肺轉移顯著減少,口服ClyA–OVA–mFc疫苗組對腫瘤挑戰的保護作用更強。總的來說,這些結果證實了口服細菌衍生OMV腫瘤疫苗可以誘導有效的免疫記憶,這對于長期預防腫瘤復發至關重要。綜上所述,研究人員通過基因工程改造大腸桿菌(腸道中最豐富的共生細菌之一)來建立基于細菌衍生OMV的口服腫瘤疫苗。利用這一策略,在腸道內實現了攜帶腫瘤抗原的OMV的原位可控生產。與腫瘤抗原一起,OMV有效地穿過腸上皮屏障,被固有層中的免疫細胞識別,從而有效地激活腫瘤抗原特異性免疫反應,導致對腫瘤生長的顯著抑制。這一策略在開發口服腫瘤疫苗方面具有巨大潛力。Yue, Y., Xu, J., Li, Y. et al. Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria. Nat. Biomed. Eng (2022). https://doi.org/10.1038/s41551-022-00886-2