先前研究

此外,今年早些,麻省理工學院K. Dane Wittrup和Darrell J. Irvine等研究人員使用美國FDA批準的疫苗佐劑氫氧化鋁 (明礬) 遞送工程細胞因子,實現將IL-12刺激分子直接輸送到腫瘤中,從而避免免疫刺激藥物在全身使用時可能產生的毒性作用。成果同樣發表在Nature Biomedical Engineering上。(細胞因子,連發2篇Nature Biomedical Engineering!)

近日,來自芝加哥大學Jeffrey A. Hubbell院士和Jun Ishihara等人再次發力,報道了一種蛋白質工程方法,作為一種解決IL-12毒性和重構冷TME的策略。研究人員通過一個融合的受體結構域屏蔽IL-12的受體結合位點,該結構域通過一個腫瘤蛋白酶可切割的連接子連接,從而使其活性在TME蛋白水解裂解時選擇性地恢復。在皮下腺癌和原位黑素瘤小鼠模型中,靜脈注射修飾后的IL-12不會引起系統性IL-12信號轉導并消除系統性免疫相關不良事件,通過重塑免疫抑制微環境導致了有效的治療效果,并使冷腫瘤對免疫檢查點抑制有反應。

背景介紹:
免疫檢查點抑制(CPI)療法,如使用抗程序性死亡1 (αPD-1)抗體的療法,在某些癌癥類型的治療中取得了巨大成功;然而,越來越多的證據表明,由于缺乏充分激活的CD8+ T細胞,這些療法在免疫“冷”腫瘤中基本上無效。免疫抑制腫瘤微環境的重構可以通過觸發一系列炎癥反應來克服CD8+ T細胞的排斥,促進抗腫瘤CD8+ T細胞的浸潤和活化。
IL-12是一種有吸引力的細胞因子,可以刺激先天和適應性免疫系統,并能夠激活抗原提呈細胞(APCs)。多年來,人們對IL-12的臨床轉化進行了無數的嘗試,但還沒有IL-12產品在臨床中獲得批準。因此,解決IL -12誘導的免疫相關的不良事件的挑戰對于將這種強大的抗腫瘤細胞因子轉化到臨床是至關重要的。
研究思路:
1、體外激活掩蔽修飾的IL-12可完全恢復IL-12的生物活性:
小鼠IL-12受體β1的前兩個纖維連接蛋白III型結構域與IL-12融合將使其失活。然后,研究人員表達了幾種具有不同連接子底物的IL-12變體,這些底物可以被不同的腫瘤蛋白酶切割。再用重組基質金屬蛋白酶-2(MMP2)、MMP9或尿激酶纖溶酶原激活劑處理修飾的IL-12分子。工程化IL-12的蛋白水解后體外激活完全恢復了活性。
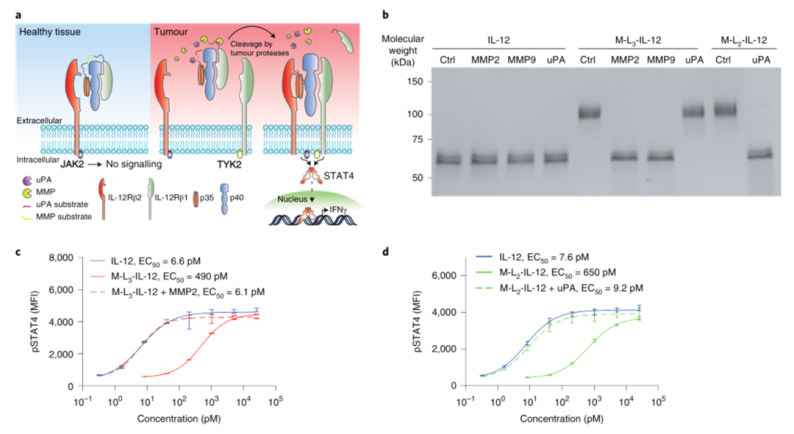
圖|經重組蛋白酶處理后,掩蔽的IL-12完全恢復活性
2、修飾后的IL-12在同基因模型中保留抗腫瘤活性,并引起TME的免疫重塑:
然后,研究人員在B16F10小鼠黑色素瘤模型中檢測三種IL-12變體誘導的抗腫瘤效果,以確定最佳連接物。結果表明,M-L6-IL-12的連接子的酶敏感性最好。且M-L6-IL-12與荷瘤小鼠的血清一起孵育至少6小時,在體外保持穩定。為了證明在體內發生了切割,研究人員用M-L6-IL-12或M-LNC-IL-12治療B16F10荷黑色素瘤小鼠,這些數據表明,M-L6-IL-12在其他環境中保持完整,但在腫瘤中被選擇性激活。然后,研究人員在B16F10模型中使用M-L6-IL-12進行劑量遞增研究,M-L6-IL-12顯示出劑量依賴性的抗腫瘤效果。為了評估M-L6-IL-12在CPI無反應模型中的抗腫瘤效果,研究人員對原位EMT6三陰性乳腺腫瘤的小鼠進行治療,用M-L6-IL-12治療可顯著延長存活時間。并且與單用M-L6-IL-12治療相比,在M-L6-IL-12中添加αPD-1可顯著延長生存期。
IFN?是IL-12抗腫瘤活性的直接下游分子和主要介質,在兩個治療組的TME中同樣上調。TNFα、GM-CSF、CXCL9、CXCL10、CCL5和CCL4的表達升高,這些結果表明,修飾的IL-12可以有效激活II型IFN途徑,從而導致多種炎癥分子的分泌,導致顯著的CD8+T浸潤。
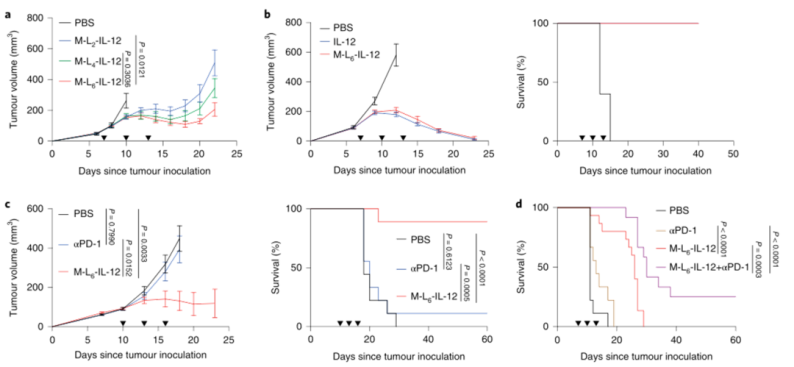
圖|修飾的IL-12誘導強烈的抗腫瘤反應,并加強CPI治療
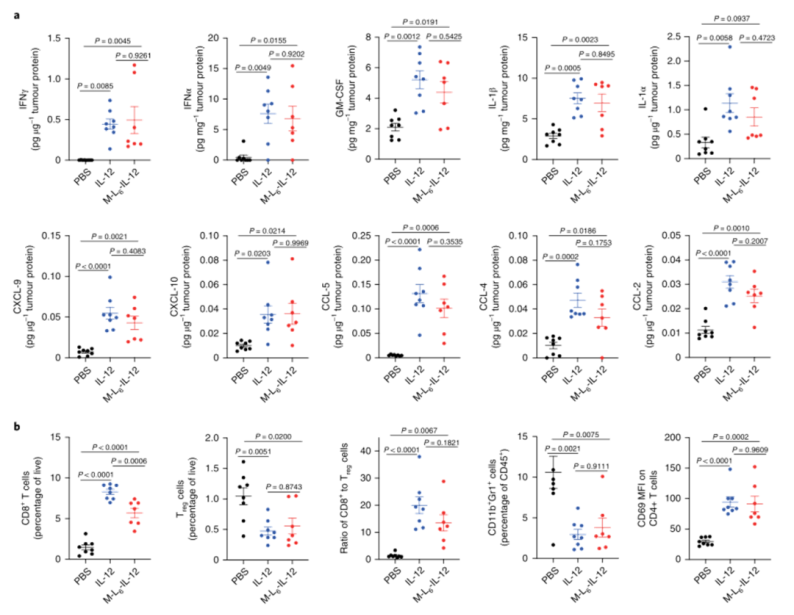
圖|修飾的IL-12療法可引起廣泛的炎癥反應,并導致黑色素瘤中的免疫細胞浸潤
3、用蛋白酶敏感的IL-12治療可最大限度地減少系統性IRAE:
研究人員接下來研究了掩蔽修飾后IL-12體外生物活性的降低是否會導致系統性IRAE的減少。與生理鹽水處理的小鼠相比,未修飾的IL-12誘導顯著的體重減輕,而修飾后IL-12處理的小鼠在研究過程中保持其體重。在臨床試驗中,修飾后IL-12可顯著降低血漿IFN?、IL-6、TNFα和CCL-2濃度。與未經修飾的IL-12治療的小鼠相比,經M-L6-IL-12治療的MC38荷瘤小鼠的肝、腎和胰腺損傷標記物減少,總之,這些數據表明,這種修飾方法顯著降低了健康和荷瘤小鼠中IL-12誘導的IRAE,降低至鹽水注射水平。
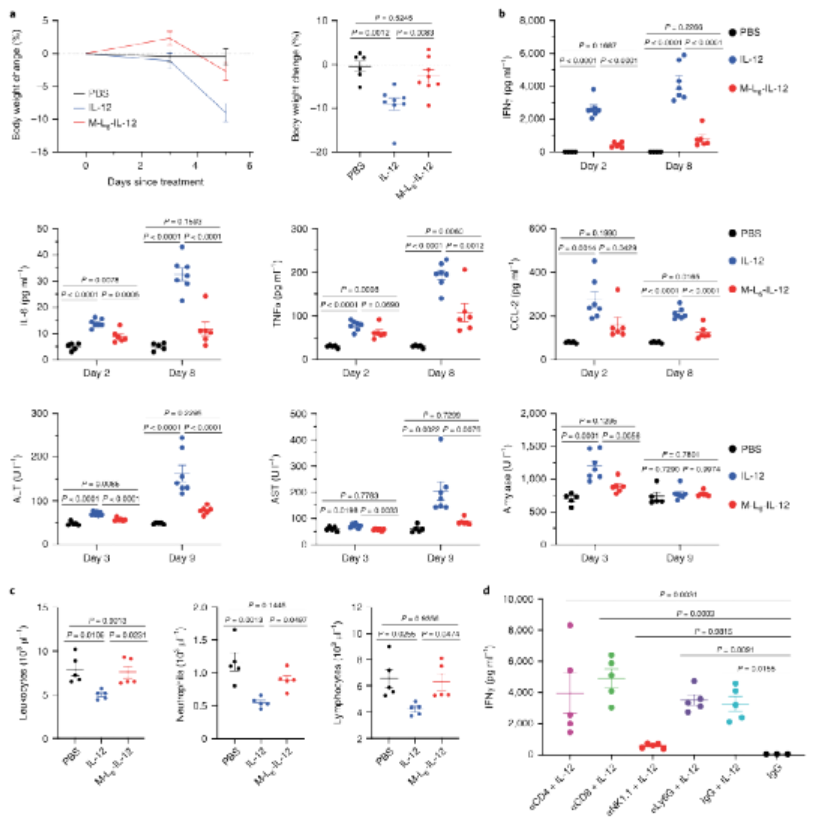
圖|修飾的IL-12可消除健康動物中與IL-12治療相關的副作用
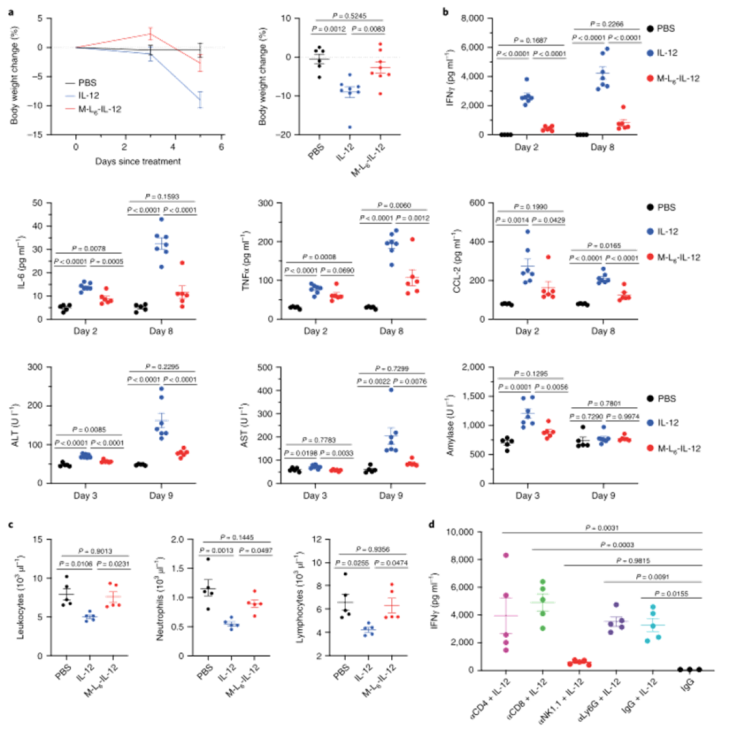
圖|用修飾后的IL-12治療黑色素瘤小鼠不會產生系統性IRAE
4、人類腫瘤的體外切割激活了修飾的IL-12:
研究人員試圖研究人類腫瘤中修飾的IL-12相對于健康組織或血清的穩定性。數據表明,M-L6-IL-12在體外可被被人黑色素瘤和乳腺癌切割,同時在匹配的血清基本保持完整。為了證明該方法也可以應用于工程人類IL-12,研究人員生成了人類修飾性IL-12,與未修飾IL-12相比,修飾的的IL-12顯示出約35倍的生物活性降低,證實了人類IL-12Rb1作為掩蔽結構域的適用性。
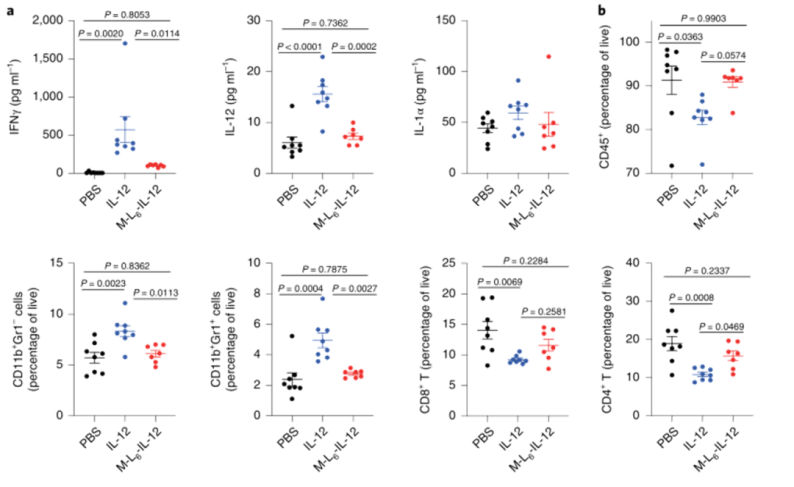
圖|人類腫瘤對修飾物的切割和人類修飾性IL-12的產生
小結:
最近旨在降低IL-12治療后IRAE發病率的工程策略依賴于將IL-12靶向腫瘤基質,盡管臨床前和臨床結果令人鼓舞,但給藥途徑、IL-12暴露于循環淋巴細胞和隨后的毒性可能會限制這種細胞因子的廣泛使用。
掩蔽修飾后的IL-12產生的全身副作用最小,可以選擇性地在腫瘤內引發嚴重炎癥。結果顯示,即使在反復服用M-L6-IL-12后,掩蔽修飾的方法也能消除IRAE。與血液中極少的IFN?相反,掩蔽修飾的IL-12誘導腫瘤內IFN?的強烈表達。IFN?誘導趨化因子表達,這些趨化因子可能誘導效應CD8+T細胞浸潤。本研究還檢測了EMT6和B16F10黑色素瘤,這是一種免疫寒冷、CPI無反應的腫瘤。研究數據清楚地表明,掩蔽修飾的的IL-12重塑了免疫抑制性冷TME,并具有與CPI療法協同作用的潛力。此外,由于IL-12Rβ1天然存在于體內,因此融合蛋白不太可能具有免疫原性,與其他可能的非內源性掩蔽結構域相比更具優勢。
總的來說,該研究結果顯示,全身性施用掩蔽修飾的IL-12可誘導有效的抗腫瘤作用,從而根除已建立的結腸腫瘤和免疫排斥的原位乳腺腫瘤;掩蔽結構域的融合消除了IL-12誘導的外周毒性。該研究還表明,離體患者腫瘤裂解物可有效激活掩蔽修飾的IL-12,強調了該方法對晚期腫瘤疾病患者的可操作性。
參考文獻:
1. A. Mansurov, P. Hosseinchi, K. Chang, A.L. Lauterbach, L.T. Gray, A.T. Alpar, E. Budina, A.J. Slezak, S. Kang, S. Cao, A. Solanki, S. Gomes, J.M. Williford, M.A. Swartz, J.L. Mendoza, J. Ishihara, J.A. Hubbell, Masking the immunotoxicity of interleukin-12 by fusing it with a domain of its receptor via a tumour-protease-cleavable linker, Nat Biomed Eng, (2022).
https://www.nature.com/articles/s41551-022-00888-0
2. Mansurov, A., et al. Collagen-binding IL-12 enhances tumour inflammation and drives the complete remission of established immunologically cold mouse tumours. Nat Biomed Eng (2020)
https://doi.org/10.1038/s41551-020-0549-2
3. Agarwal,Y., Milling, L.E., Chang, J.Y.H. et al. Intratumourally injected alum-tetheredcytokines elicit potent and safer local and systemic anticancer immunity. NatBiomed Eng (2022).
https://doi.org/10.1038/s41551-021-00831-9











