臨床三維成像中常規(guī)使用的計算機斷層掃描、磁共振成像和超聲成像缺乏在單細胞水平(小于5μm)觀察結(jié)構(gòu)和過程所需的分辨率。而且它們不能用于可視化自發(fā)熒光(所有組織的一種特征,它攜帶大量結(jié)構(gòu)信息)或來自成像示蹤劑的熒光,通常用于突出組織中的結(jié)構(gòu)特征。熒光,即使在亞細胞分辨率下,也可以通過顯微鏡檢測到,但傳統(tǒng)系統(tǒng)甚至先進的共聚焦激光掃描顯微鏡通常在生成 3D 圖像方面很慢,并且不足以建立用于臨床應(yīng)用。光片顯微鏡,它使用專門的光學(xué)器件將激光束轉(zhuǎn)換成薄光片,然后可以用于以高分辨率(甚至是極高的分辨率)進行體積成像,速度更快,但通常需要復(fù)雜的預(yù)處理樣品。
成果簡介
近日,哥倫比亞大學(xué)Elizabeth M. C. Hillman等人報告了一種用于光片熒光顯微鏡的優(yōu)化系統(tǒng),該系統(tǒng)每秒可生成高達12次的活組織體積圖像,平面和垂直分辨率分別約為 1 μm 和 2 μm。這種用于體積顯微術(shù)的快速系統(tǒng)建立在先前報道的稱為掃描共焦對齊平面激發(fā) (SCAPE) 的技術(shù)之上,并使用快速數(shù)碼相機和檢流計鏡(galvo)沿垂直于薄光的方向掃描樣品。成果發(fā)表在Nature Biomedical Engineering上。

整體設(shè)計
在“經(jīng)典”裝置中,光片顯微鏡通過照明透鏡生成固定的光片,第二個垂直放置的透鏡檢測組織的熒光激發(fā)部分。為了產(chǎn)生體積掃描,樣品需要通過光片移動。該研究開發(fā)了一種更為優(yōu)雅的光路,在這種光路中,由斜光片照射的組織切片發(fā)出的熒光通過照明透鏡本身進行檢測,然后由檢流計鏡通過兩個物鏡和一個分束器(允許同時進行雙色成像)控制進入相機。除了檢流計鏡外,此裝置沒有移動部件,因為使用相同的鏡子將光片掃過組織。(值得注意的是,來自不同掃描光片的圖像最終在相機中的相同位置,因為光片掃描運動通過掃描鏡“向后轉(zhuǎn)向”;也就是說,它們是“去掃描的”)。
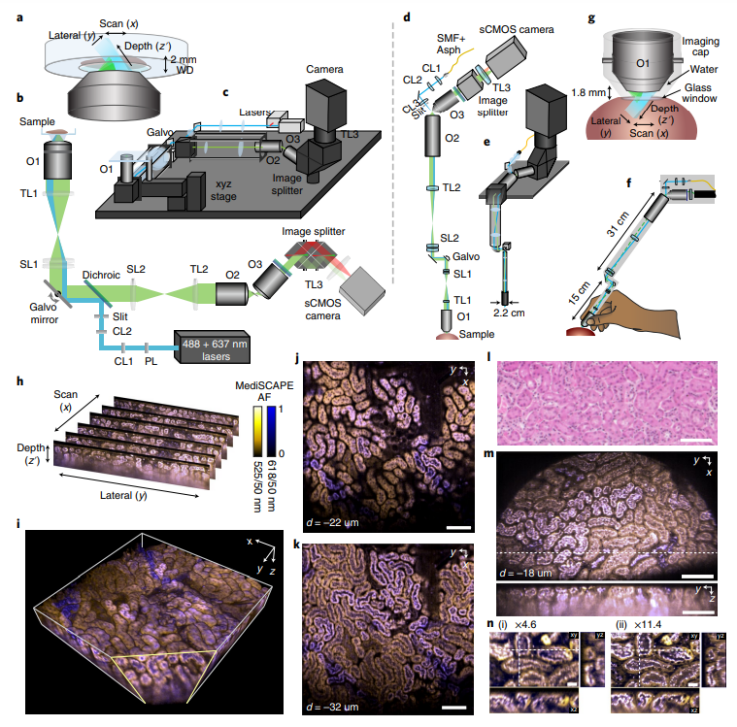
圖|MediSCAPE 系統(tǒng)設(shè)計和圖像形成
快!
通過使用該系統(tǒng)和快速照相機,作者在0.78秒內(nèi)以每體素1.0×1.4×1.1μm3的采樣速度對802×861×275 μm3的體積進行成像。除了使用單個主物鏡(直徑51 mm)的固定工作臺設(shè)置并針對大視野進行優(yōu)化外,作者還使用較小的主物鏡(直徑12mm)構(gòu)建了一個小型系統(tǒng),更堅固的光路,外徑與內(nèi)窺鏡相當(dāng),設(shè)計適合臨床使用。在小型化系統(tǒng)中,主物鏡和檢流計鏡可以手持,成像透鏡上的滅菌性蓋確保透鏡表面和成像組織之間有一個規(guī)定的距離。
可對活體小鼠進行掃描
研究人員通過利用內(nèi)源性熒光色素對組織自發(fā)熒光進行成像,展示了臺式和小型化系統(tǒng)的性能。他們報告了從小鼠身上切除的不同健康和癌性器官的基本結(jié)構(gòu)特征的如實重建。而且,在活體小鼠中,盡管由于血流、呼吸和肌肉抽搐而導(dǎo)致組織自然運動,但顯微鏡仍然能以每秒超過10個體積的最大成像速度,在大面積組織(跳動的心臟中的腎臟、癌變胰腺和肌肉,盡管其頻率約為自由行為小鼠的 10%)上產(chǎn)生了清晰的高對比度掃描。
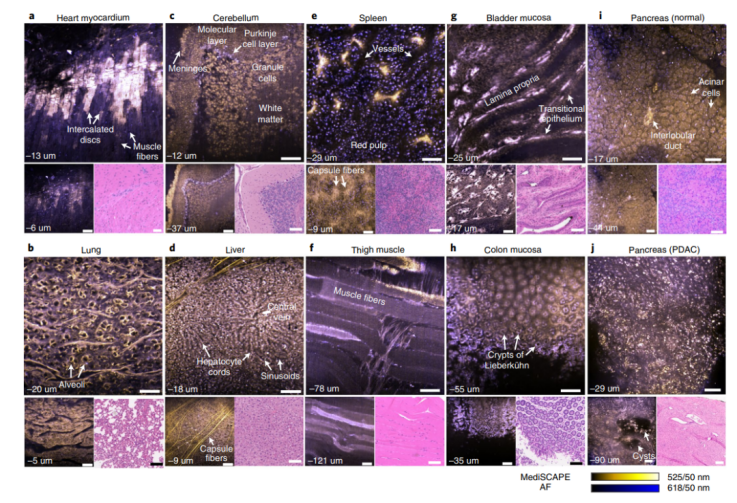
圖|使用 MediSCAPE 對各種新鮮小鼠組織進行無標記成像
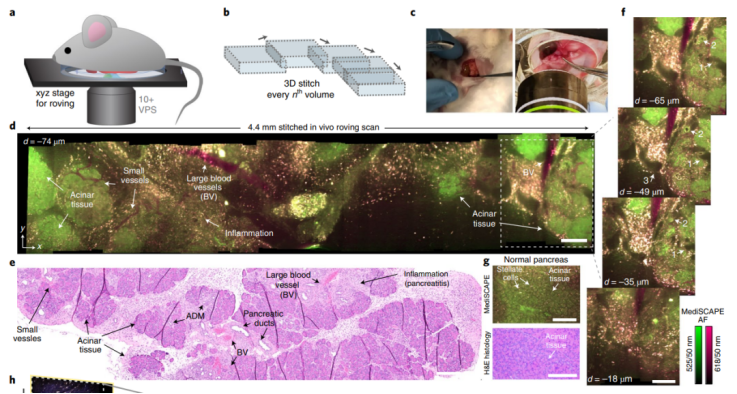
活體小鼠,胰腺疾病和心臟跳動的無標記巡回采集
可用于病理切片
通過圖像“拼接”,作者還表明,腎切除術(shù)后的人體腎臟圖像可以顯示預(yù)期的病理特征,正如組織病理學(xué)所證實的那樣。此外,顯微鏡可以通過將微囊與萎縮性小管明確區(qū)分開來進行診斷。當(dāng)只有經(jīng)典的組織切片可用時,這項診斷任務(wù)很難執(zhí)行。
具有臨床適用性
為了探索微型手持系統(tǒng)的潛在臨床適用性,研究人員對志愿者的舌頭和嘴唇進行了成像,以識別這些組織的特征性功能結(jié)構(gòu)。作者還展示了臺式系統(tǒng)對活體小鼠組織成像的能力的三個演示:注入熒光示蹤劑后大腦中微血管灌注的成像揭示了細節(jié),包括毛細血管中血流的單紅細胞分辨率;內(nèi)源性自發(fā)熒光顯示腎臟缺血和再灌注的影響;該系統(tǒng)的高時間分辨率允許對熒光示蹤劑通過腎臟并進入其近端小管的過濾進行成像。能夠在單個功能元素(小鼠腎臟中有超過 15,000 個功能元素)水平上實時執(zhí)行腎臟生理學(xué)尤其令人印象深刻。

圖|小鼠大腦和腎臟的體內(nèi)功能成像
綜上,該研究進一步優(yōu)化的醫(yī)療 SCAPE 系統(tǒng)將使實時組織可視化變得更加容易,并最終可能成為基于圖像的診斷設(shè)備的一部分。例如,它們可以實時觀察用于識別癌癥患者前哨淋巴結(jié)的熒光示蹤劑(如吲哚菁綠)的引流情況。
參考文獻:
1.Patel, K.B., Liang, W., Casper, M.J. et al. High-speed light-sheet microscopyfor the in-situ acquisition of volumetric histological images of living tissue.Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00849-7
2.Gunzer, M. Fast volumetric scanning of living tissue. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00894-2











