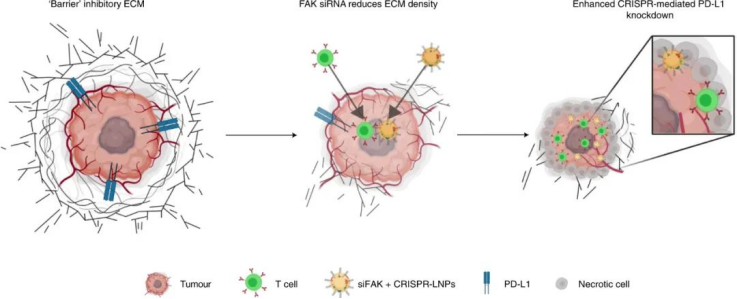
使用穩(wěn)健且可編程的CRISPR/Cas系統(tǒng)對癌癥相關(guān)基因進(jìn)行體內(nèi)失效或修復(fù)是一種令人興奮的癌癥治療方法。然而,基于CRISPR的實體瘤療法面臨著重大的障礙。1)首先是癌癥的無限復(fù)制潛力,因此編輯少量細(xì)胞將無法逆轉(zhuǎn)疾病癥狀。2)第二個是腫瘤微環(huán)境獨特的僵硬和纖維化基質(zhì)。因此,物理致密的腫瘤微環(huán)境成為腫瘤治療的障礙,這阻止了納米顆粒進(jìn)入腫瘤中接觸到更多的腫瘤細(xì)胞以抑制癌細(xì)胞復(fù)制潛能,并且阻礙了免疫細(xì)胞滲透到腫瘤組織中。由于豐富的 ECM,腫瘤微環(huán)境表現(xiàn)出剛性,從而增強了微環(huán)境的內(nèi)在力學(xué)性能。反過來,ECM 在腫瘤中經(jīng)歷細(xì)胞誘導(dǎo)的變形。癌癥和基質(zhì)細(xì)胞可以對 ECM 施加相當(dāng)大的肌動球蛋白產(chǎn)生的力,這有助于增加 ECM 剛度。在涉及粘著斑激酶 (FAK) 激活的過程中,這些“由內(nèi)而外”傳遞的張力主要由附著細(xì)胞的整合素依賴性粘附介導(dǎo)。因此,靶向腫瘤組織中的 FAK 可以調(diào)節(jié)腫瘤細(xì)胞、基質(zhì)細(xì)胞和腫瘤 ECM 的機械特性。此外,抑制 FAK 活性可調(diào)節(jié)腫瘤免疫環(huán)境,導(dǎo)致 CD8+ 細(xì)胞毒性 T 細(xì)胞浸潤升高。然而,浸潤的 T 細(xì)胞會被腫瘤細(xì)胞上的PD-L1過表達(dá)抑制,PD-L1 通過向免疫系統(tǒng)發(fā)送關(guān)鍵的“找不到我”信號來抑制 T 細(xì)胞反應(yīng)。鑒于此,德克薩斯大學(xué)西南醫(yī)學(xué)中心Daniel J. Siegwart等人開發(fā)了一種復(fù)合納米粒子 siRNA+Cas9mRNA+sgRNA方法來降低腫瘤力學(xué)和細(xì)胞外基質(zhì) (ECM) 硬度,增強納米粒子內(nèi)吞作用和組織滲透,并降低治療性修飾閾值,使基因編輯療法能夠為患有侵襲性腫瘤的基因工程小鼠提供顯著的生存益處。

摘要圖
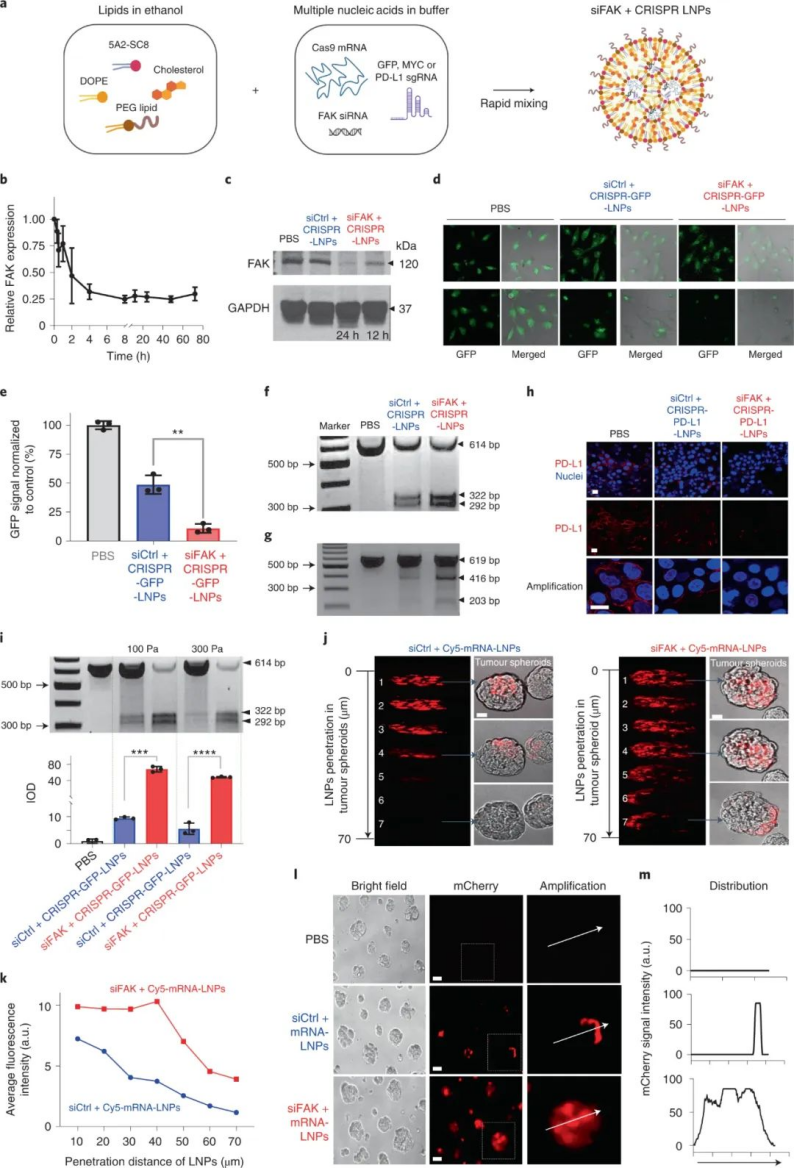
研究人員將 siRNA(抗FAK)、mRNA(Cas9)和靶向 sgRNA 共同包裝到自組裝脂質(zhì)納米顆粒(LNP)中,以解決癌癥治療的兩個關(guān)鍵障礙(僵硬的 ECM 和 PD-L1 過表達(dá))。基于該課題組先前發(fā)表在Nature Nanotechnology(點擊鏈接查看:Nature Nanotech:器官選擇性靶向納米顆粒,去哪個器官它來sort(附專訪))上的研究,研究人員選用可以特異性靶向肝臟的可離子化氨基脂質(zhì)樹狀大分子5A2-SC8,來結(jié)合帶負(fù)電荷的RNA,構(gòu)建了自組裝LNP(siFAK+CRISPR LNPs),并對其質(zhì)量比進(jìn)行優(yōu)化(5A2-SC8:膽固醇:DOPE:DMG-PEG2000:DSPE-PEG2000=15:30:15:2:1),從而導(dǎo)致靶向 LNP 能夠以高 RNA 封裝效率裝載三重RNA。此外,該LNP由于內(nèi)體pH下降而改變電荷,從而促進(jìn)細(xì)胞攝取LNP后的內(nèi)體逃逸。

細(xì)胞實驗表明,復(fù)合LNP 成功地將所有三種類型的核酸遞送至人類癌細(xì)胞系,以實現(xiàn)高效的基因沉默和基因組編輯,總體基因編輯增強了> 10 倍。值得注意的是,研究人員還發(fā)現(xiàn)了一個有趣的現(xiàn)象,即 FAK 敲低顯著增強了納米顆粒在多個腫瘤細(xì)胞系中的基因編輯功效。此外,在細(xì)胞球?qū)嶒炛斜砻鳎現(xiàn)AK 敲低可以克服腫瘤球的物理障礙并顯著增加 RNA的遞送。圖|FAK 敲低增強了 LNP 介導(dǎo)的 mRNA 傳遞和 CRISPR 基因編輯為了研究 FAK 敲低如何增強 siFAK + CRISPR-LNPs 的基因編輯功效的機制,研究人員進(jìn)行了細(xì)胞攝取途徑實驗,結(jié)果發(fā)現(xiàn)FAK 沉默主要通過調(diào)節(jié)網(wǎng)格蛋白和小窩依賴的內(nèi)吞途徑增加 LNP 的細(xì)胞攝取。膜內(nèi)陷和內(nèi)吞作用是這兩種途徑的主要步驟,涉及由肌動蛋白絲(F-肌動蛋白)和肌動球蛋白網(wǎng)絡(luò)產(chǎn)生的張力調(diào)節(jié)的膜張力。進(jìn)一步研究發(fā)現(xiàn),用siFAK +CRISPR-LNPs處理的細(xì)胞應(yīng)力纖維和肌動球蛋白網(wǎng)絡(luò)均減少,這表明其處理的細(xì)胞收縮力明顯降低。因此,siFAK+CRISPR-LNPs 通過降低收縮力以增強細(xì)胞納米顆粒的內(nèi)吞作用和滲透。
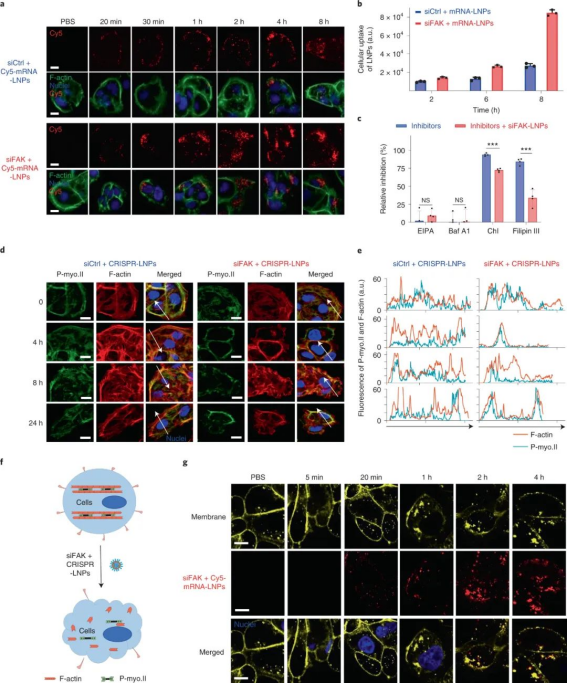
圖|FAK 敲低通過動態(tài)改變收縮力和細(xì)胞膜張力來增強 siFAK?+?CRISPR-LNPs 的內(nèi)吞作用
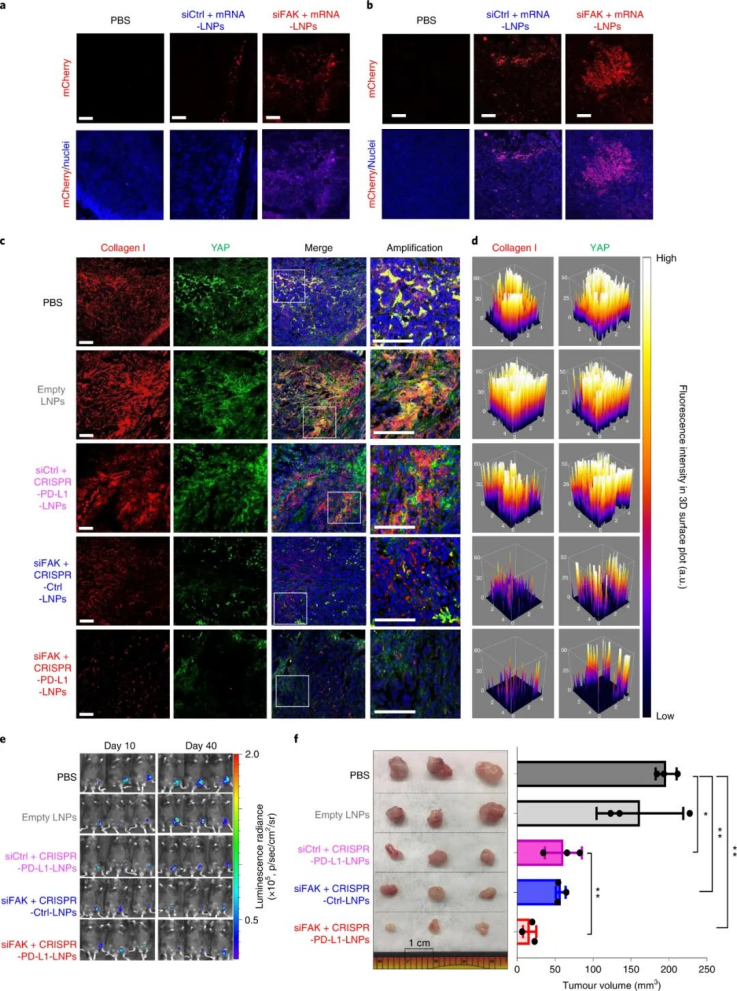
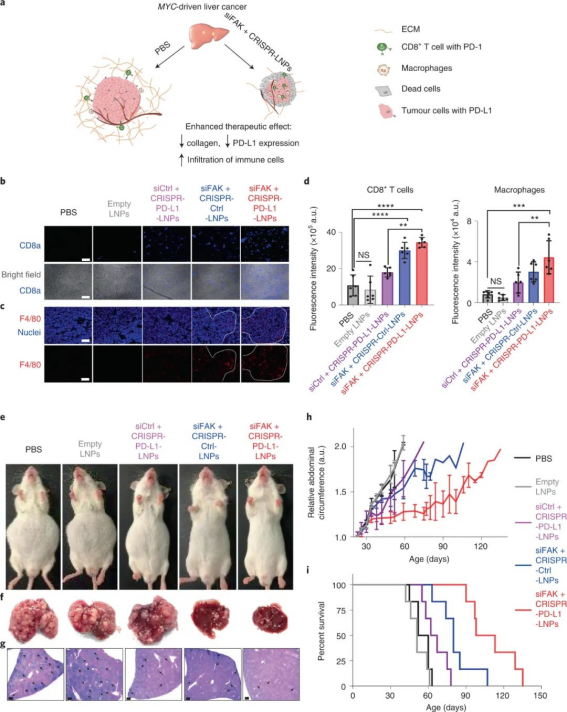
FAK在幾種晚期實體癌中過度表達(dá),尤其是卵巢癌,這會增加腫瘤細(xì)胞的收縮力和 ECM 的硬度。因此,研究人員評估了 siFAK +CRISPR-PD-L1-LNPs 的基因編輯和抗腫瘤功效。實驗結(jié)果證明,通過 FAK敲低調(diào)節(jié) ECM硬度有利于PD-L1的基因編輯,從而顯著抑制腫瘤生長。此外,復(fù)合LNP還降低了卵巢癌小鼠轉(zhuǎn)移模型中的潛在轉(zhuǎn)移,改善了異種移植腫瘤小鼠模型中的癌癥治療,并顯著延長了MYC驅(qū)動的侵襲性轉(zhuǎn)基因肝癌小鼠模型中的生存期。研究人員還發(fā)現(xiàn)了,使用 siFAK +CRISPR-PD-L1-LNP 治療的小鼠腫瘤中浸潤的 CD8+ T 細(xì)胞和巨噬細(xì)胞數(shù)量也顯著增加。圖|siFAK?+?CRISPR-PD-L1-LNPs靶向腫瘤硬度和PD-L1抑制異種移植腫瘤生長圖|siFAK?+?CRISPR-PD-L1-LNPs的全身給藥顯著延長了攜帶侵襲性、MYC驅(qū)動癌癥的小鼠的生存期綜上所述,該研究提供的證據(jù)表明,通過調(diào)節(jié)腫瘤組織的硬度可以增強腫瘤中的基因編輯,這種多路復(fù)用、可推廣的策略可用于各種癌癥類型的各種癌癥靶點,為使用 CRISPR 基因編輯治療癌癥提供一種新方法。Zhang, D., Wang, G., Yu, X. et al. Enhancing CRISPR/Cas gene editing throughmodulating cellular mechanical properties for cancer therapy. Nat. Nanotechnol.(2022).https://doi.org/10.1038/s41565-022-01122-3

DanielJ. Siegwart是德克薩斯大學(xué)西南醫(yī)學(xué)中心的副教授。他的研究計劃專注于開發(fā)先進(jìn)的基于聚合物和脂質(zhì)的系統(tǒng),該系統(tǒng)可精確控制大分子的結(jié)構(gòu)、順序和響應(yīng)性,以用于藥物輸送、成像、遺傳疾病和癌癥。他是ReCode Therapeutics公司的共同創(chuàng)始人,致力于修飾tRNA負(fù)載的納米顆粒,用于糾正引起囊性纖維化和其他疾病的無義突變。