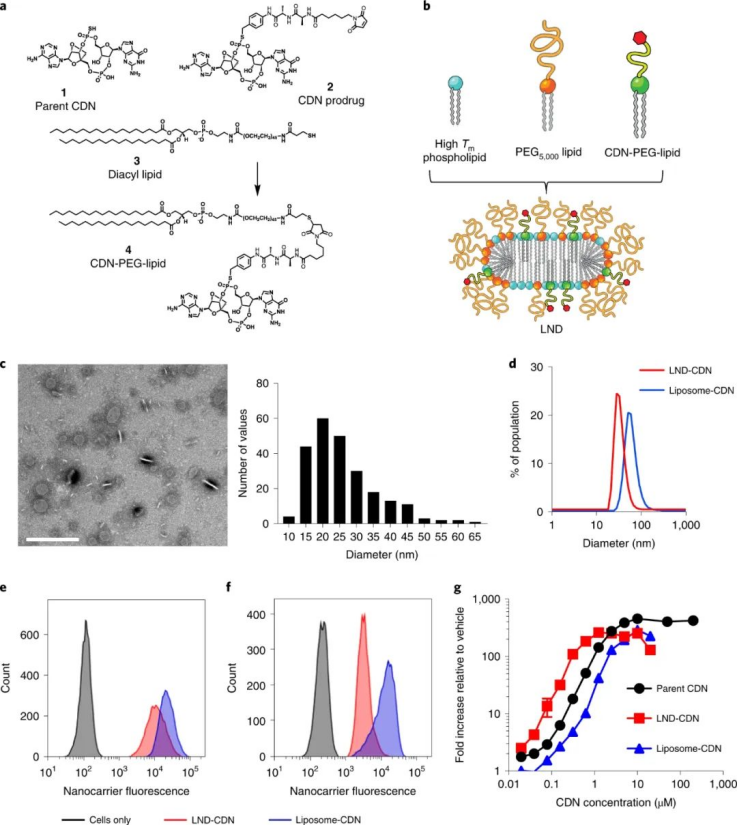
過去幾年,癌癥免疫療法取得了巨大的成功,它利用患者的免疫系統進行癌癥治療。免疫檢查點阻斷療法、嵌合抗原受體 T 細胞療法、溶瘤病毒、雙特異性抗體和癌癥疫苗已經徹底改變了癌癥治療,許多新的免疫治療策略目前正在臨床和臨床前研究中。然而,這些免疫療法仍然面臨的一個重大障礙是到達致密腫瘤組織的免疫抑制區域。因此,環狀 GMP-AMP 合成酶(cGAS)-干擾素基因刺激因子(STING) 途徑已成為癌癥免疫治療的有希望的靶點。已經發現和開發了許多天然和合成的 STING 激動劑。這些激動劑已在臨床前模型和臨床癌癥免疫治療中進行了測試。環狀二聚核苷酸 (CDN),如環狀二聚體單磷酸鳥苷 (c-di-GMP)、環狀二聚體單磷酸腺苷 (c-di-AMP) 和環狀 GMP-AMP (cGAMP),是一類可引發強免疫反應。然而,使用CDN 進行癌癥免疫治療存在三個主要挑戰。1)天然 CDN 是親水性小分子,帶高負電荷,不能穿過細胞膜。2)CDN 具有非標準的2',5'-磷酸二酯鍵和或標準的 3',5' 鍵(c[G(2',5')pA(3',5')p]),易受酶降解,導致靶組織生物利用度低。3)最后,將CDN 直接遞送至腫瘤組織具有挑戰性,因為脫靶組織中的 STING 激活會誘導毒性,從而導致治療窗口狹窄。鑒于此,麻省理工學院Darrell J. Irvine等人利用CDN結合脂質納米盤(lipid nanodisc, LND)解決了這些局限性,與金標準球形脂質體相比,LND可改善癌癥免疫治療。成果發表在Nature Materials上!
圖|脂質納米圓盤用于癌癥免疫療法
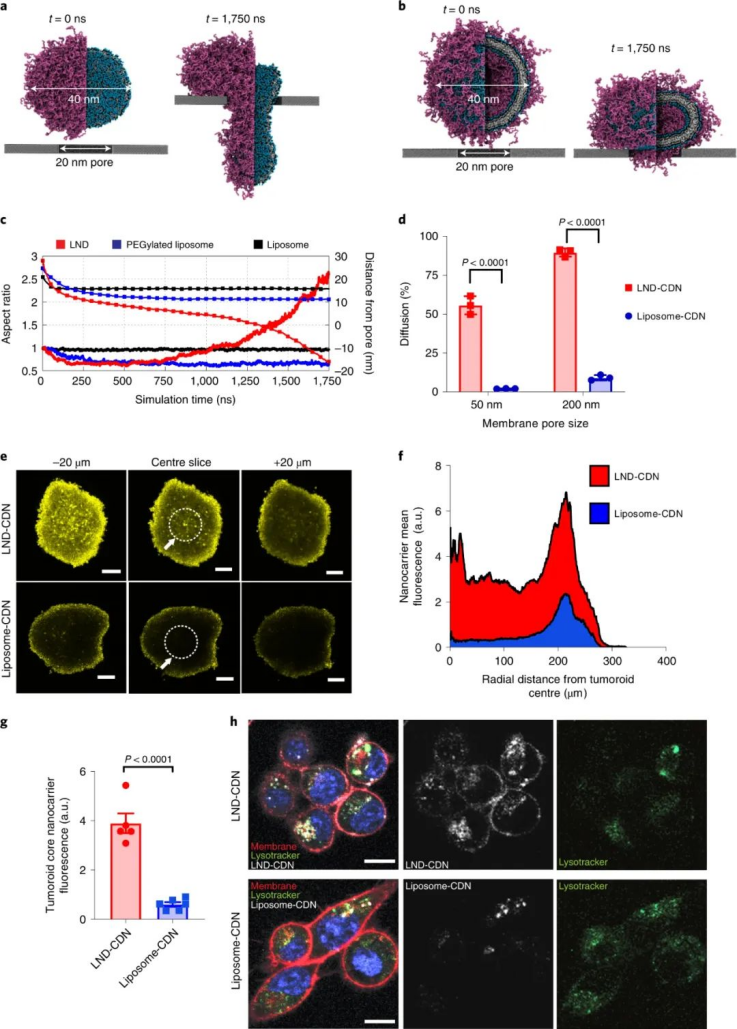
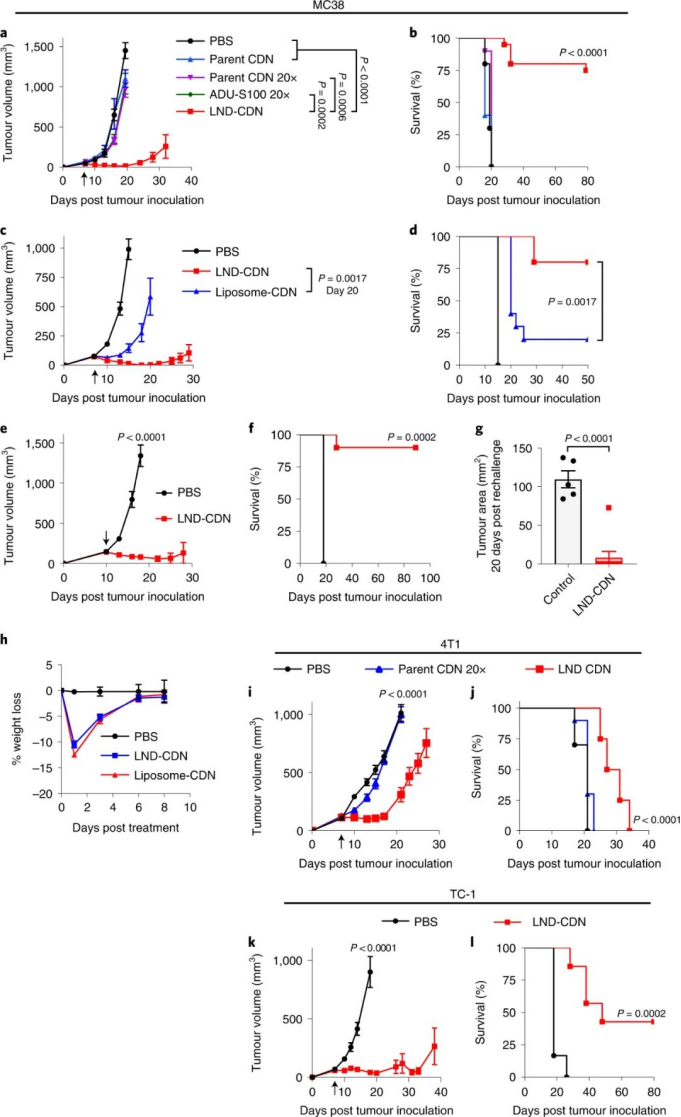
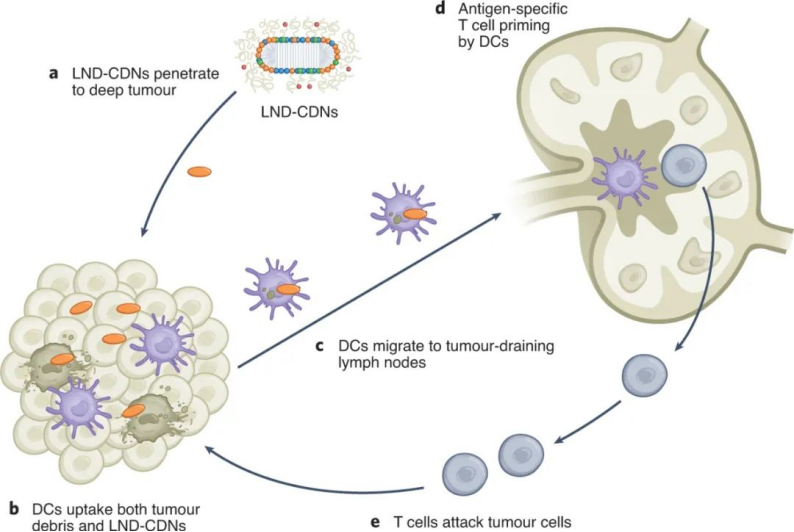
該課題組合成了一種CDN前體藥物,通過將CDN與LND的聚乙二醇(PEG)脂質成分連接在一起,并使用一個在細胞攝取時被細胞內蛋白酶切割的肽連接體。與正常細胞相比,這種蛋白酶在腫瘤細胞中高度表達,這確保了腫瘤細胞中CDN釋放的增加和靶向毒性的降低。與游離CDN相比,LND-CDN大大提高了CDN的半衰期。圖|用于 STING 激動劑遞送的納米顆粒的設計和表征與使用脂質體遞送的CDN相比,在小鼠體內全身施用LND CDN可實現CDN在整個腫瘤組織中的更大聚集,以到達垂死的腫瘤細胞和DC。與球形脂質體相比,由于LND的高寬高比和獨特形狀,使得LND具有更大的靈活性,增強了腫瘤的穿透力。重要的是,這使得在DC遷移到腫瘤引流淋巴結之前,腫瘤和淋巴中的DC可以同時吸收LND-CDN和腫瘤碎片,其中DC提供腫瘤抗原以引發長期適應性免疫反應。因此,這種療法能夠誘導原位抗腫瘤疫苗接種。圖|與脂質體-CDN 相比,LND-CDN 在體外顯示出優異的被動擴散和腫瘤穿透性然后,研究人員在三種不同的腫瘤模型(這些模型使用了來自相同小鼠品系的腫瘤細胞)中測試了單劑量療法,研究人員發現 LND-CDN 在 MC38 結腸癌小鼠模型中實現了約 80% 的腫瘤排斥,在4T1乳腺癌小鼠模型中,中位生存時間增加了約50%。然而,當使用LND-CDN治療攜帶 MC38 腫瘤的 STING-/- 小鼠卻完全無效,這證實了 STING在這種治療方法中的作用。圖|單劑量的 LND-CDN 在多種同基因腫瘤模型中顯示出治療效果令人驚訝的是,LND-CDNs 僅在小鼠中引起短暫的體重減輕,在幾天內恢復,在給藥劑量下沒有出現主要器官毒性的跡象。總之,這些小鼠模型證實了 LND-CDN 能夠誘導急性腫瘤縮小,同時啟動適應性免疫系統以產生強大的抗腫瘤反應。綜上所述,這些結果拓展了癌癥治療領域,因為這種脂質納米圓盤平臺可以潛在地用于將一系列的其他治療貨物輸送到腫瘤中。例如,攜帶在腫瘤中積累的化療藥物的 LND 可能會在降低毒性的同時增強抗腫瘤功效;提供成像方式的 LND 有助于早期腫瘤診斷;攜帶編碼細胞因子、檢查點阻斷劑或其他腫瘤抑制蛋白的信使 RNA (mRNA) 的 LND 可能會產生更好的抗腫瘤結果。此處描述的 LND-CDN 的主要優勢之一是,與球形脂質體相比,由于其蛋白酶響應的連接頭和獨特的形態,它可以誘導腫瘤細胞中更高的 CDN 積累。這可以減輕系統性遞送治療性貨物的潛在脫靶效應。此外,探索這種非靶向 LND 和被動腫瘤積累方法與用主動靶向配體(如單克隆抗體)進一步功能化的制劑相比,將會很有趣。未來的工作還應解決 CDN 是否輔助針對納米盤的 PEG 成分的體液反應,這可能會誘導抗 PEG 抗體反應,從而導致納米盤的快速清除。這種反應可以通過用 PEG 替代品代替 PEG 來避免,例如目前在納米醫學和生物材料領域正在研究的其他兩性離子聚合物。雖然需要進一步研究以充分利用 LND 用于癌癥免疫治療的潛力,但與傳統的球形脂質體載體相比,LND 平臺在治療效果方面取得了顯著進步。1.Dane, E.L., Belessiotis-Richards, A., Backlund, C. et al. STING agonistdelivery by tumour-penetrating PEG-lipid nanodiscs primes robust anticancerimmunity. Nat. Mater. (2022).https://doi.org/10.1038/s41563-022-01251-z2.Gong, N., Mitchell, M.J. Lipid nanodiscs give cancer a STING. Nat. Mater.(2022).https://doi.org/10.1038/s41563-022-01270-w

Darrell Irvine ,麻省理工學院教授和霍華德休斯醫學研究所研究員。其研究重點是工程工具在細胞免疫學問題上的應用以及疫苗和藥物遞送新材料的開發。目前的努力集中在與 HIV 疫苗開發和癌癥免疫治療相關的問題上。這項跨學科工作已獲得眾多獎項的認可,包括貝克曼青年研究員獎、美國國家科學基金會職業獎、TR35等獎項。發表Nature、Science、Nature Materials、Nature Biotechnology、Nature Biomedical Engineering等70多篇研究論文,并擁有眾多專利。以下列出該課題組近年來在高水平期刊上發表的部分研究成果