研究背景:
自2019年新冠病毒疫情爆發以來,全球已有至少36款疫苗被批準。然而,這些疫苗大多通過肌肉注射途徑來激活全身性免疫反應,無法特異性引起肺粘膜免疫。特別是對于目前推出上市的mRNA疫苗,還需要低溫儲存或運輸條件來保障其有效性,這大大提高了疫苗成本。因此,開發能夠激活肺粘膜免疫反應且不需低溫儲存的新冠疫苗至關重要。
基于此,北卡羅來納州立大學的的程柯和李振華等人報道了一種可吸入的重組SARS-CoV-2受體結合域(RBD)修飾的外泌體疫苗RBD-Exo,用于激活高效的肺粘膜免疫。該研究表明,RBD-Exo吸入疫苗被證明可在室溫穩定儲存3個月以上。在小鼠及倉鼠感染模型中,兩劑吸入疫苗可引起肺部粘膜特異性IgG和IgA抗體反應,并激活肺部CD4+和CD8+細胞的增殖及Th1型細胞因子的分泌,最終成功抑制病毒感染進展。因此,該吸入疫苗具有較好的預防新冠病毒的應用潛力。
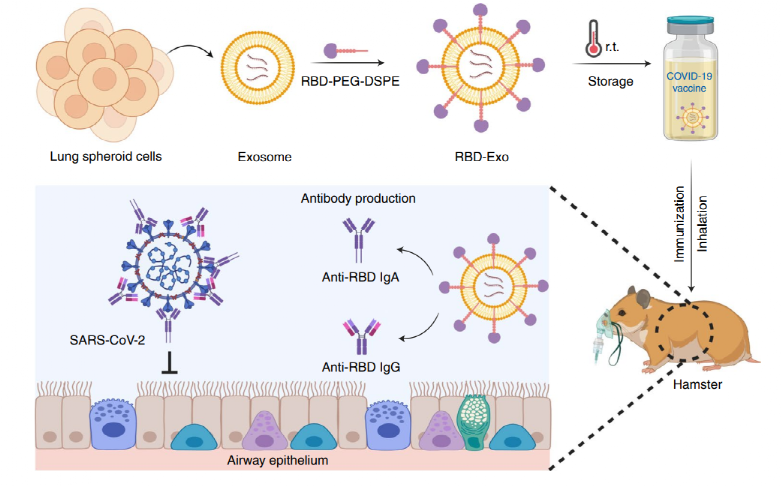
圖 RBD-Exo吸入疫苗的設計與預防機制
外泌體具有相對脂質體更優良的肺滯留特性
目前用于新冠疫苗遞送的多為脂質納米顆粒載體,但是其難以實現靶細胞特異性遞送。由于該課題組前期已成功制備肺球樣細胞(LSCs)來源的可吸入外泌體用于特發性肺纖維化的治療,該外泌體具有高度的肺部細胞同源靶向性,有望實現更優的肺部遞送與滯留。以CD1小鼠為模型的體內分布研究結果表明,該外泌體在霧化吸入4 h后可遞送至氣管及細支氣管,并在24 h后大量分布于肺實質中,表現出比商用脂質體更優良的肺部遞送性能。此外,該吸入外泌體可更多的被樹突狀細胞所攝取,具有作為疫苗遞送載體來激活抗原呈遞的潛力。
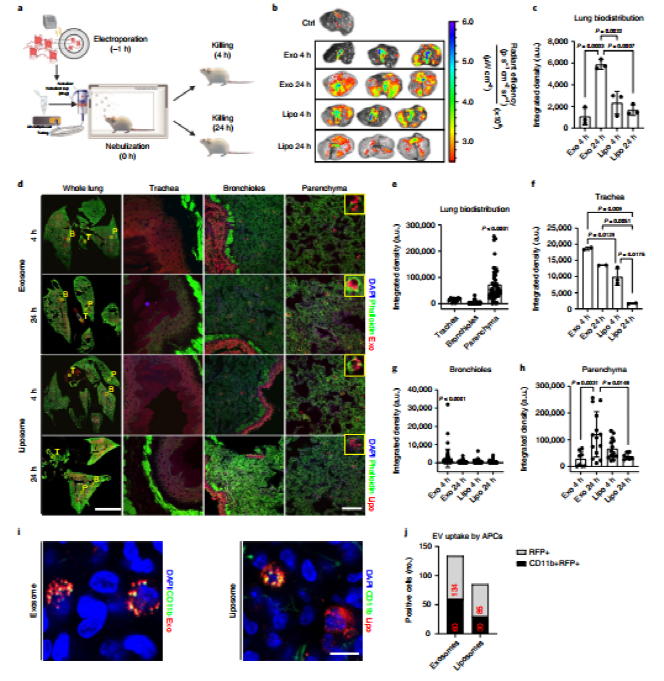
圖 商用脂質體與外泌體的肺遞送性能
RBD-Exo疫苗的制備與表征
在證明了吸入外泌體優良的肺部遞送性能后,進一步將RBD與DSPE-PEG共價結合獲得RBD-PEG-DSPE,并將其修飾于LSC-Exo表面獲得RBD-Exo。通過TEM和免疫印跡法證明了RBD-Exo的成功制備,在裝載前后其粒徑從約136.7±4.2 nm略增長至145.3±4.1 nm,所得到的每1010個RBD-Exo中可裝載約0.52 μg RBD。進一步, 作者檢驗了RBD-Exo在-80℃、4℃、室溫3周和室溫3個月的儲存穩定性。通過分析儲存后RBD-Exo的形貌、粒子濃度、粒徑和RBD裝載量等關鍵參數,證明RBD-Exo在室溫條件儲存3個月后依然可以保持結構和生物穩定性,顯示出卓越的儲存穩定性。此外,在C57BL/6小鼠模型中,作者發現相對于游離RBD,RBD-Exo提高了B細胞、巨噬細胞和樹突狀細胞(DCs)等抗原呈遞細胞(APCs)對其的識別攝取,其中DCs是吞噬其的主要APCs。
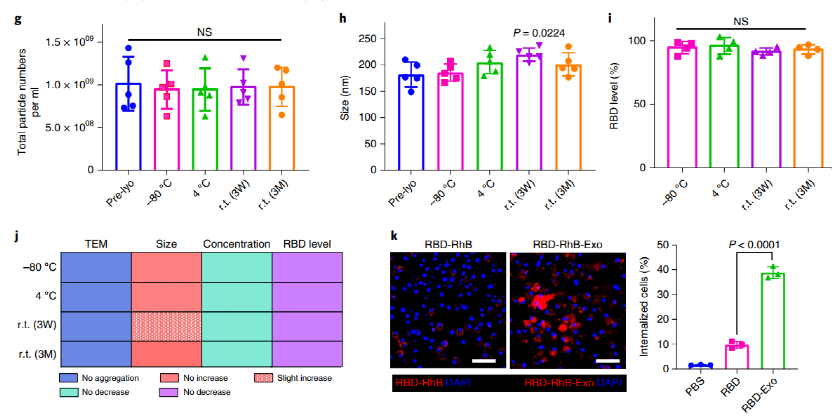
圖 RBD-Exo的儲存穩定性
RBD-Exo疫苗激活系統性和肺粘膜免疫反應
對CD1小鼠進行兩劑吸入疫苗接種后,小鼠被氣管內給予SARS-CoV-2模擬病毒感染,研究RBD-Exo吸入疫苗的抗病毒療效和機制。結果顯示,相對于靜脈注射組,吸入RBD-Exo顯著提高了病毒清除速率。血清抗體分析表明,吸入RBD-Exo顯示出最高的血清RBD特異性抗體生成水平。對抗體亞型進一步分析證明靜脈注射RBD-Exo激活Th2型免疫反應,而吸入RBD-Exo激活Th1型免疫反應。以上結果均表明吸入RBD-Exo疫苗可激活針對RBD的系統性免疫反應。接著,對鼻咽灌洗液(NPLF)和支氣管肺泡灌洗液(BALF)中的RBD特異型IgA水平檢測結果顯示,靜脈注射RBD-Exo組難以激活肺粘膜免疫反應,而吸入RBD-Exo組在NPLF和BALF中均可以激活最高水平的抗體產生,證明其可以誘發肺部粘膜免疫反應。對肺部CD4+和CD8+ T細胞分析表明,相對于游離RBD組,RBD-Exo組可誘導高水平Th1型細胞因子陽性T細胞(IFN-γ, IL-4和IL-17a)的增殖分化,且室溫長期儲存后的RBD-Exo顯示出相似水平的免疫激活效應,證明其良好的儲存穩定性。
進一步分析RBD-Exo是否能夠激活脾臟免疫細胞產生細胞因子。結果顯示,RBD-Exo吸入疫苗可顯著提高小鼠體內IFN-γ,TNF-α和IL-6等促炎因子的水平,顯示出比靜脈注射更優良的免疫刺激效果。提取小鼠脾臟中的免疫細胞進行分析,RBD-Exo組和長期儲存的RBD-Exo組能夠刺激更大量的Th1型細胞因子陽性T細胞的增殖分化,且均優于游離RBD組。
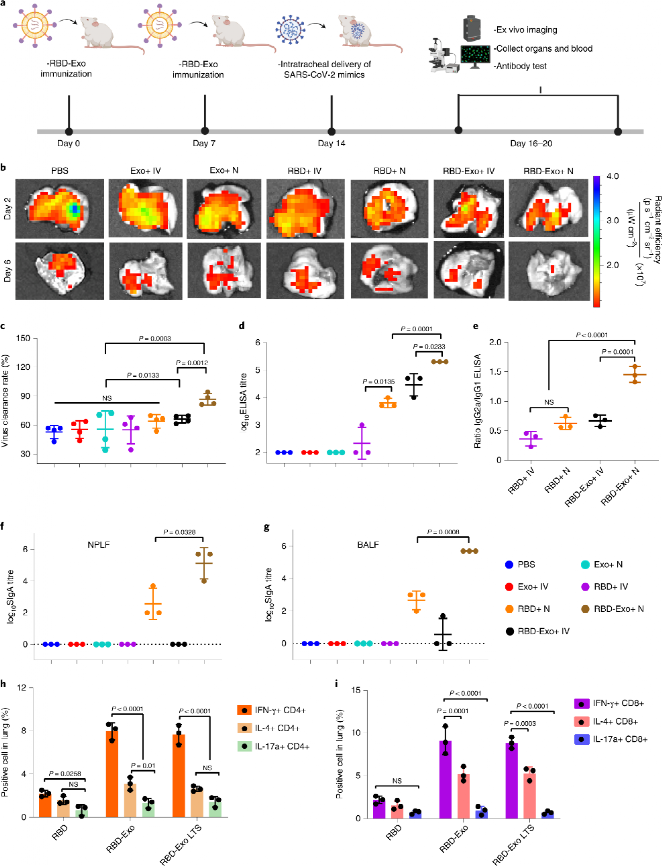
圖 RBD-Exo疫苗接種激活免疫反應加快病毒清除
RBD-Exo疫苗預防大劑量SARS-CoV-2病毒感染
接著,在倉鼠模型中檢驗RBD-Exo預防病毒感染的效果。在兩劑吸入疫苗接種后氣管內給予感染劑量的活病毒,而后對其咽拭子和肺泡灌洗液中的病毒RNA進行檢測。結果表明,在接種病毒4天后RBD-Exo組即可顯示出相對PBS組和游離RBD組更低的病毒檢出量,證明其優異的預防性能。RBD-Exo組在給予病毒前后均顯示出最高的RBD特異性血清抗體滴度水平。肺組織的HE和Masson染色均表明RBD-Exo吸入疫苗組顯著減輕肺炎癥浸潤水平和病灶結節數量。
接著,對肺組織進行多種染色以直觀表征病毒分布情況。SARS核衣殼蛋白染色和全角蛋白染色共同表明病毒分布于多灶性肺細胞和肺泡間隔,且RBD-Exo組顯著降低肺病毒水平。此外,采用原位RNA雜交法(RNAscope)檢測肺部SARS-CoV-2病毒RNA,也證明了RBD-Exo組降低病毒水平的作用。此外,多種組織學染色也證明RBD-Exo可降低病毒水平,減輕炎癥浸潤。
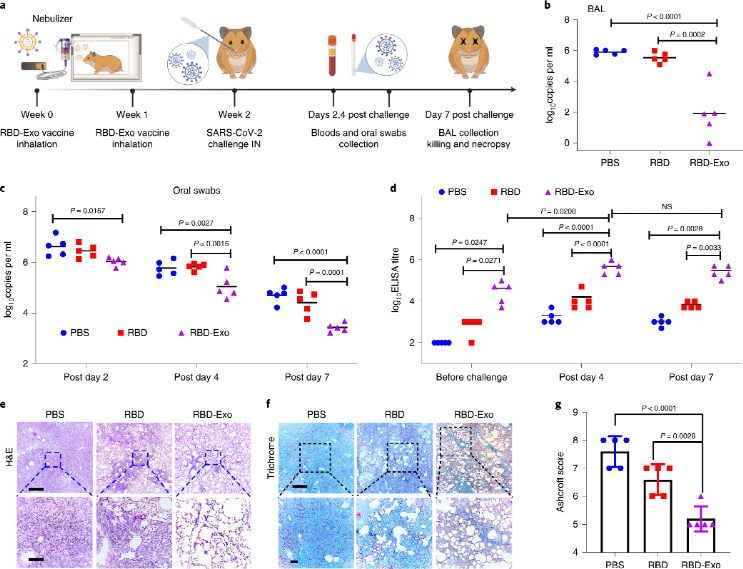
圖 RBD-Exo在倉鼠SARS-CoV-2感染模型中的預防作用
RBD-Exo吸入疫苗的交叉保護活性
接著,采用更具感染性的SARS-CoV-2 D614G突變株研究RBD-Exo吸入疫苗的抗交叉感染效果。結果表明,接種RBD-Exo吸入疫苗后可顯著降低全肺內病毒水平,包括氣管、支氣管和肺實質組織,且長期儲存不影響疫苗效果。建立體外SARS-CoV-2感染模型以研究其交叉保護機制,將原代小氣道上皮細胞與原代支氣管/氣管上皮細胞共培養于Traswell系統,以評估不同來源IgA的阻斷活性。結果顯示,RBD-Exo 吸入疫苗接種小鼠來源的IgA有效地抑制了SARS-CoV-2 D614G對支氣管/氣管細胞的感染。此外,對疫苗接種小鼠來源的IgA和IgG抗體中和病毒的能力進行比較,結果顯示二者的IC50分別為53.6 ng/ml和65.4 ng/ml,表明IgA比IgG抗體具有更高的交叉活性。
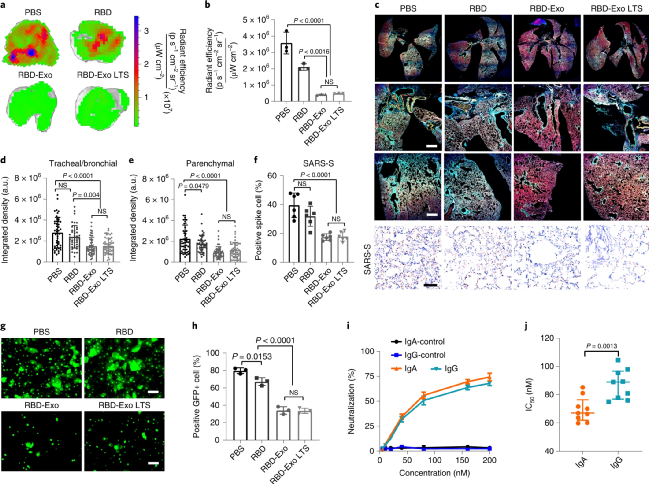
圖 RBD-Exo吸入疫苗交叉保護SARS-CoV-2 D614G突變株感染
小結與展望
綜上所述,本研究設計制備了一種可吸入的基于外泌體的疫苗體系RBD-Exo,可通過激活肺粘膜免疫反應,大量激活RBD特異性抗體生成,調節T細胞增殖分化,從而有效防止病毒感染,減輕肺部病變。相對于目前上市的疫苗產品,RBD-Exo不僅提高肺部遞送效率,還能在室溫下穩定儲存3個月,大大降低疫苗接種成本,具有較大的應用潛力。
然而,該研究還有一些不足之處有待解決。
1)首先是外泌體的大規模生產頗具挑戰,特別是RBD表面修飾的大批量生產穩定性難以保持。
2)此外,由于DSPE-PEG-NHS與RBD存在空間位阻效應,其接枝效率也需進一步提高。
3)另外,由于呼吸系統基礎疾病患者的呼吸功能障礙,這種吸入型疫苗可能難以適用于該類人群。但是,這種室溫穩定的吸入型疫苗為未來的疫苗開發提供了新的思路。
參考文獻:
Wang, Z., Popowski, K.D., Zhu, D. et al. Exosomes decorated with a recombinant SARS-CoV-2 receptor-binding domain as an inhalable COVID-19 vaccine. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00902-5











