自組裝,又一篇Nature Chemistry!
Ai pingping
納米人
2022-07-22
作者:Ai pingping
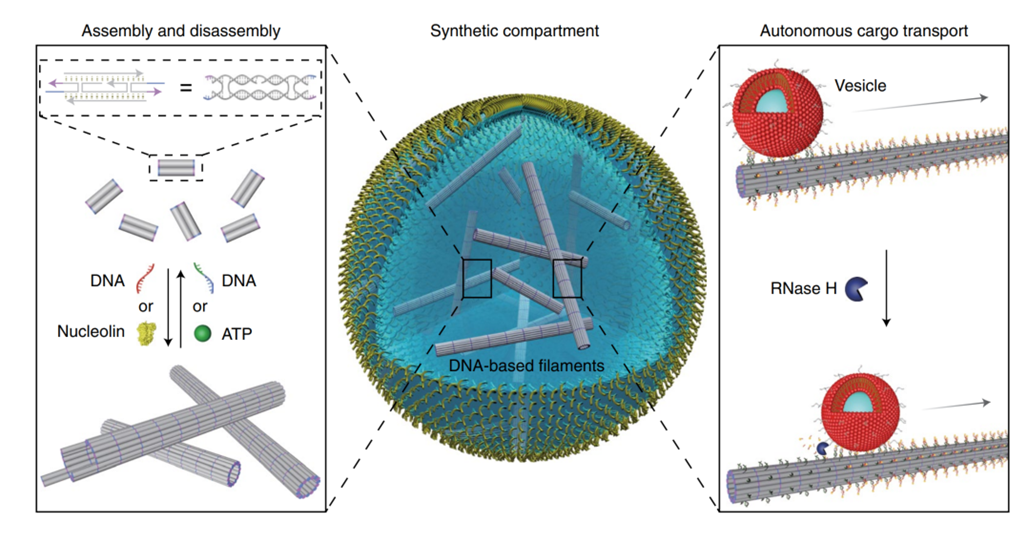
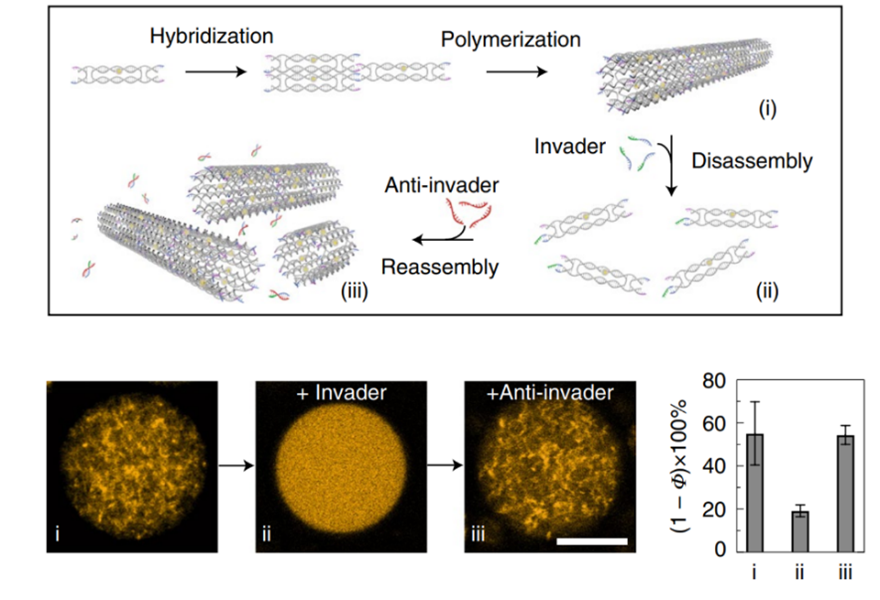
自下而上地實現人工細胞合成一直是許多合成生物學家熱衷研究的方向,但也一直存在著諸多挑戰。而細胞骨架作為組成細胞的重要元件,它控制著細胞形狀,有序地排布內部細胞器,并執行重要的生物學功能。因此,人工合成細胞骨架對于合成細胞來說是至關重要的一步。近日,德國馬克斯-普朗克研究所醫學研究機構的Kerstin G?pfrich教授與固體研究的Na Liu教授合作,在Nature Chemistry上發表了題為“Functional DNA-based cytoskeletons for synthetic cells”的研究文章,報道了基于DNA納米技術構建的具有一定功能的細胞骨架。這個合成的細胞骨架系統可以模擬許多自然細胞骨架的特點,包括可逆地自組裝過程和ATP驅動的聚合過程,同時,他們還在細胞大小的水平上實現了該骨架系統用于指導囊泡運輸的可能性。圖1 用于合成細胞的基于DNA的功能化細胞骨架系統1.使用基于立足點的鏈取代方式來實現DNA微管的組裝和解聚首先,他們設計了像圖1一樣含有四個粘性末端的DNA瓦片結構,這四個粘性末端最后會使得DNA瓦片結構自組裝形成管狀結構。共聚焦顯微鏡下可以看到該結構的形成,且原子力顯微鏡顯示,該結構平均直徑在12nm。進一步地,他們在DNA瓦片結構中引入一段立足點序列,通過立足點介導的鏈取代方式,在加入侵入鏈之后,該細絲結構將發生去組裝,再引入與入侵鏈互補的反義入侵鏈,又可以使得重新發生自組裝的過程,形成細絲骨架結構(如圖2所示)這個組裝和去組裝的過程可以在10分鐘之內發生。圖2 細胞大小層面上基于DNA的細絲骨架結構的組裝與去組裝過程接下來,為了在這個系統中引入生物學相關的元素從而更好模擬真正的細胞骨架,他們基于核酸適配體設計出了ATP響應的組裝和去組裝過程。在如圖3a的設計方案中,有ATP的條件下DNA瓦片會自組裝成管狀細絲結構。但是由于ATP和ATP適配體之間的親和力比基于立足點的雙鏈互補的親和力低很多,基于ATP的自組裝過程需要40分鐘并且ATP的濃度相較于入侵鏈需要高幾個數量級。作者同時也證實,基于DNA的骨架與基于肌動蛋白的骨架在組裝動力學上十分接近,但是基于肌動蛋白的骨架細絲的聚合是可逆地,在加入三氟乙酸后會引發肌動蛋白去組裝。因此,為了更好地模擬這一過程,作者在ATP適配體的基礎上又引入核仁素適配體形成雙適配體功能化的DNA瓦片。如圖3d所示,在這種設計中,DNA瓦片會因為核仁素的作用發生聚合,又會因為ATP的作用發生解組裝,相關的結果通過原子力顯微鏡和共聚焦顯微鏡得到了證實。

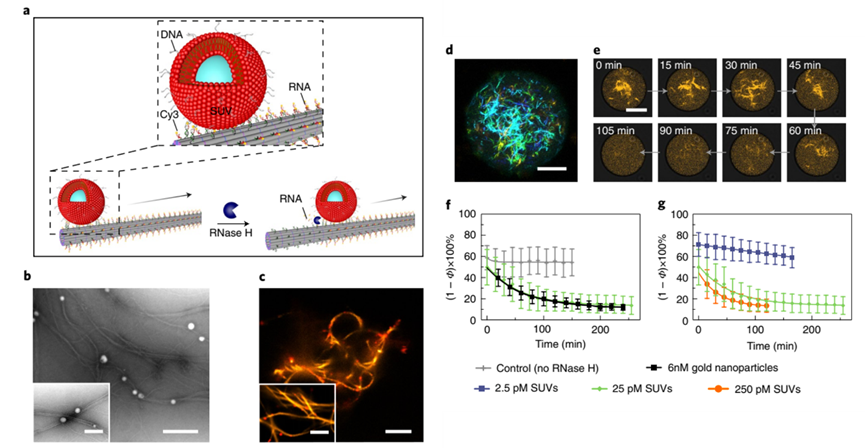
圖3 ATP誘發的DNA瓦片自組裝和ATP核仁素體系介導的DNA瓦片可逆自組裝過程最后,作者設計出了沿著DNA微絲結構定向運送貨物的方式,模擬細胞骨架上動力蛋白的運送功能。如圖4所示,這個基于DNA的微絲上帶有RNA的懸臂可以作為運輸軌道,被運送的貨物上面滿載著與RNA懸臂互補的DNA。在本文中作者使用小單層囊泡作為被運輸的貨物,其表面負載了許多膽固醇修飾的DNA,通過向體系中引入RNase H(可以選擇性降解DNA-RNA雜交鏈中的RNA鏈)可以實現貨物沿著DNA微絲移動。
總之,本研究提出了一種使用DNA納米技術來模擬細胞骨架并且在細胞大小水平上進行一定操作的方法。通過這個方法構建的模擬細胞骨架微絲結構可以實現生物分子如ATP驅動的動態組裝和去組裝的過程,該微絲結構還可以支持定向的貨物運輸。這項研究在為人工合成細胞提出了新的方案,作者希望,按照這個方案,未來可以應用于生物醫藥,機器藥物遞送,人造細胞信號交互等等其他更多可能性作者也提出,這個方法仍然存在一些挑戰和不完備的地方,例如,還無法在同一根微絲上實現多個貨物的同時運輸,與生物體的微管蛋白比起來,轉運效率無疑會因此大打折扣。筆者也認為,對于真正的細胞骨架而言,組裝和解聚都是由酶催化的,其反應效率會遠高于文中使用的方法,速度也是目前的方法所不能比擬的,需要后續研究進一步完善。Zhan, P., Jahnke, K., Liu, N. et al. Functional DNA-based cytoskeletons for synthetic cells. Nat. Chem. (2022). https://doi.org/10.1038/s41557-022-00945-w
加載更多

2555

版權聲明:
1) 本文僅代表原作者觀點,不代表本平臺立場,請批判性閱讀!
2) 本文內容若存在版權問題,請聯系我們及時處理。
3) 除特別說明,本文版權歸納米人工作室所有,翻版必究!