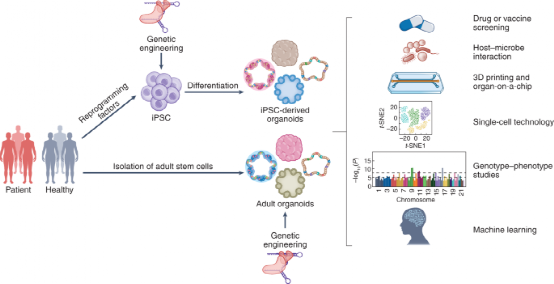
它,類器官,CNS期刊的座上賓,一時聲名鵲起,風光無兩,被各大媒體爭相報道:2013年,被Science雜志評為年度十大技術;2018年,被Nature Methods評為2017年度方法;2019年,被The New England Journal of Medicine雜志成為優良的臨床前疾病模型。類器官作為微型體外器官模型,主要來源于多能干細胞(PSC)或成體組織。它們可以自我組織和分化成功能細胞類型,高度模擬人體內器官結構和功能特征。分析類器官的形成可以加深對人類發育和組織/器官再生機制的理解。此外,類器官為疾病建模和藥物篩選提供了強大的平臺。2019年,由冠狀病毒2(SARS-CoV-2)引起的嚴重急性呼吸系統綜合征(COVID-19)是歷史上最致命的流行病之一。SARS-CoV-2不僅感染呼吸道,還會對其他組織器官造成損害。類器官可以自我更新和概括不同器官的結構和功能,是模擬COVID-19的強大平臺,并為類器官模型研究SARS-CoV-2和未來新興病毒提供了全新的視角。近日,威爾康奈爾醫學院陳水冰教授團隊在Nature Methods上發表觀點文章,概述了目前應用人類多能干細胞衍生類器官和成體類器官來研究SARS-CoV-2趨向性,宿主反應和免疫細胞介導的宿主損傷,并進行藥物發現和疫苗開發的努力,進一步總結了基于類器官的COVID-19研究中使用的新型技術,以及深入討論了后續的挑戰。

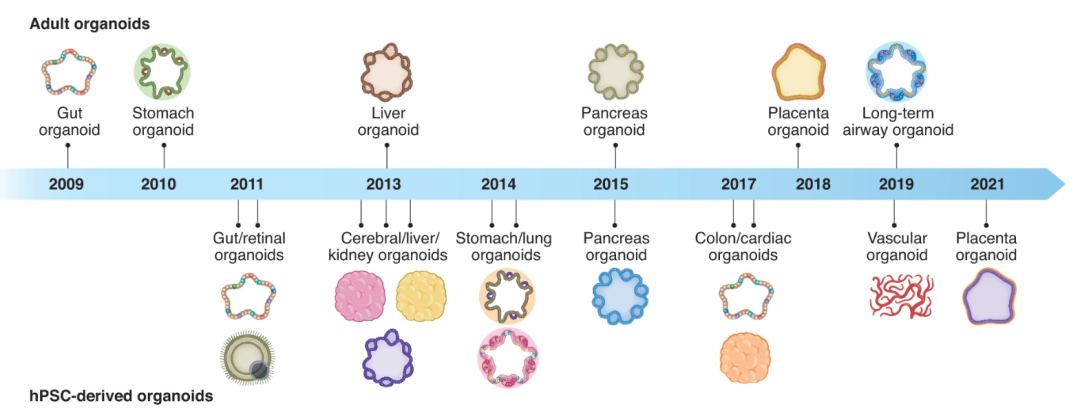
類器官的起源可以追溯到1907年,當時H. V. Wilson試圖在體外再生生物體,并表明機械分離的海綿細胞可以重新組裝和自組織成具有正常功能的新海綿生物體。1965年,在3D細胞培養的早期研究中,類器官被定義為異常的細胞生長或細胞內結構。1975年,萊茵瓦爾德和格林首次描述了長期培養人類細胞的方法。隨著3D培養方法的發展,Emerman和Pitelka通過懸浮的膠原凝膠培養乳腺上皮細胞。1981年,首次從小鼠胚胎中分離出胚胎干細胞(ESC)。1998年,從的人類囊胚中分離出人ESC。這些進步推動了干細胞生物學和類器官領域的進一步發展。2006年,通過引入四種轉錄因子將小鼠胚胎或成纖維細胞誘導PSC。2008年,Eiraku等人使用3D聚集培養系統從ESC產生基底極性的大腦皮層組織。2009年,Sato等人證明Lgr5+的人腸道成體干細胞可以自組織和分化成隱窩-絨毛類器官。此后,類器官領域研究呈現出爆發式增長。目前,幾乎所有的組織都可以在體外構建3D培養的類器官,包括人多能干細胞(hPSC)來源的腸道、視網膜、腦、肝、腎、胃、肺、胰腺、結腸、心臟、和血管類器官和人成體組織來源的胃、肝、胰腺、胎盤、和肺類器官(圖1)。
器官已被廣泛地應用于模擬人類疾病,包括傳染病。2016年,使用腦類器官模型,ZIKV被發現感染神經祖細胞,導致細胞死亡增加和增殖減少。隨后,ZIKV感染的腦類器官用于研究病毒趨向性和菌株致病性以及全基因組分析。此外,腦類器官還用于化學藥物篩選研究,該研究確定了幾種潛在的抗ZIKV候選藥物。最近的一項研究表明,ZIKV和1型單純皰疹病毒都損害了腦類器官的生長,誘導了明顯的形態缺陷和轉錄組變化,并最終導致小頭癥,腦類器官為該疾病的病理生理學提供了關鍵的見解。在COVID-19大流行之前,幾項研究應用人肺類器官來研究呼吸道疾病,如呼吸道合胞病毒和流感病毒。這些研究促進了類器官在新發病毒感染疾病中的應用,如SARS-CoV-2。COVID-19是由SARS-CoV-2引起的傳染病,可導致嚴重的急性呼吸系統綜合征,過度炎癥反應和廣泛的多器官損傷(圖2)許多研究報告了SARS-CoV-2的進入因素。首先確定和占主導地位的SARS-CoV-2受體是存在于不同人類細胞類型的細胞表面的血管緊張素轉換酶2(ACE2)。由于ACE2廣泛分布在哺乳動物細胞中,SARS-CoV-2可以通過呼吸道感染人體并迅速擴散到其他器官系統。因此,COVID-19不僅會導致嚴重的呼吸道疾病,還會誘發其他器官的損害,包括大腦,心臟,肝臟,腎臟,腸道和胰腺。二維(2D)細胞培養模型,如VeroE6細胞或ACE2過表達的癌細胞系,已被用于SARS-CoV-2感染的藥物篩選和機制研究。但2D細胞培養模型無法模擬宿主的復雜性,并且與組織具有不同的表型。相較于2D細胞培養模型,3D類器官與人體組織/器官的生理和病理特征具有更高相似性,可以作為研究SARS-CoV-2感染模型,模擬受損器官病理生理學并進行藥物發現的高級模型。
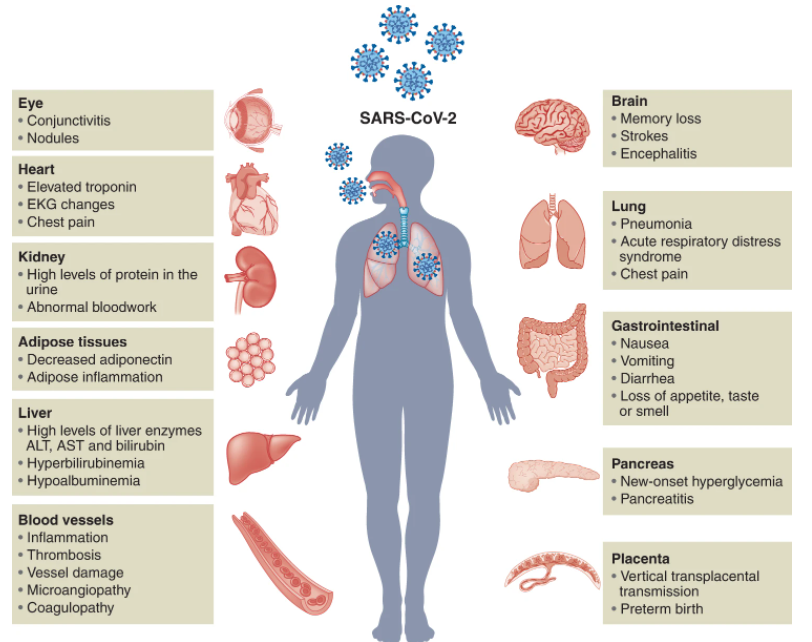
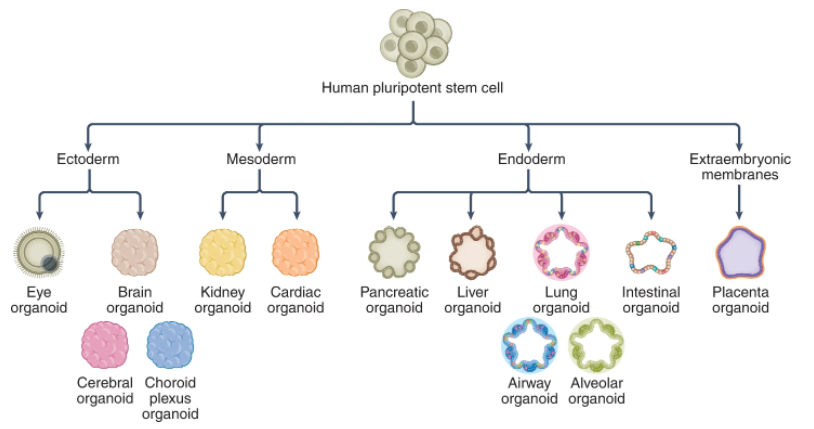
在胚胎發育過程中,呼吸上皮細胞來自內胚層,隨后以產生多個隔室,包括肺泡,近端和中間氣道以及呼吸道細支氣管。SARS-CoV-2主要針對呼吸系統中的上皮細胞,引起嚴重咳嗽,粘液分泌過多和呼吸急促。在嚴重的COVID-19患者中,發展為肺炎,進展為急性呼吸窘迫綜合征,最后發展為呼吸衰竭。肺泡、肺氣道和支氣管類器官已被廣泛用于監測病毒感染、探索病理變化和確定潛在的治療方法。呼吸類器官模型表明,纖毛細胞、棒狀細胞和AT2細胞亞群(分布在氣道和肺泡末端的近端到遠端)易于受到SARS-CoV-2感染。這些發現與COVID-19患者尸檢數據一致,表明呼吸道類器官模型可以概括體內SARS-CoV-2感染。COVID-19患者通常表現出胃腸道癥狀,例如腹瀉、嘔吐或腹痛。人類腸道類器官(IO)已被確定為體外研究腸道病理生理學的生理相關模型。IO包含多種細胞類型,包括腸細胞、杯狀細胞、腸內分泌細胞、轉運擴增細胞和干細胞。hPSC和成體組織來源的IO,包括小腸類器官(ISO)、結腸類器官(CO)和回腸類器官(ILO),已被用于研究SARS-CoV-2感染。SARS-CoV-2感染伴隨著hPSC-SIO的超微結構變化,并誘導了包括ISG在內的強大轉錄反應。急性腎損傷等腎損傷在COVID-19患者中很常見。hPSC衍生的腎臟類器官(KO)已被應用于研究腎臟中的SARS-CoV-2感染。最近一項比較2D和3D腎近端腎小管上皮細胞中ACE2表達水平的研究發現,與2D培養條件相比,KO中ACE2的表達率高出兩倍,這凸顯了應用3D類器官進行COVID-19疾病建模的重要性。據報道,在COVID-19患者中,肝功能檢查異常和肝損傷的患病率很高。肝臟相關并發癥包括總膽紅素升高和丙氨酸氨基轉移酶異常。由于肝細胞和膽管細胞是肝臟中的兩種主要功能性細胞類型,因此含有這些細胞類型的肝細胞和膽管細胞類器官研究SARS-CoV-2感染具有獨特的優勢。在hPSC衍生的肝臟類器官(LO)中,在大多數白蛋白陽性肝細胞中檢測到ACE2表達。SARS-CoV-2假病毒和SARS-CoV-2病毒均被證明可感染肝細胞。COVID-19患者會出現一系列神經系統癥狀,嚴重程度從嗅覺和味覺喪失到記憶喪失,再到中風。hPSC衍生的腦類器官(BO),包括全腦和區域腦特異性BO,已應用于SARS-CoV-2研究。在皮層,海馬,下丘腦和中腦類器官中鑒定出SARS-CoV-2。發現星形膠質細胞可促進BO中的SARS-CoV-2感染。目前關于類器官主要集中在宿主反應和藥物發現上。最近,開發了人扁桃體類器官(TOs)來評估對SARS-CoV-2疫苗的體液免疫反應。特化的生發中心(GCs)中濾泡輔助T細胞和B細胞之間的相互作用在抗原特異性體液反應的發展中起關鍵作用。通過重新聚集解離的人扁桃體組織而獲得的TO維持扁桃體細胞組成,并支持抗原特異性體細胞超突變,親和力成熟和人B細胞的分類切換。在使用減毒活流感疫苗進行免疫接種后,TOs分化成了具有清晰光區和暗區,這一分區對于GC選擇至關重要。B細胞從暗區遷移到光區,與濾泡樹突狀細胞和濾泡輔助T細胞相互作用,調節GC反應。約三分之一的COVID-19住院患者出現眼部異常,包括結膜炎。ACE2和TMPRSS2在hPSC衍生的視網膜類器官(RO)中表達。SARS-CoV-2假病毒和實時SARS-CoV-2可感染hPSC衍生的RO。受感染的hPSC衍生的RO和成人人眼細胞表現出強大的SARS-CoV-2復制和宿主免疫應答,包括NF-κB信號通路激活。最近,利用與內皮細胞共同培養的hPSC衍生的心臟類器官(CDO)來模擬在COVID-19患者心臟中觀察到的細胞因子風暴。人毛細血管類器官(CAPOs)類似于人毛細血管的管腔結構以及內皮細胞、包膜和基底膜。在CAPOs中通過QPCR檢測SARS-CoV-2,可被hrsACE2阻斷。類器官為研究SARS-CoV-2感染提供了生理相關平臺。除了如上所述的病毒趨向性,宿主反應和藥物發現外,類器官還被應用于研究宿主遺傳變異的影響,檢查物種差異并評估不同SARS-CoV-2變異的性質。此外,可以生成來自不同物種的類器官來研究其允許性和對病毒感染的免疫反應的物種差異。hPSC衍生的和成體類器官在可用性,可編輯性,成熟度和多樣性方面有利有弊。從理論上講,hPSC具有無限的增殖能力和發育潛力,可以在所有三個胚層中產生類器官(圖3)。hPSC衍生的類器官可以大規模研究,如代謝分析和藥物篩選。一些類器官,如腦和心臟類器官,只能從hPSC獲得。相比之下,來自成體組織的類器官具有有限的自我更新能力,這限制了它們在可擴展研究中的應用。基因編輯技術已應用于hPSC衍生和成體類器官,以研究基因/變異在SARS-CoV-2感染中的作用。成體類器官的一個主要優點是成熟度。與成體類器官不同,大多數hPSC衍生的類器官仍存在胎兒或新生兒身份。還需要做更多的工作來進一步改善hPSC衍生的類器官的成熟狀態。總之,具有不同遺傳背景的類器官可以應用于探索遺傳背景對疾病進展的影響。
在過去的兩年中,類器官在COVID-19疾病建模方面大顯身手,也取得了重要進展。然而,現有的類器官模型,仍存在一定的局限性,需要進一步優化傳染病的類器官模型,例如通過添加壁龕/免疫細胞來提高類器官的復雜性,結合3D打印和器官芯片技術來開發與人體系統的生理學和病理學更加相似的平臺,應用單細胞技術以高分辨率對病毒-宿主相互作用進行深入研究,以及應用基因組測序和基因編輯來探索病毒感染期間的基因型-表型相關性(圖4)。這些技術將加強類器官培養方法,加速新的抗病毒療法和疫苗的研究進程,這可能有助于研究未來的其他病毒爆發。用于COVID-19研究的大多數類器官僅包含宿主組織/器官的細胞,缺乏其他關鍵細胞類型,例如免疫細胞和血管系統細胞。免疫細胞是COVID-19病理生理學和疾病進展的關鍵。免疫介導的損傷在宿主損傷中可能比直接感染起同等甚至更重要的作用。因此,除了直接感染的后果外,體外共培養的類器官與免疫細胞還可用于研究由免疫細胞引起的COVID-19的病理生理學。此外,具有免疫細胞的類器官可以更好地了解受感染的宿主細胞和免疫細胞之間的相互作用,從受感染細胞釋放的免疫調節分子如何影響免疫成分,以及免疫反應如何影響受感染的宿主組織。類器官另一個局限性是缺乏血管。血栓并發癥在COVID-19中很常見,并導致死亡。類器官與血管內皮細胞和周細胞共培養以形成血管化類器官,為進一步發展類器官模型系統提供了希望。包含宿主類器官、免疫細胞和血管細胞的免疫-血管-類器官模型將推進類器官技術,并為研究新出現病毒的感染提供下一代高階版模型(圖5)。除了在類器官中包括不同的細胞類型外,創建具有適當空間細胞位置和組織間相互作用的類器官也很重要。3D生物打印技術使用生物墨水中含有的組織特異性細胞類型,并通過分層打印技術重建人體器官樣結構。3D生物打印生成的器官模擬系統技術在人體病毒感染研究中具有廣闊的應用前景。另一種與類器官融合的創新技術是器官芯片,它是用于在連續灌注的小腔室中培養細胞和組織的微流體裝置。芯片上的器官系統允許創建動態和可控的微環境,適合研究病毒-宿主相互作用,對病毒治療的耐藥性的演變,新的抗病毒療法的開發以及潛在的病毒發病機制。在芯片上培養的類器官為在器官水平上概括生理功能提供了新的可能性,這將進一步增強對COVID-19發病機制的理解。類器官的一個主要優點是它們含有多種類型的細胞,可用于探索病毒與不同宿主細胞之間的相互作用,以及病毒感染時宿主細胞之間的相互作用。在COVID-19研究的早期階段,scRNA-seq已被廣泛用于確定類器官內不同類型細胞中SARS-CoV-2進入因子的表達。然而,基于scRNA-seq分析的總體ACE2表達較低。例如,肺AT2細胞中ACE2陽性細胞的百分比在0.3%至2.4%之間變化,這反映了scRNA-seq平臺的檢測低靈敏度。因此,有必要深入解析SARS-CoV-2進入因子表達的scRNA-seq數據。此外,scRNA-seq數據需要通過獨立方法進一步驗證,例如免疫染色或流式細胞術分析。這些類型的研究有望以單細胞分辨率深入了解SARS-CoV-2感染時宿主細胞反應和宿主細胞相互作用。hPSC和成體類器官都可以來自具有不同遺傳背景的個體,這為探索遺傳變異對疾病進展(包括病毒感染)的影響提供了可靠的模型。在某種程度上,基于CRISPR的基因編輯方法可以有效地敲除單個基因/位點或敲入單個變體。為產生等位基因hPSC/類器官提供高通量平臺。這些等位基因hPSC/類器官可用于確定單個基因/遺傳位點,甚至是單核苷酸多態性在病毒感染和宿主損傷中的精確作用。另一方面,通過將全基因組測序和來自不同供體的類器官篩選相結合,進行基因型表型研究,以確定與病毒感染相關的新基因/位點/變異。鑒定的基因/位點/變異可以使用基因編輯工具開發的等基因類器官模型進一步驗證。此外,這些來自不同供體的hPSC/類器官也可用于調查個體對抗病毒藥物的反應,這將有助于為COVID-19患者開發個性化治療。深度機器學習已應用于分子和細胞生物學、藥物發現、蛋白質結構預測和轉化生物醫學。深度學習在病毒遺傳學領域的應用主要集中在對與耐藥性相關的病毒突變的預測上。最近,DeepNEU是一種基于完全連接的遞歸神經網絡架構的無監督深度機器學習技術,每個輸入都有一個網絡處理層,它使用一組定義的重編程轉錄因子來模擬iPSC系統。在DeepNEU中,可以模擬AT2細胞,并且被證明對模擬的SARS-CoV-2病毒感染是易感的。受感染的肺細胞和類器官可用于刺激和評估SARS-CoV-2基因組中潛在功能突變的影響。這些數據與最近公布的數據一致,并為確定潛在有效的抗SARS-CoV-2藥物組合提供了一種新方法。使用類器官平臺的研究為COVID-19疾病建模和藥物發現做出了重大貢獻。類器官仍然存在一些局限性,與動物模型相比,缺乏血管系統,免疫細胞和組織間通訊等。在現階段,疫苗和藥物開發仍然需要動物模型。未來,這些類器官平臺將用于模擬更復雜的器官,模仿器官內相互作用,并探索致病機制。來自健康或COVID-19供體的多種組織和類器官可以提供不同年齡、性別或種族群體個體的病毒易感性的可靠分子評估,并為當前和未來的大流行提供個性化的治療策略。Han,Y.,Yang,L.,Lacko,L.A.etal.HumanorganoidmodelstostudySARS-CoV-2infection.NatMethods19,418–428(2022).https://doi.org/10.1038/s41592-022-01453-y