幾十年來,化療納米藥物的前景一直吸引著臨床醫(yī)生和患者。納米顆粒 (NPs) 可以直接靶向腫瘤細(xì)胞,這將減少化療的劑量及其全身毒性,提高患者的生活質(zhì)量,并在終生劑量限制的情況下延長治療的效用。然而,這些希望在很大程度上仍未實(shí)現(xiàn)。脂質(zhì)體藥物載體幾乎構(gòu)成了所有臨床批準(zhǔn)的納米藥物,與單獨(dú)使用藥物治療相比,并沒有延長患者的總體生存期。這些失敗歸因于向靶細(xì)胞的傳遞不良,因?yàn)?NPs 必須首先穿過一系列生物屏障。盡管納米載體的組成、表面化學(xué)、尺寸和形狀已被優(yōu)化以促進(jìn)細(xì)胞進(jìn)入,但細(xì)胞攝取信號(hào)的異質(zhì)性阻礙了進(jìn)展。近日,美國四院院士、麻省理工學(xué)院Paula T. Hammond教授等人利用高通量篩選方法nanoPRISM揭示了NP材料特性與細(xì)胞內(nèi)化之間的相互關(guān)系。成果發(fā)表在Science上。
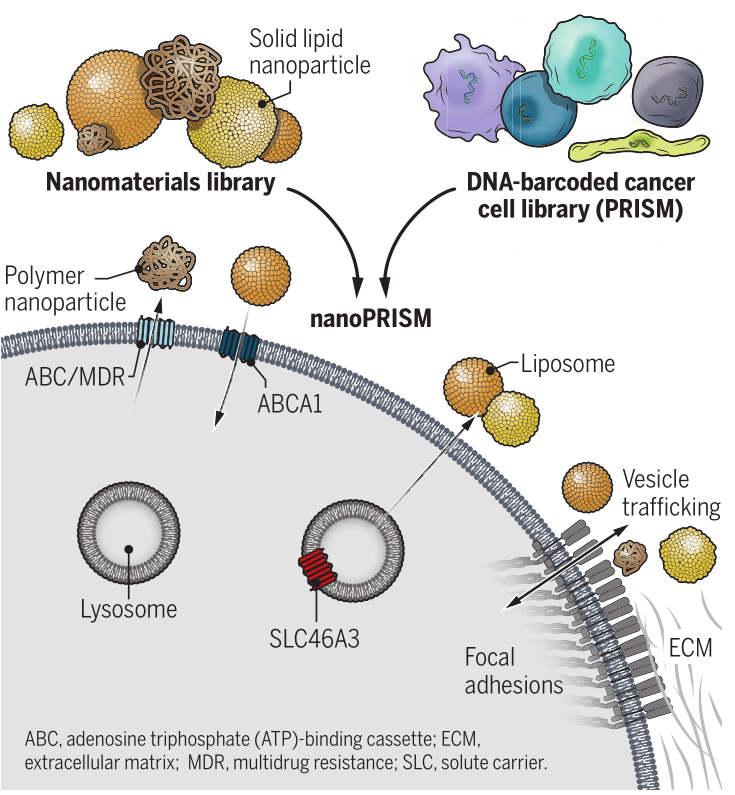
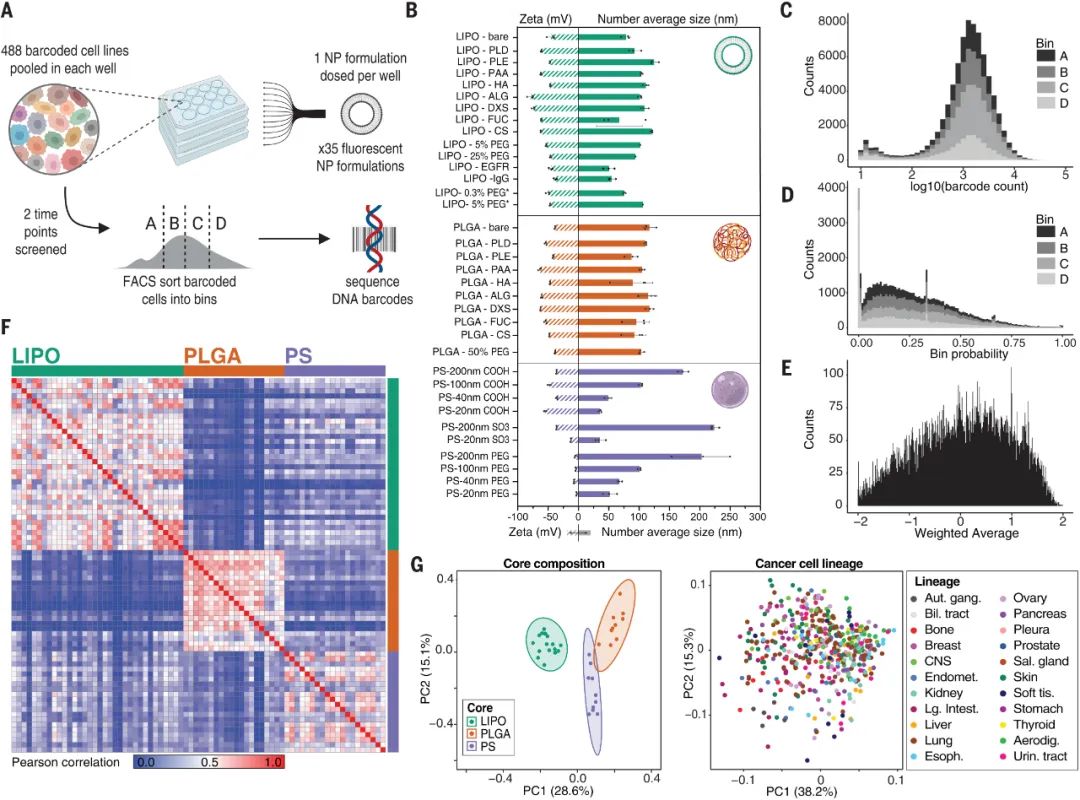
nanoPRISM 技術(shù)使用分子條形碼PRISM方法(profiling relative inhibition simultaneously in mixtures)生成約500 個(gè)癌細(xì)胞系的篩選庫,這些細(xì)胞系帶有不同的 DNA 序列,允許通過高通量基因組測序識(shí)別細(xì)胞。該細(xì)胞庫與一組35種不同的熒光標(biāo)記 NPs 組合,這些 NPs 具有不同的核心成分、表面化學(xué)性質(zhì)和粒徑,以識(shí)別細(xì)胞攝取的協(xié)同相互作用。PRISM標(biāo)記的細(xì)胞根據(jù)攝取水平分為四組,對它們的DNA進(jìn)行測序以識(shí)別它們并篩選可歸因于 NP 特征或細(xì)胞信號(hào)傳導(dǎo)的 NPs 內(nèi)化的關(guān)鍵驅(qū)動(dòng)因素。研究人員在過表達(dá)該受體的細(xì)胞系中比較了與靶向表皮生長因子受體 (EGFR) 的抗體結(jié)合的 NPs 與單獨(dú)的 EGFR 抗體的攝取效率。NanoPRISM 揭示了細(xì)胞攝取的差異,這很可能是由NP共軛的空間位阻引起的。這些結(jié)果表明,nanoPRISM可能適用于評估抗體-藥物偶聯(lián)物(ADC),這是一個(gè)不斷增長的治療類別。
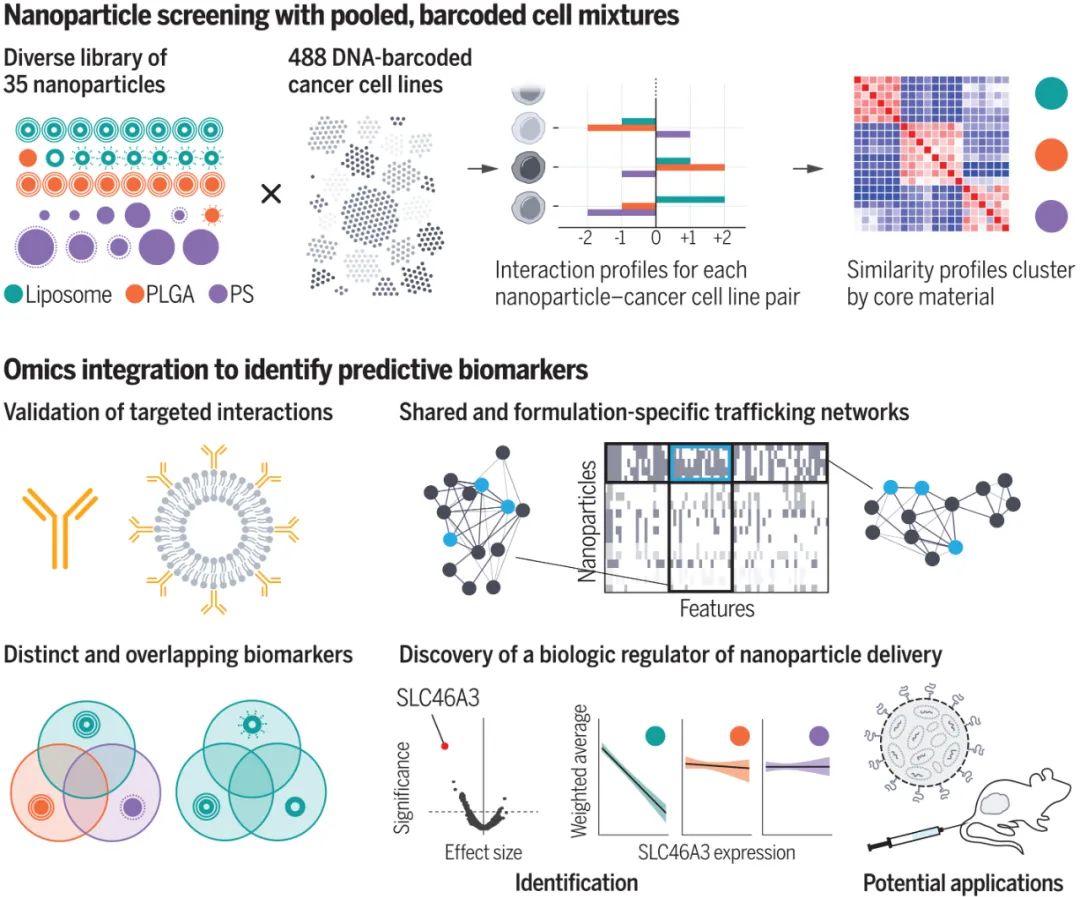
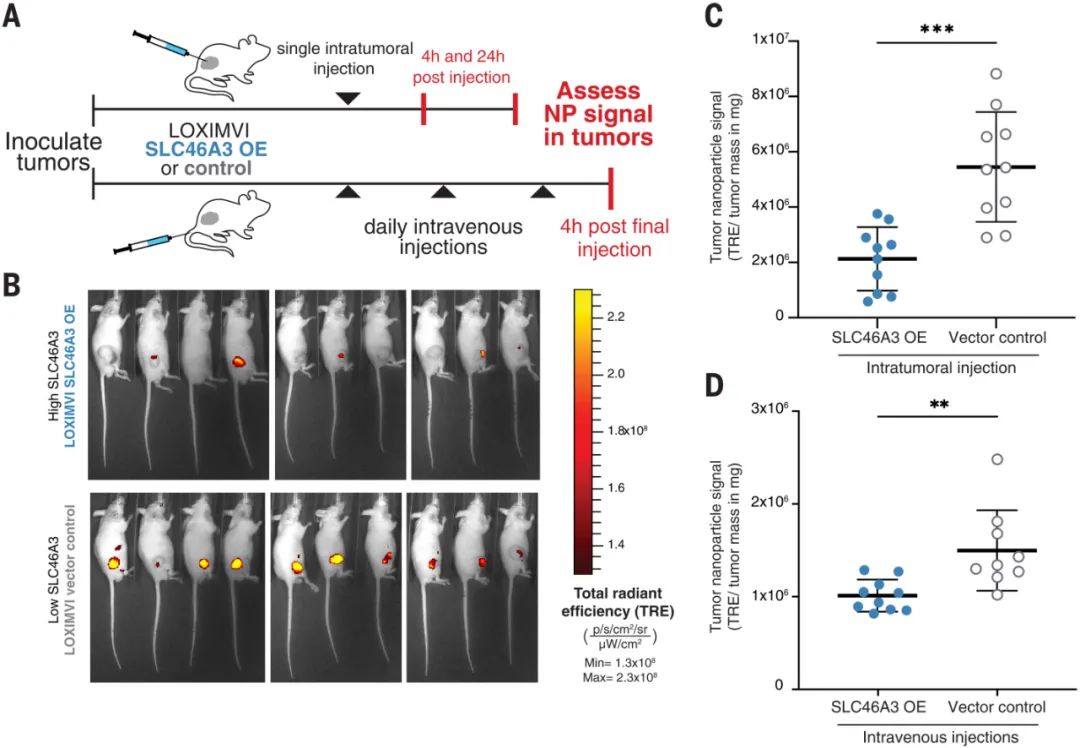
圖|nanoPRISM 篩選集成了藥物輸送和組學(xué)研究人員還使用nanoPRISM 來檢測具有最常應(yīng)用于納米醫(yī)學(xué)的成分的NPs:由脂質(zhì)雙層和固體脂質(zhì)制成的球形脂質(zhì)體和由無序球形脂質(zhì)或或聚合物聚集體組成的聚合物NPs。他們還檢查了帶有或不帶有聚乙二醇 (PEG) 修飾的NPs,PEG常用于減少全身攝取和改善循環(huán)時(shí)間。研究人員發(fā)現(xiàn) NPs核心成分是細(xì)胞攝取的主要決定因素(下圖F和G)。這一出人意料的發(fā)現(xiàn)顛覆了多年來在調(diào)節(jié)NP表面化學(xué)以改變蛋白質(zhì)吸附模式和隨后的細(xì)胞粘附方面的工作。盡管檢測的是NPs的表面化學(xué)與細(xì)胞作用,但研究人員的發(fā)現(xiàn)支持早期研究表明,由核心成分決定的NP剛度和可變形性是攝取過程的更強(qiáng)調(diào)節(jié)劑。圖|同時(shí)評估數(shù)百個(gè)癌細(xì)胞系中的 NP 細(xì)胞相互作用SLC46A3 是脂質(zhì)體 NP 攝取的負(fù)調(diào)節(jié)基因通過將這些發(fā)現(xiàn)與癌細(xì)胞系百科全書相結(jié)合,進(jìn)一步說明了nanoPRISM方法的魔力,該百科全書量化了常見癌細(xì)胞系的突變基因組特征。研究人員確定了與NP內(nèi)化最相關(guān)的基因組特征和信號(hào)網(wǎng)絡(luò)。許多結(jié)果并不令人驚訝,例如溶質(zhì)載體 (SLC) 轉(zhuǎn)運(yùn)蛋白或三磷酸腺苷 (ATP) 結(jié)合盒 (ABC) 家族的參與,這些家族以前與NPs細(xì)胞進(jìn)入和轉(zhuǎn)運(yùn)有關(guān)。nanoPRISM 篩選還突出了與有助于NPs細(xì)胞進(jìn)入過程的質(zhì)膜和細(xì)胞外基質(zhì)相關(guān)的基因網(wǎng)絡(luò)。然而,nanoPRISM 方法也揭示了一個(gè)未被研究的基因(SLC46A3)的參與,該基因與NP內(nèi)化無關(guān)。該基因編碼一種與脂質(zhì)分解代謝相關(guān)的溶酶體跨膜蛋白,影響ADC的溶酶體運(yùn)輸。SLC46A3 的表達(dá)負(fù)調(diào)控脂質(zhì)體和固體脂質(zhì)NPs細(xì)胞攝取,而缺乏脂質(zhì)的聚合物 NPs不受影響。即使在NPs表面涂有非脂質(zhì)分子時(shí),也證明了SLC46A3與基于脂質(zhì)的 NPs的關(guān)聯(lián)。這進(jìn)一步表明了NPs核心成分在細(xì)胞攝取過程中的重要性,并且還表明細(xì)胞可以通過表面涂層檢測核心成分,表面涂層更類似于多孔網(wǎng)而不是壁。這可能對預(yù)測核酸疫苗和使用脂質(zhì)載體的療法(如 COVID-19 mRNA 疫苗)的功效具有重要意義。例如,可以實(shí)施 SLC46A3 生物標(biāo)志物測試,以確定最有可能對基于脂質(zhì)的納米療法產(chǎn)生反應(yīng)的患者。圖|高通量成像細(xì)胞術(shù)證實(shí)了 NP 內(nèi)化并揭示了 SLC46A3 依賴性細(xì)胞內(nèi)運(yùn)輸?shù)淖兓?/span>nanoPRISM 篩選的結(jié)果也在動(dòng)物模型中得到證實(shí),表明該技術(shù)可用于確定最有希望的下游分析配方,從而減少臨床前動(dòng)物試驗(yàn)的需求。這種高通量方法對于癌癥納米藥物的快速發(fā)展至關(guān)重要,因?yàn)槊绹蜌W洲監(jiān)管機(jī)構(gòu)尚未根據(jù)與現(xiàn)有產(chǎn)品的相似性制定納米藥物批準(zhǔn)標(biāo)準(zhǔn)。鑒于藥物開發(fā)的時(shí)間很長,可能長達(dá)十年或更長,安全地加速這一過程的技術(shù)是可取的。圖|LOXIMVI 腫瘤中 PEG 化脂質(zhì)體 (LIPO-0.3% PEG*) 的保留和積累取決于 SLC46A3 的表達(dá)nanoPRISM方法代表了對NPs內(nèi)化的不太嚴(yán)格和定性研究的重大進(jìn)步,該研究是該領(lǐng)域早期的特征。研究單個(gè)細(xì)胞系中的一些NPs特性無法捕捉NPs細(xì)胞進(jìn)入的復(fù)雜性。結(jié)合機(jī)器學(xué)習(xí)、迭代模擬和材料合成方法,nanoPRISM可以篩選針對特定細(xì)胞類型的納米材料,類似于目前的肽生物篩選方法或通過指數(shù)富集(SELEX)方法發(fā)現(xiàn)適體的配體系統(tǒng)進(jìn)化。雖然該研究僅檢測了35種不同的納米顆粒,但可以向庫中添加額外的納米材料,例如無機(jī)納米顆粒(如金、二氧化硅和碳)和具有復(fù)雜幾何形狀的材料(如DNA折紙)。nanoPRISM 的一個(gè)限制是它專注于細(xì)胞進(jìn)入,這是生物分布過程的最后一步。然而,很容易設(shè)想將這種方法擴(kuò)展到細(xì)胞攝取之外,以研究 NP 材料特性與細(xì)胞粘附和運(yùn)輸中基因表達(dá)之間的關(guān)系。此外,使用該研究提供的模板,類似的方法可以與微流體、芯片上的器官或腫瘤類器官培養(yǎng)物相結(jié)合,以模擬其他傳遞障礙,如循環(huán)、外滲和組織擴(kuò)散。因此,nanoPRISM 方法可以催化快速材料優(yōu)化,加速納米載體設(shè)計(jì),并使癌癥納米醫(yī)學(xué)的前景更接近現(xiàn)實(shí)。1. Massively parallel pooled screening reveals genomic determinants of nanoparticle delivery. Science 2022.DOI: 10.1126/science.abm5551https://www.science.org/doi/10.1126/science.abm5551
2. One step closer to cancer nanomedicine. Science 2022.
https://www.science.org/doi/10.1126/science.add3666

Paula T. Hammond, 麻省理工學(xué)院教授兼化學(xué)工程系主任。2013年當(dāng)選美國藝術(shù)與科學(xué)學(xué)院院士,2016年當(dāng)選美國國家醫(yī)學(xué)院院士,2017年當(dāng)選美國國家工程院院士,并在2019年當(dāng)選美國國家科學(xué)院院士。她是入選所有三個(gè)國家科學(xué)院院士的僅有的 25 位杰出科學(xué)家之一。Hammond 教授發(fā)表了 320 多篇論文,并申請了 20 多項(xiàng)專利。她是 Layer Bio, Inc. 科學(xué)顧問委員會(huì)的聯(lián)合創(chuàng)始人和成員,也是 Moderna Therapeutics 科學(xué)顧問委員會(huì)的成員。Hammond 教授課題組專注于利用靜電和其他互補(bǔ)相互作用來生成具有高度可控結(jié)構(gòu)的功能材料。她在納米醫(yī)學(xué)方面的研究包括開發(fā)新的生物材料,以使藥物從具有時(shí)空控制的表面輸送。她還研究了用于靶向納米顆粒藥物和基因傳遞的新型響應(yīng)聚合物結(jié)構(gòu),并開發(fā)了用于電化學(xué)能源設(shè)備的自組裝材料系統(tǒng)。