特別說明:本文由學研匯技術中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。
原創丨彤心未泯(學研匯 技術中心)
編輯丨風云
碳烯:
在化學領域,獲取瞬態和反應中間體的新策略對進一步的研究和合成應用很有幫助。在有機化學中,碳烯就是這樣一種中間體,是一種具有兩個未共用價電子的中性碳分子。碳烯是一種高度有效的反應性中間體,可促進各種其他難以實現的化學反應,包括小環的形成和強δ鍵的插入。為了獲得這種有價值的反應性,通常使用具有高熵或焓驅動力的試劑,包括爆炸性(重氮)或不穩定(寶石-二鹵)化合物。重氮烷烴是一種活性碳基分子,在碳烯形成時釋放氮。當與金屬催化劑配對時,會發生各種不同的反應。重氮烷烴可以被受電子/給電子基團取代以調節生成的碳烯的電子特性以及隨后的反應特性。然而,在處理這些熱不穩定分子時,反應過程中釋放的氮氣會導致嚴重的安全問題(如爆炸、窒息等)。另一種常用方法是金屬(例如鋅)與二鹵代烷烴的反應。雖然這種方法更安全,但所得鋅類化合物的反應性僅限于環丙烷的形成(即環丙烷化)。如果原料是烷基取代的二鹵代烷,則鋅類碳烯的制備也可能會出現有害的副反應,這進一步限制了它們的應用。
雖然碳烯在有機化學中具有廣泛的應用,但獲取這種有價值的中間體仍存在以下關鍵問題:1. 安全問題亟需解決:重氮烷烴是一種不穩定的前體分子,在使用過程中會釋放大量氮氣,有可能會引起爆炸、不受控的連鎖反應以及操作者的窒息等安全問題。2. 存在有害副反應:金屬與二鹵代烷烴的反應可以產生碳烯,但由于鋅羰基化合物的1,2-H遷移,質子很少被耐受,使用鋅類碳烯的制備可能會出現有害的副反應。3. 缺少合成活性碳烯的通用方法:雖然通過硼酸鋰碳烯、Mo介導的酮脫氧和金催化的炔烴環化可以解決Matteson重排,但仍然沒有一種通用的方法來獲取非穩定的烷基碳烯,或者將它們用于穩定重氮試劑的廣泛的碳烯反應。有鑒于此,美國俄亥俄州立大學David A. Nagib等人受經典的 Clemmensen中用Zn(Hg)和HCl還原羰基化合物的啟發,開發了一種以安全的方式從穩定的前體制備碳烯的方法。利用穩定且可擴展的含乙酸鹽的有機鹵化物前體,證明了芳基和烷基取代的碳烯的形成,其本身可以衍生自簡單的醛。通過將這些碳烯與適當的金屬催化劑配對,可以控制它們的反應性以進行各種合成轉化。這種通用方法避免了重氮烷烴的安全問題以及二鹵代烷烴的穩定性和選擇性限制。
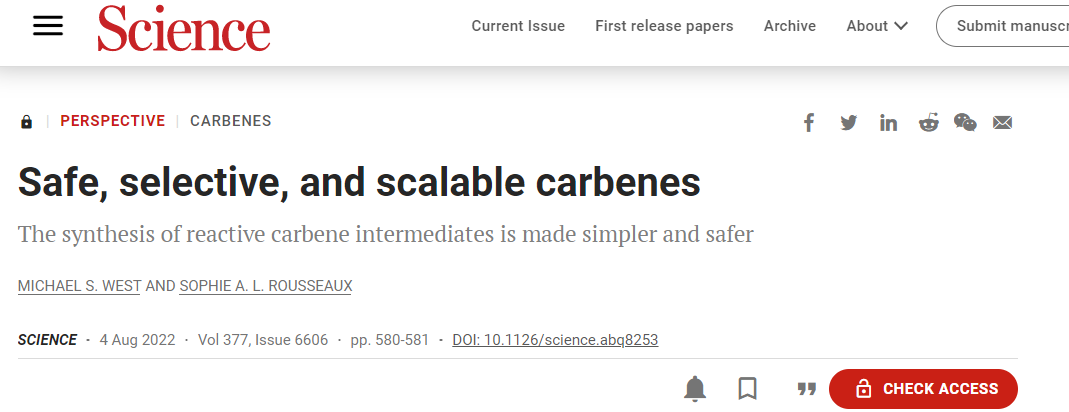

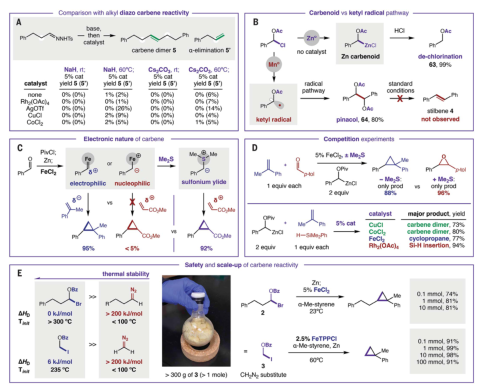
1、設計了羰基化合物轉化為電子多樣化碳烯的通用催化策略作者提出堿金屬催化劑控制的α-酰基化消除可以形成活潑的金屬羰基。與簡單的鋅羰基相比,催化可以賦予碳烯不同的反應性。此外,利用該方法可以實現大規模的生產且無安全隱患。作者探索了碳烯的安全性和反應性,對醛衍生的碳烯前體進行了不同類別反應性的驗證,包括環丙烷化和X-H插入。發現一系列烷基胺和芳基胺有效地進行了N-H插入。更親核的H供體(例如,膦、硅烷、硼烷)非常適合這種碳烯反應性,已證實應用于數10種反應類別。作者通過一系列中間體表征、反應性比較和動力學數據對碳烯反應解析了碳烯反應機理。發現了催化碳烯中間體的親電性,在引入硫化物助催化劑后,瞬態過硫酸鹽能夠與此類親電試劑發生反向反應,無需重氮中間體。利用原位紅外光譜和可變時間歸一化分析表明二聚反應在催化劑中是二級反應。

重氮烷烴可以在100°C分解,其分解產生的能量超過200 kJ/mol。這種熱不穩定性使得這些試劑的放大反應非常危險。本工作中對于醛衍生的碳烯前體,在>300°C下分解時產生的能量小于30 kJ/mol,且避免了氮的輸出。因此,該反應可以放大1000倍而不會發生安全事故。本工作中碳烯前體被證實在10多種不同類型的反應中具有通用性的。利用廉價的非貴金屬催化劑,通過二聚反應選擇性地生成烯烴產品。通過調控催化劑,可以實現碳烯反應性的調節。由這些前體生成的穩定的芳基碳烯和不穩定的烷基碳烯也成功地進行了鍵插入反應。作者提出堿金屬催化劑控制的α-酰基化消除可以形成活潑的金屬羰基。與簡單的鋅羰基相比,催化劑影響也可以賦予不同的反應性。作者發現親電性較低的羰基化合物最好與親電性更強的酰鹵配對,以提供反應性越來越強的卡賓前體。然而,親電性較低的脂肪醛最好與苯甲酰溴 (BzBr)結合形成不穩定的烷基類似物。兩種反應都可以在>20 g的規模下進行,且不會出現類似重氮類似物固有的安全問題。苯甲酰碘 (BzI)很容易與反應性最低的醛、甲醛結合,從而獲得甲基碳烯前體,這是一種常見的保護基團,可以以千克為單位購買,成為重氮甲烷的安全替代品。
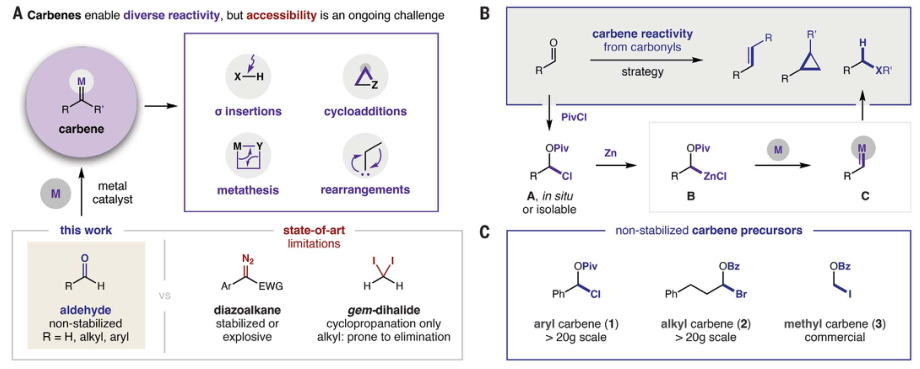
通過將苯甲醛納入所提出的策略來研究碳烯二聚反應,這是一個需要PivCl添加、插入Zn和金屬催化的三階段序列。結果表明幾種基本金屬鹽能夠有效地二聚生成二苯乙烯,并觀察到CoCl2具有顯著的催化劑立體控制。除了作為碳烯反應性概念的證明,還表明了電子上不同的取代基在芳基碳烯組分中具有很好的耐受。
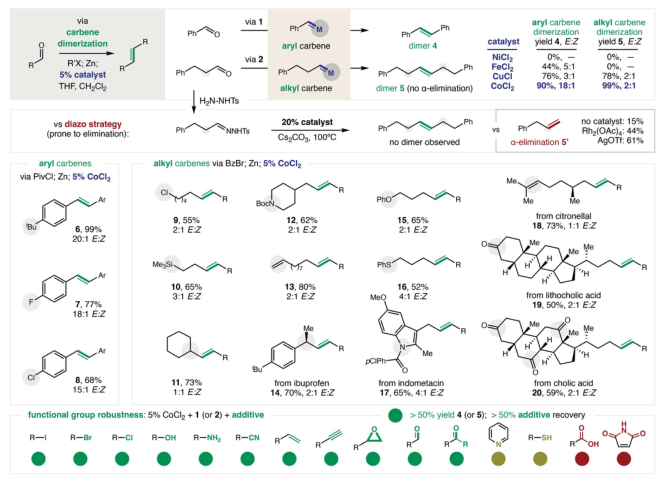
作者測試了烷基卡賓反應性可以通過催化方法以比重氮烷烴或二鹵化物更安全和更有選擇性的方式利用。可以轉化為碳烯的脂肪族醛的獨特廣泛范圍是這項初步研究的亮點。為此,發現CoCl2有效地催化氫化肉桂醛的碳烯二聚化。與未催化的甲硅烷氧基變體相比,沒有觀察到α-消除。為了進一步的比較,通過將腙置于各種催化劑和堿中以獲得其碳烯,研究了重氮化策略。此外,進行了穩健性研究以進一步評估該策略的廣泛官能團耐受性,將化學多樣化的添加劑與催化劑和碳烯前體結合,證實了它們在二聚化步驟中的可行性。
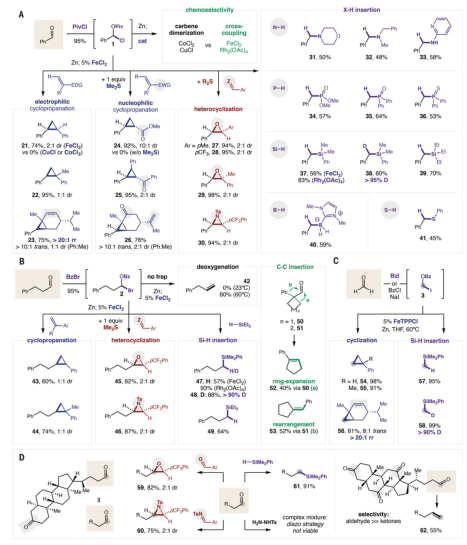
為了證明在更復雜的環境中的可行性,利用兩種膽汁酸的醛經歷了四種不同類別的碳烯反應,證實了本工作策略的可行性。作者基于一系列中間體表征、反應性比較和動力學數據解析了碳烯反應機理。作者探索發現了催化碳烯中間體的親電性,在引入硫化物助催化劑后,瞬態過硫酸鹽能夠與此類親電試劑發生反向反應,而無需重氮中間體。金屬催化劑決定了反應的化學選擇性。碳烯二聚反應的原位紅外光譜和可變時間歸一化分析表明二聚反應在催化劑中是二級反應。
本文報道的碳烯前體的直接合成、穩定性、可擴展性和選擇性,將為化學家提供更好的方法來實現有價值的碳烯合成應用。作者提供了一種直接的方法,克服了長期存在的安全性和反應性挑戰,從醛中生成這些有價值的穩定和非穩定的反應性中間體。預計該方法將對碳烯反應的進一步發展產生三重影響,包括使用非貴金屬催化劑、使用安全可擴展的試劑以及改進不穩定碳烯的合成途徑,這將助力對碳烯化學的學術及工業化探索。MICHAEL S. WEST, et al. Safe, selective, and scalable carbenes. Science, 2022, 377: 580-581.DOI: 10.1126/science.abq8253.https://www.science.org/doi/10.1126/science.abq8253LUMIN ZHANG, et al. Carbene reactivity from alkyl and aryl aldehydes. Science, 2022, 377: 649-654.DOI: 10.1126/science.abo6443https://www.science.org/doi/10.1126/science.abo6443














