活細胞是多任務處理的專家。它們通過創建專門的隔間,使用有限的工具卻可以集中執行無數重要功能。在某些情況下,隔室被脂膜包圍,但分子也可以分為無定形團塊,稱為液體凝聚物,其內容隨著分子擴散進出它們而波動。這些凝聚物的完整性是由熱力學來維持的,就像油滴不溶于水一樣。但它們的動態行為帶來了一個挑戰:是什么阻止了細胞的成分形成一個巨大的團塊?
于此,德國馬克斯普朗克研究所Stephan W. Grill、Frank Jülicher、Arjun Narayanan等人報告了細胞使用的一種生化計時機制,以避免在肌動蛋白細胞骨架(賦予細胞結構的蛋白質網絡)形成過程中發生災難性的聚集。

關鍵問題
細胞骨架由一組生物聚合物形成,這些生物聚合物可以快速組裝成各種網絡結構:從推動細胞前進的樹狀網絡,到分裂時收縮細胞的環狀結構,以及施加閉合開放性傷口所需力的線性陣列。這些網格的剛度通常被認為是維持細胞機械完整性的核心。然而,通過觀察網絡形成的最早階段,研究人員表明,新生肌動蛋白網絡形成稀疏凝聚物,有助于構建細胞骨架。因此,細胞骨架不受控制的生長或合并成單個凝聚體將給細胞帶來巨大的問題,因為細胞骨架在細胞表面的均勻分布對于健康的胚胎發育和細胞資源的正確分配至關重要。
異步地出現和消失
研究人員研究了秀麗隱桿線蟲胚胎單細胞階段的細胞骨架。他們發現數以千計的肌動蛋白絲小簇在幾分鐘內以異步動力學在細胞表面出現和消失。作者的分析表明,這些簇通過一種涉及兩種成分相互作用的機制被阻止合并成一個團塊:一種啟動肌動蛋白細絲組裝的蛋白質,稱為 WSP-1,以及細絲本身。
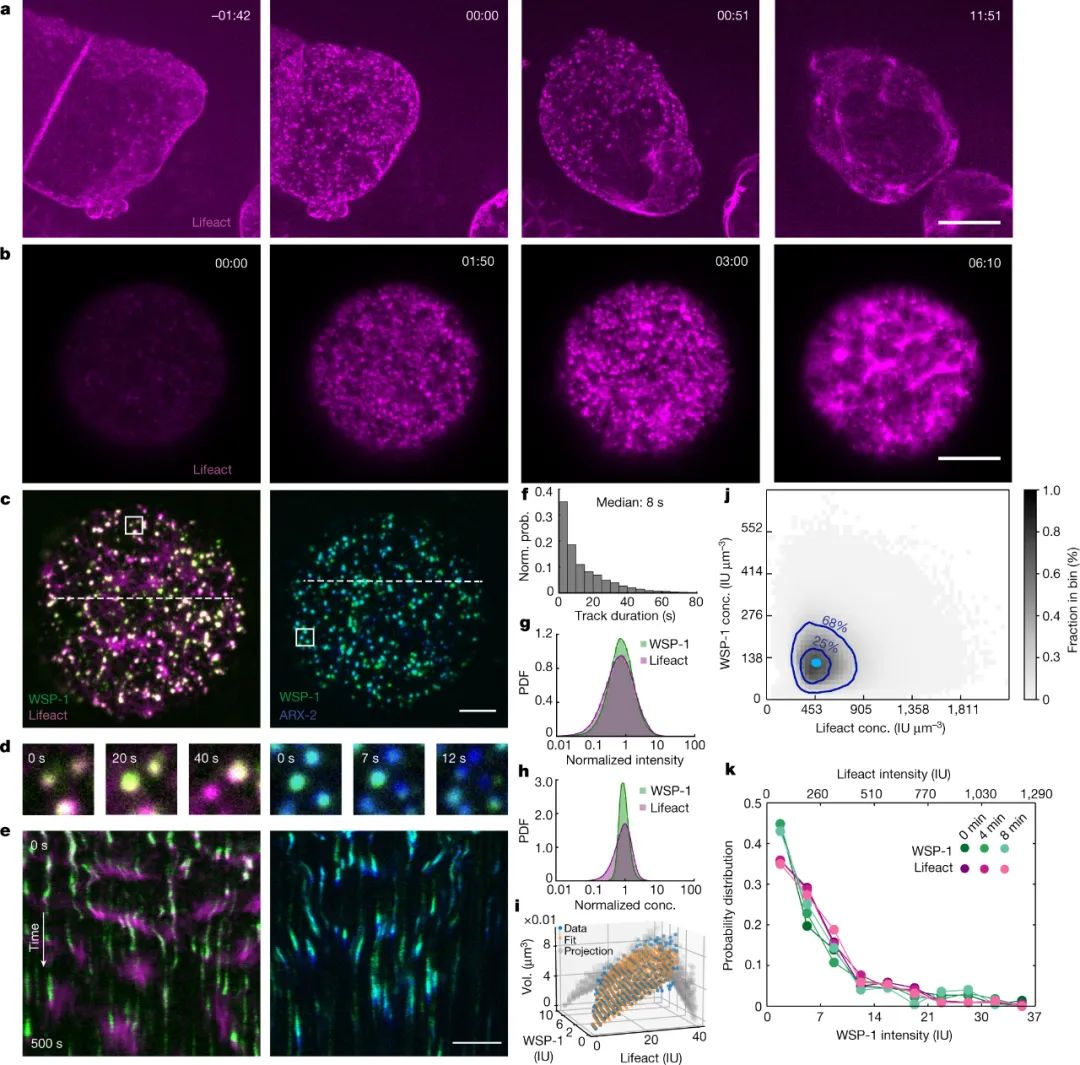
圖|在卵母細胞到胚胎的轉變過程中,肌動球蛋白皮質的形成是通過動態的 F-肌動蛋白/WSP-1 皮質凝聚物進行的。
生物化學計時器
研究小組表明,當WSP-1通過優先結合自身而開始在細胞表面積累時,首先會形成凝聚物。這種聚集在WSP-1簇的位置觸發肌動蛋白網絡的組裝,并且該網絡被細胞質中存在的其他特殊蛋白質不斷分解。在簇形成開始時,與WSP-1誘導的組裝中的爆發相比,細絲被分解的速率可以忽略不計。
隨著越來越多的肌動蛋白絲積累,WSP-1從凝聚物中移出,留下富含肌動蛋白的凝聚物,蛋白質缺乏。此時,分解開始超過組裝,導致凝聚液最終溶解。通過這種機制,細胞產生具有正確功能的凝聚物,同時也及時主動破壞它們。作者將這一循環映射為肌動蛋白和WSP-1濃度的函數。該循環有效地創建了一個生物化學定時器,通過該定時器,細胞可以防止其有限的資源被一個功能囤積。
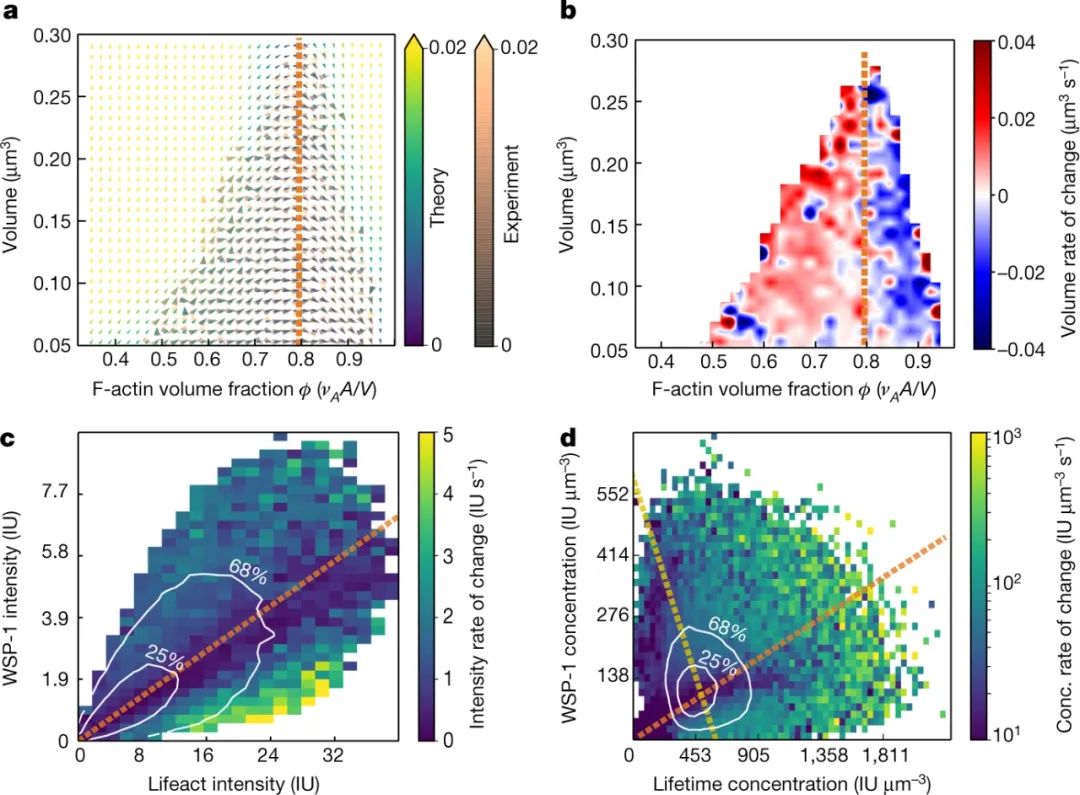
圖|集合平均濃度由具有最慢動力學的化學計量確定
整個簡要過程如下圖所示,在第一階段,WSP-1首先在細胞表面積累形成凝聚物,觸發肌動蛋白網絡的局部組裝;然后進入第二階段,這些細絲不斷地被分解,盡管速度低于它們的組裝速度。在第三階段,WSP-1通過一種未知的機制被移出液體凝聚物。最后的第四階段,分解速度超過了組裝速度,導致凝聚液溶解。
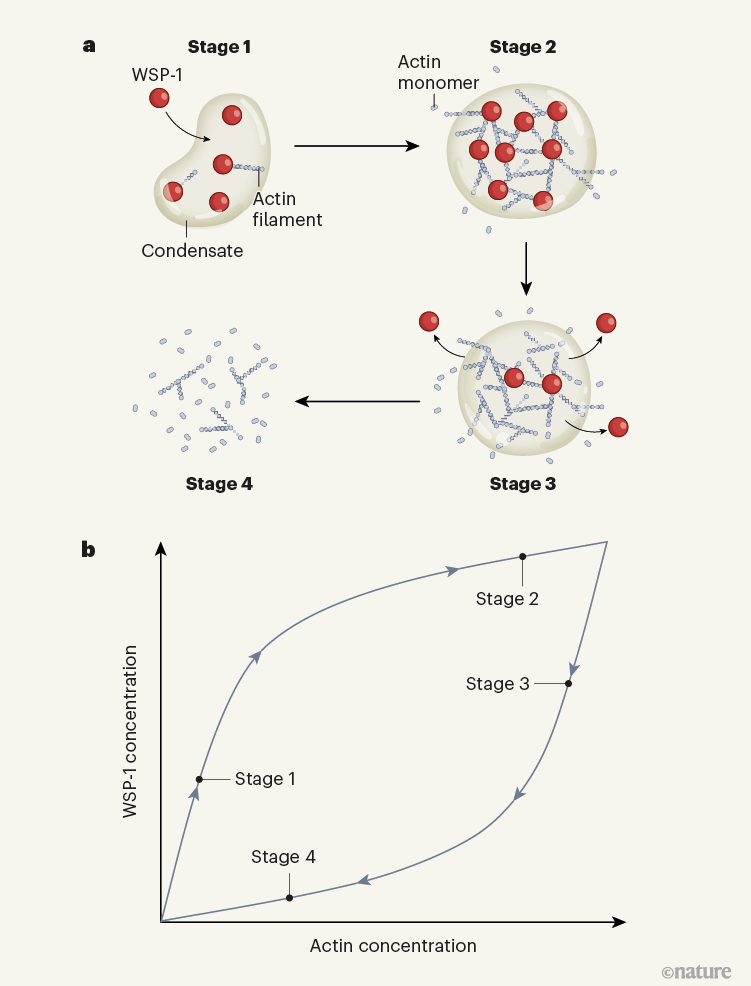
圖|肌動蛋白細胞骨架凝聚物的生化計時器
這項技術性研究的結果提出了許多問題。
1)事實上,控制細胞骨架凝聚物的密度不僅需要設計一種在正確的時間摧毀它們的方法,而且還需要精確調節它們首先出現的頻率。控制成核過程的方法是一個有待進一步研究的課題。
2)WSP-1 從凝聚物中排除的確切機制同樣未知。一種可能性是生長的肌動蛋白絲通過直接的機械相互作用將 WSP-1 從凝聚物中移出。事實上,在爬行細胞的前部,與 WSP-1 相關的復合物已被證明被觸發形成的肌動蛋白絲物理置換。類似的力會導致 WSP-1 排斥嗎?
3)盡管作者的模型是基于兩種成分之間的相互作用,但很明顯,許多隱藏的蛋白質隱藏在其參數背后。根據我們對肌動蛋白網絡生物化學的現有知識,可以猜測其中一些的身份。例如,與與去除肌動蛋白絲相關的參數可能會受到參與網絡分解的蛋白質的豐度或活性變化的影響,例如 coronin 和 cofilin。其他參數則更為神秘:當作者耗盡參與細絲組裝的蛋白質復合物的細胞時,變化最大的模型參數反而與肌動蛋白分解有關。
回答這些問題需要結合成像和建模。作者使用的早期秀麗隱桿線蟲胚胎在這方面提供了一個理想的系統,它的透明性使其能夠進行高質量的成像,并且可以使用多種遺傳工具進行探測。對這種模式生物中凝聚物形成的進一步研究無疑將加深我們對細胞骨架組織的理解。
小結
該研究工作擴展了我們對細胞內凝聚物的理解。盡管許多觀察到的凝聚物是本質上無序蛋白質的液體狀聚集體,但研究人員觀察到的細胞骨架聚集體可能采取凝膠狀結構的形式,涉及堅硬的蛋白質絲。這些凝膠狀聚集體是否能像兩個液滴一樣在接觸時順利融合仍有待確定,這一特性迄今為止一直被認為是凝聚物的標志。
該研究還豐富了我們對如何控制凝聚物大小的理解。先前提出的尺寸調節機制表明,例如,凝聚物受到彈性支架的物理限制,或者它們的尺寸由其組分的擴散和降解之間的不平衡決定。與這些靜態機制不同,該生化計時器表明,細胞內凝聚物通過高度動態的方式進行調節,并再次揭示了整合物理和生物化學在我們從分子相互作用中了解細胞過程的努力中的力量。
參考文獻:
1. Yan, V. T., Narayanan, A., Wiegand, T. et al. A condensate dynamic instability orchestrates actomyosin cortex activation. Nature (2022).
https://doi.org/10.1038/s41586-022-05084-3
2. A biochemical timer phases condensates in and out in cells. Nature 2022.
https://www.nature.com/articles/d41586-022-01794-w











