背景介紹:
神經科學的一項重大技術進步是用光記錄操縱神經活動的能力。神經活動的讀取是通過開發基因編碼的鈣指示物實現的,這些指示物與細胞內鈣結合,并發出與神經活動成比例的熒光。光遺傳學可以操縱神經活動,利用不同基因表達的光敏離子通道(opins)來激活和滅活特定的神經元群體。總之,這些技術已經徹底改變了神經科學,允許研究人員記錄和操縱動物行為的細胞類型特異性的神經活動。最近,鈣成像和光遺傳學已經能夠結合在2光子(2P)顯微鏡中,同時操縱和成像神經活動。通過這種“全光”的方法,相同的神經元可以同時被記錄和刺激,光傳輸可以限制在單個神經元上。通過使用更真實的生理刺激參數重放鈣成像的活動,也可以模擬正常的神經活動。目前,2P顯微鏡是全光刺激和細胞分辨率記錄的金標準。然而,傳統的2P顯微鏡技術有一些關鍵的局限性,比如成本高、便攜性差,使得它難以在自由移動的動物中使用。盡管最近的研究已經開發出了一種便攜式2P系統,但仍無法同時結合圖形化和鈣成像。雖然1光子(1P)模式的刺激和成像系統也已經開發了,但它們也有相當大的局限性,例如需要臺式共聚焦顯微鏡,這限制了系統的可移植性。
基于以上限制因素,來自美國杜克大學的Henry H. Yin團隊報告了一種微型單光子內窺鏡的設計,用于同時進行光遺傳學刺激和鈣成像。通過集成數字微鏡,內窺鏡可以激活視野內的任意神經元,并在成像鈣活動時應用任意時空光刺激模式。使用內窺鏡對自由運動小鼠的紋狀體神經元從直接通路或間接通路成像,同時激活視野中的任何選定神經元。內窺鏡還允許根據神經元與特定動物行為的關系選擇神經元,并通過光刺激模擬自然神經活動來重建行為,微型內窺鏡可能有助于研究神經活動如何引起自由活動動物的行為。

研究思路:
MAPSI的設計:
MAPSI中的鈣成像組件基于加州大學洛杉磯分校的微型鏡,該微型鏡允許對自由移動的動物中的許多神經元進行成像。為了集成發光二極管(LED)激發鈣指示劑和激光刺激,研究人員修改了原微型鏡設計,以納入數字微鏡裝置(DMD)和額外的激光光源。DMD可以創建具有極高空間和時間分辨率的任意光圖案。為了同時記錄和刺激,研究人員使用了兩種光源:第一種是石灰LED(540 nm–580 nm濾光片),用于激發鈣指示劑。第二個光源是一個外部激光器(光引擎,PSU-H-LED),它產生藍光用于光生激發(473 nm)。通過使激發光通過DMD24,26,可以生成圖案化光束,該光束與主激發路徑中的鈣成像激發光合并(圖1)。
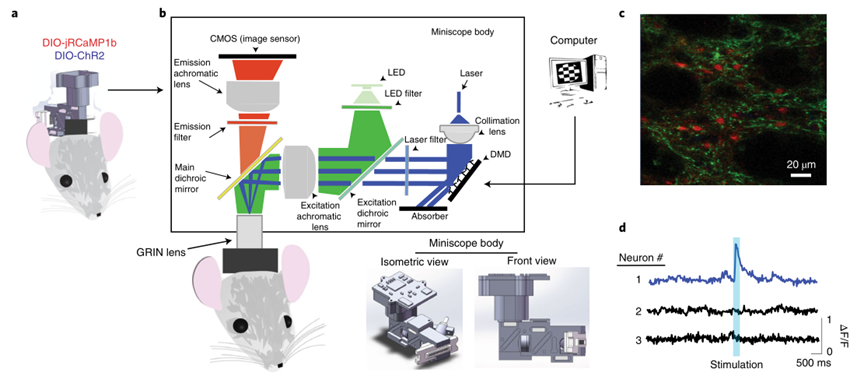
圖|具有全光圖案化刺激和成像(mAPSI)的迷你鏡
MAPSI的性能測試:
為了測試MAPSI同時刺激和記錄自由運動動物神經元的能力,研究人員在背外側紋狀體(DLS)中注射了含有Cre依賴性的jRCaMP1b和ChR2-eYFP的兩種病毒載體。jRCaMP1b可以由帶有540–580nm激發濾光片的石灰LED激發,并且ChR2可以使用473nm的激發波長和來自單獨激光發生器的450-490nm發射濾光器來激活。在D1-Cre和A2A-Cre小鼠中使用Cre依賴性病毒載體并在直接(D1+)和間接(A2A+)途徑神經元中表達jRCaMP1b和ChR2-eYFP 28。首先在麻醉小鼠中測試MAPSI,以驗證刺激區域與鈣成像區域相似(圖2a)。研究表明,在大于100 mW mm的高功率下,長時間刺激可能導致不可接受的組織加熱。
軸向和橫向分辨率:
為了確定MAPSI的軸向(z軸)分辨率,研究人員首先使用共焦顯微鏡從感染ChR2和RCaMP1jb的D1-Cre小鼠的腦切片記錄熒光信號,同時使用MAPSI刺激神經元。軸向分辨率和穿透深度如圖2b所示。研究結果發現,刺激小束的全寬半最大值(FWHM)約為30μm。同樣的實驗也在A2A Cre小鼠的腦切片上進行,結果相似。當激光光斑直徑為10μm時,檢測到的熒光幾乎為圓形,x軸的半高寬為10.5μm,y軸的半寬為9.8μm(圖2c)。熒光隨著照明區域的直徑增加而線性增加,并且隨著小光束更深入地穿透組織而強度降低(圖2d)。為了確定哪些神經元同時表達ChR2和jRCaMP1b,在低功率(~1mW mm)下連續激發JRCAMP1 B?2 為了獲得穩定的基線,ChR2以20Hz(20ms脈沖持續時間,20個脈沖,功率密度~50mW mm)激發?2). 在刺激期間,能夠通過靶向測量jRCaMP1b熒光信號的顯著增加神經元使用直徑為10μm的斑點(圖2d)。
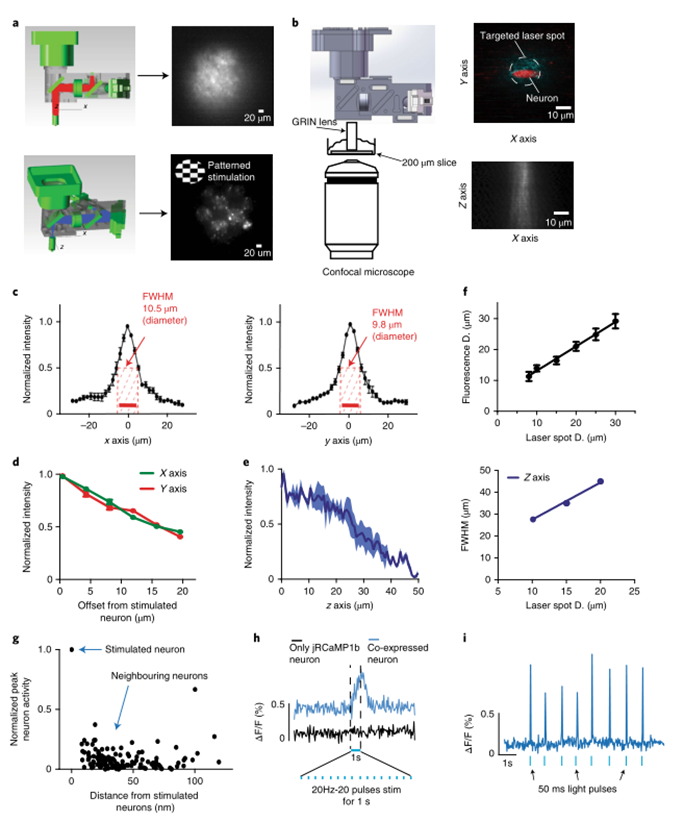
圖|mAPSI的高分辨率允許圖案化刺激和鈣成像
在自由活動的小鼠中測試:
MAPSI使得在實驗感興趣的行為期間活躍的單個神經元并回放其活動成為可能。為了模擬自然發生的神經活動模式,研究人員確定了在感興趣的行為期間活躍的神經元,在D1-Cre小鼠或A2A-Cre鼠中測試了MAPSI,長期植入GRIN透鏡(直徑1.8 mm,長度4.3 mm),生成了多個10μm小波束進行刺激,同時記錄FOV中所有神經元的鈣活性。單個DSPN或ISPN可以在不激活相鄰神經元的情況下被穩健地和選擇性地激活(圖3)。偶爾,位于受刺激神經元(圖3c中的神經元1)附近的非受刺激的神經元(如圖3c的神經元6)幾乎系統性地響應,但具有較長的潛伏期(圖3d)。這表明一些神經元可以通過電路連接被刺激間接激活。
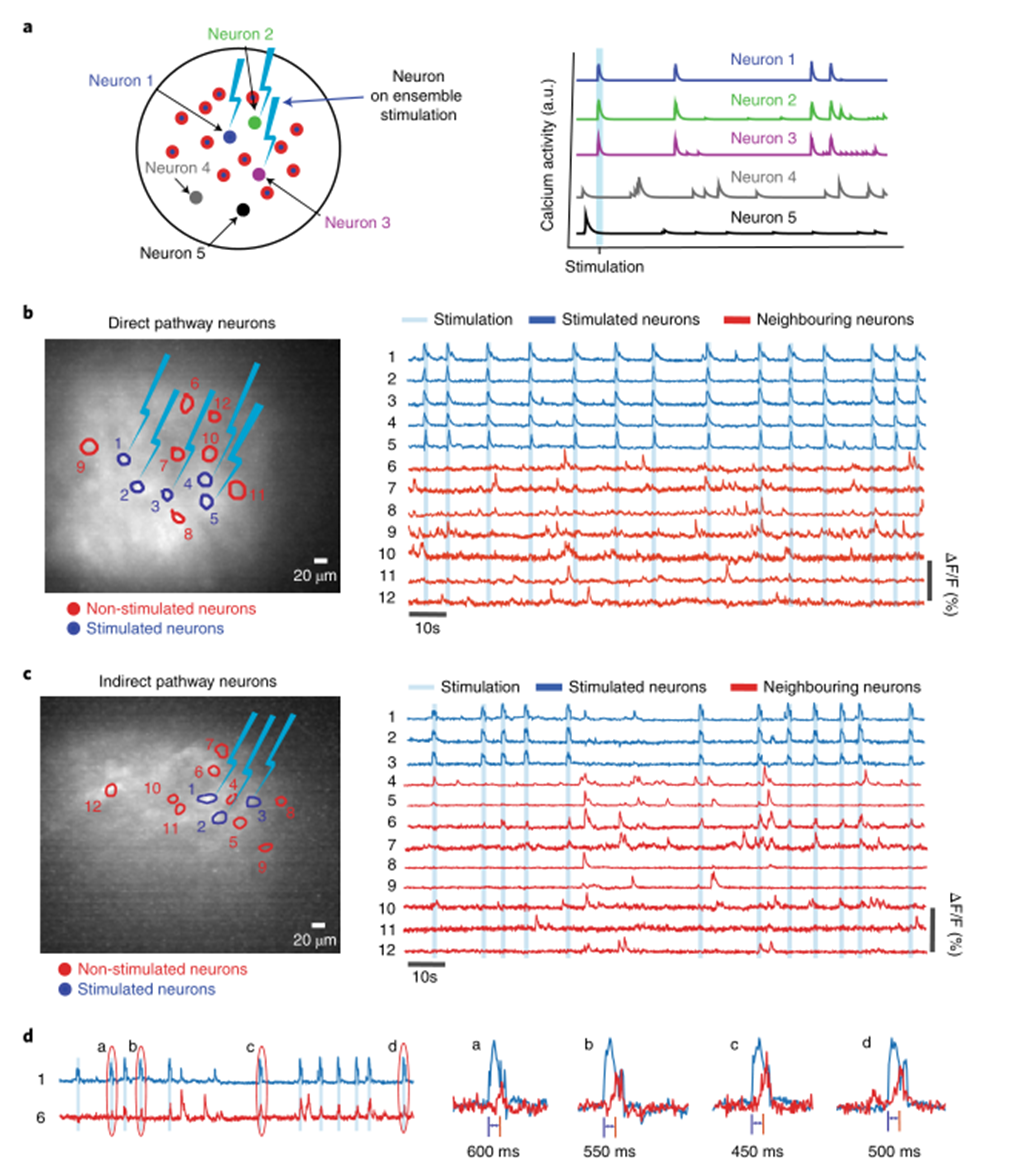
圖|自由行為動物中mAPSI刺激的分辨率
分離行為活躍的神經元并操縱其活動:
為了檢驗直接途徑激活的效果,研究人員將Cre依賴性jRCaMP1b和ChR2-eYFP注射到D1-Cre小鼠中,并將JRCAMP1 b注射到對照小鼠,同時記錄它們在開闊場地的行為(圖4a)。在DeepLabCut39中標記每個幀后計算轉角(圖4b,c)。使用頭-體向量的導數作為身體姿勢角偏差的度量,不論老鼠是否在行走。然后選擇15個轉向相關神經元(每只小鼠中5個神經元)進行刺激(圖4d所示的代表性小鼠)。對這些神經元的選擇性刺激引發了與小鼠自然的相當轉向(圖4g,h,與圖4b,e相比較)。令人驚訝的是,刺激5個神經元足以產生反向轉向。相反,刺激5個與轉向無關的相鄰神經元不會產生顯著轉向(圖4g,h)。接下來,研究人員用A2A Cre小鼠進行了相同的實驗(圖5a)。已知間接通路神經元的激活會產生同向翻轉。在354個記錄的ISPN中,36個與同向翻轉相關。于是選擇了12個神經元(每只小鼠視野中的4個神經元),它們在同向旋轉過程中表現出強烈的興奮(N=3只小鼠;圖5b,c)。然后,刺激這些轉向相關神經元(n=3只小鼠的12個神經元),產生同向轉向(圖5e,g)。還刺激了在轉向過程中不活躍的神經元,這不會產生顯著的同向轉向。此外,選擇性刺激的效果在時間上也是穩定的。
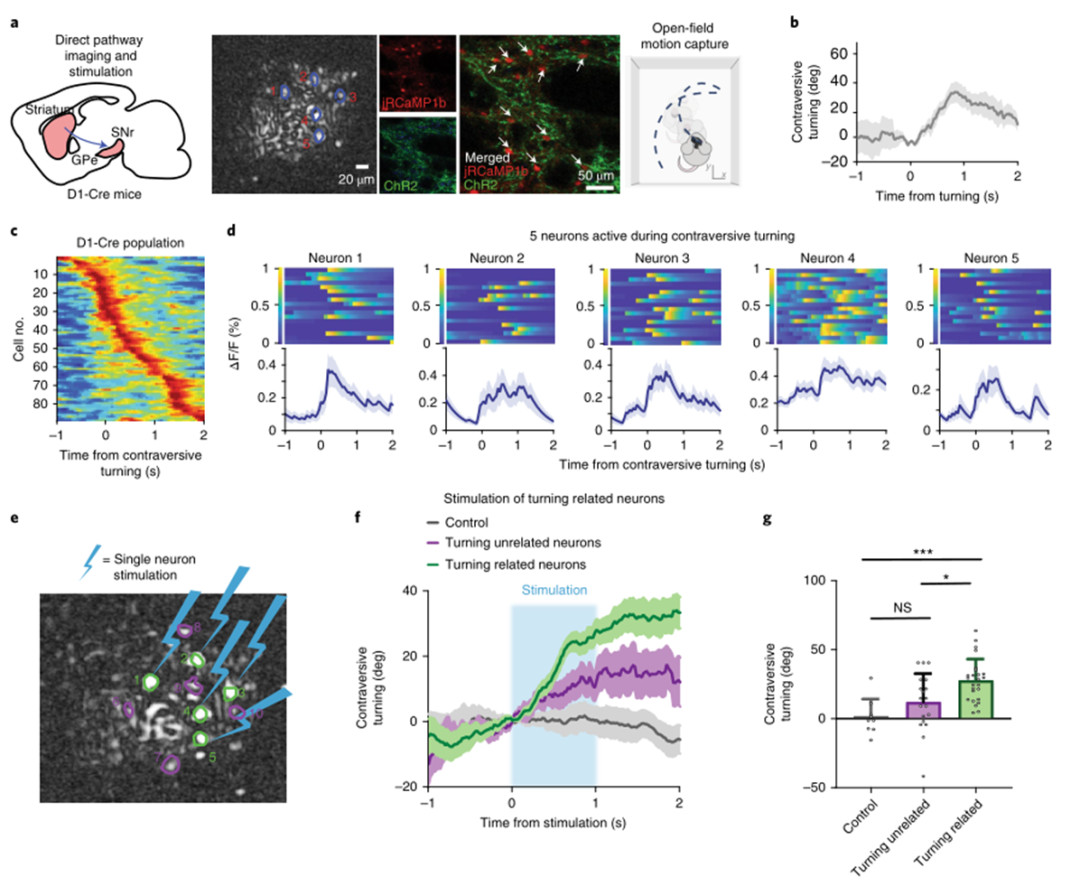
圖|激活直接通路神經元的復制反向轉向
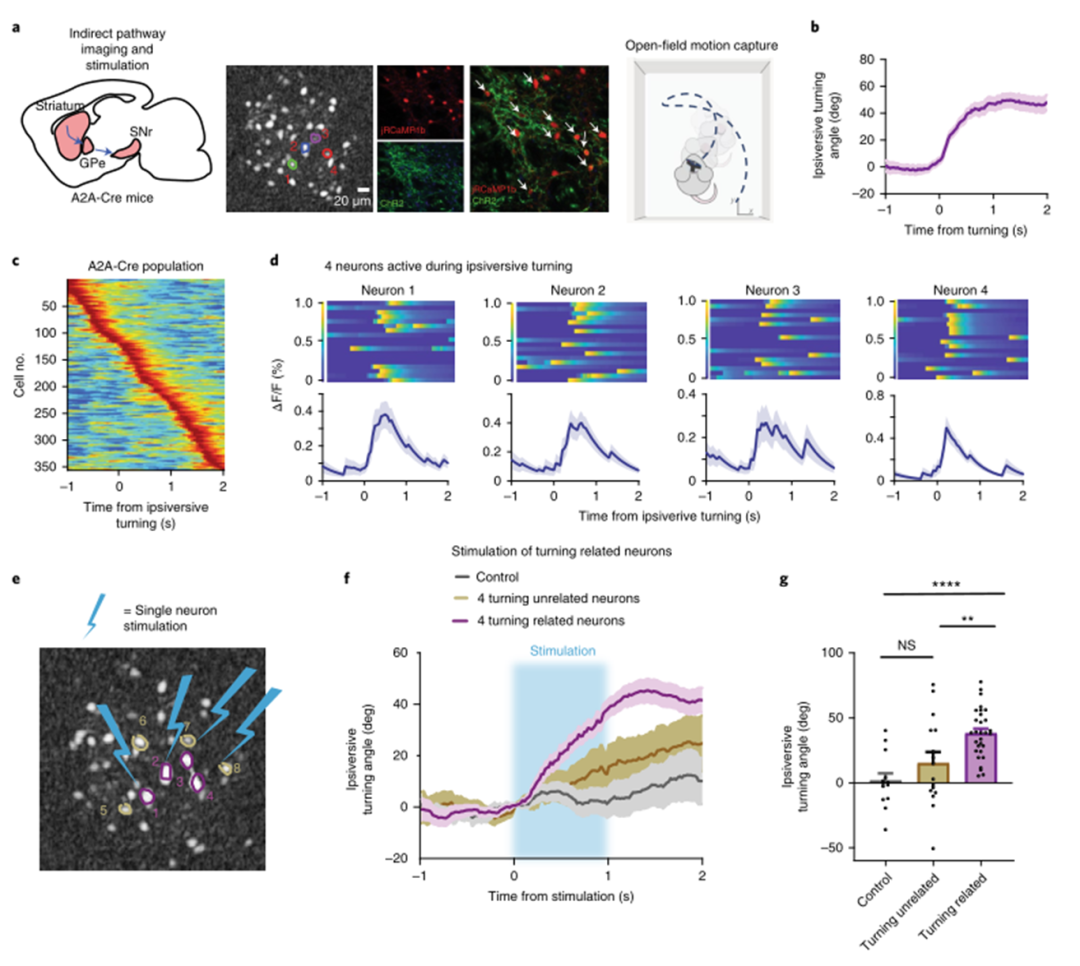
圖|選擇性刺激在同向翻轉過程中活躍的間接通路神經元可重現同向翻轉
合成刺激序列和掃描模式:
為了測試任意刺激模式的效果,研究人員使用兩種順序模式激活轉向相關神經元:從外側到內側(LM,從最外側的神經元開始)或從內側到外側(ML,從最內側的神經元開始)(圖6b,c)。這兩個序列都是反向轉向產生的(圖6d)。MAPSI還可以產生任意時空光模式來塑造神經活動。對DMD進行編程,以產生覆蓋約2%視場的矩形掃描圖案。在兩個半球的視場上使用了兩個不同的方向(ML或LM)(圖6f)。在D1-Cre小鼠(N=3)中,兩種模式都產生了相反的轉向,但不同的掃描方向(ML或LM)之間沒有顯著差異,而不管半球是否受到刺激(圖6g,h)。接下來,使用A2A Cre小鼠進行相同的實驗(圖7a)。研究人員鑒定了在同向翻轉過程中活躍的神經元,并使用與圖6(圖7b)中使用的相同序列模式。驗證了順序模式刺激期間的鈣活性(圖7c)。兩個序列都產生了同向翻轉,LM序列(#1)產生了更大的同向翻轉(圖7d)。然后,使用圖6中使用的掃描模式:在兩個半球的視場上進行ML或LM掃描(圖7f)。與對照組相比,矩形掃描(ML和LM掃描)顯著增加了同向旋轉,但不同掃描方向(ML或LM)之間沒有顯著差異(圖7g)。如果在5 s內掃過視野,ML和LM掃描刺激都比對照組產生了更多的轉向,并且LM與ML掃描相比產生了更大的轉向(圖7h)。
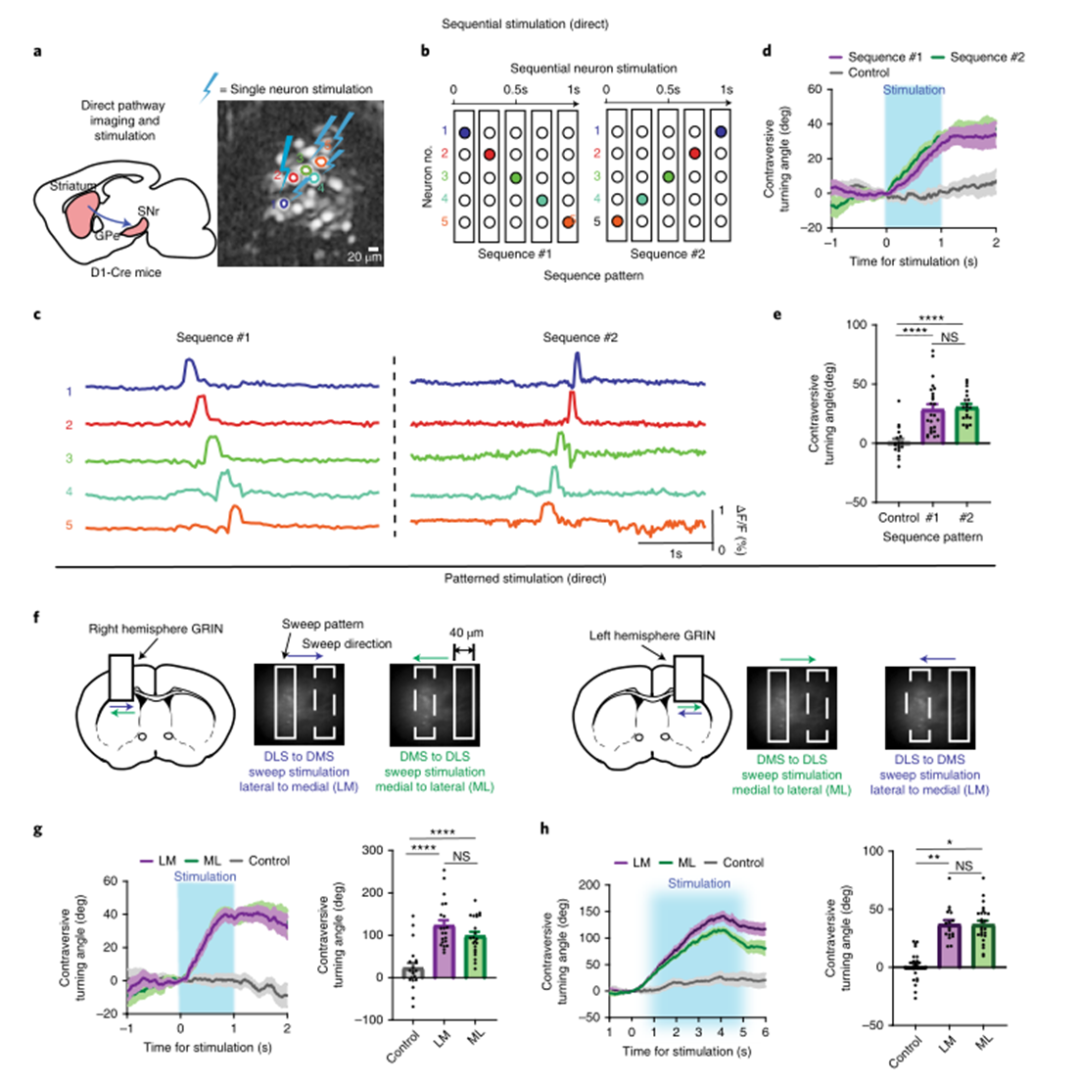
圖|直接通路的順序和模式化刺激導致反向轉向
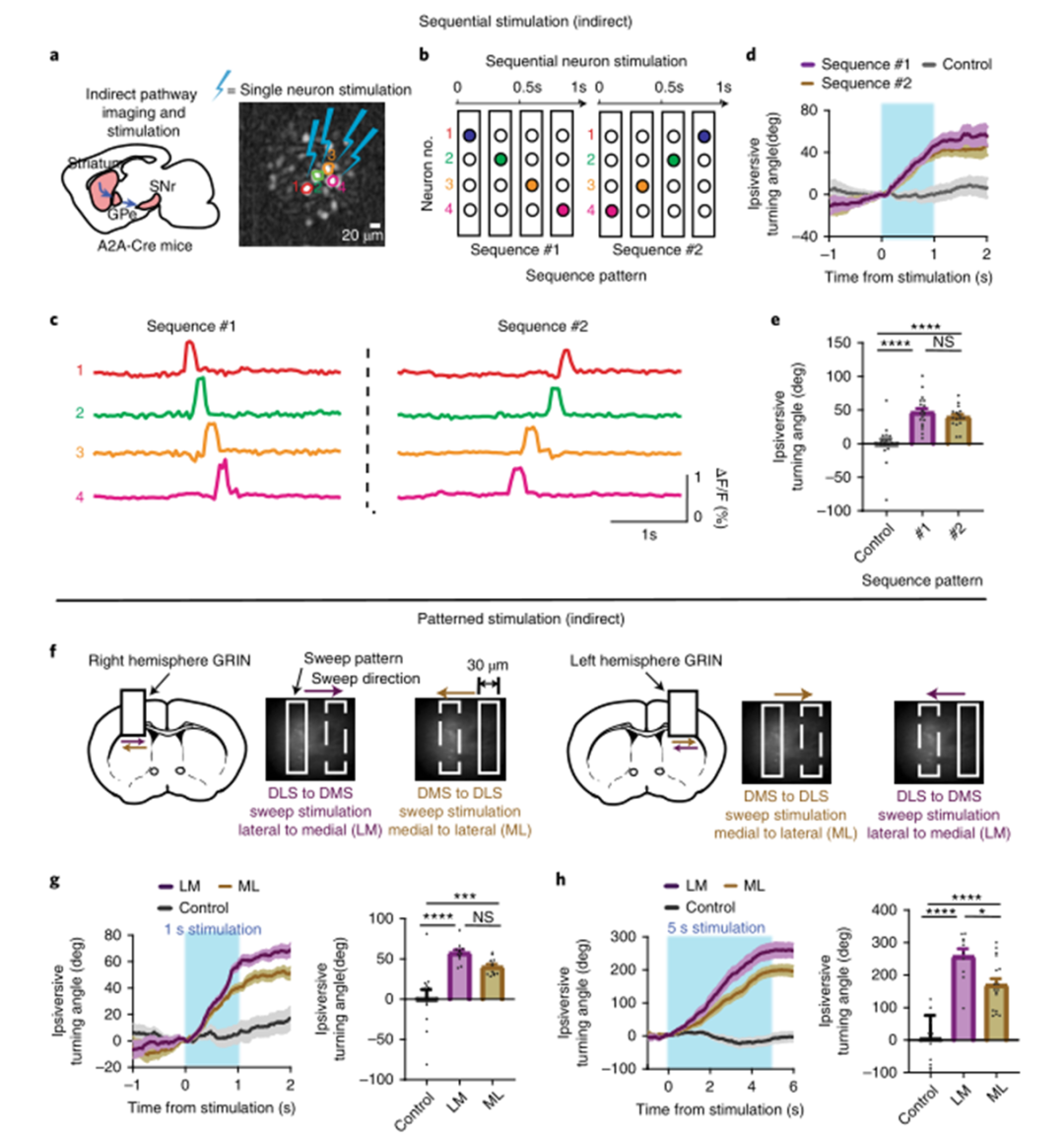
圖|間接通路的順序和模式化刺激導致同向性轉向
總結與展望:
MAPSI系統具有以下優勢與創新:
(1)提供近細胞分辨率刺激(圖1和2);
(2)刺激和記錄選定的神經元并同時記錄FOV中其他神經元的活動(圖3)
(3)識別在特定行為期間活動的神經元,然后選擇性地激活相關的神經元群以再現該行為(圖4和5)
(4)用刺激重建記錄的時空模式;
(5)在FOV中合成任意刺激模式(圖6和7)。
在MAPSI中,由于雙光束路徑相互獨立,因此選擇用于刺激的神經元可以與FOV中其他神經元的活動同時記錄。因此,它允許在自由移動的動物中同時操作和記錄任何記錄的神經元。因此,MAPSI可用于詢問神經元回路功能并研究神經和精神疾病的小鼠模型。簡而言之,由于其可移植性和低成本,MAPSI為理解行為的神經基礎提供了一個強大的工具。
參考文獻:
Zhang, J., Hughes, R.N., Kim, N.et al. A one-photon endoscope for simultaneous patterned optogenetic stimulation and calcium imaging in freely behaving mice. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00920-3











