分子捕捉鍵在生物學中無處不在,對于白細胞外滲和細胞機械傳感等過程至關重要。與普通(滑動)鍵不同,捕捉鍵在張力下會加強。當前的范式是該功能提供“按需強度”,從而使細胞能夠在壓力下增加剛性。然而,捕獲鍵通常比滑動鍵弱,因為它們具有通常被掩埋的神秘結合位點。
鑒于此,荷蘭原子與分子物理研究所Gijsje H. Koenderink、Sander J. Tans和普渡大學Taeyoon Kim等研究人員表明捕獲鍵使重組的細胞骨架肌動蛋白網絡比滑動鍵更強,即使單個鍵時候是較弱的。
模擬表明,滑動鍵仍然被困在無應力區域,而弱結合允許捕捉鍵通過移動到高張力區域來減輕裂紋萌生。這種“按需解離”解釋了細胞如何將機械強度與形狀變化所需的適應性相結合,并且與捕獲結合受損的疾病相關。研究人員推測,捕獲鍵是創造類似生命的材料的關鍵。

弱捕獲鍵和強滑動鍵
研究人員利用與遺傳性疾病腎局灶節段性腎小球硬化 1 型相關的肌動蛋白結合蛋白 α-actinin-4及其 K225E 點突變體來確定捕捉鍵在肌動蛋白網絡機械特性中的作用。肌動蛋白與其他細胞骨架蛋白一起是細胞力學的關鍵決定因素。為了分離捕捉鍵在肌動蛋白力學中的作用,研究人員從純化的成分中重構了肌動蛋白網絡。
基于晶體結構,先前推測力會激活 α-actinin-4 的一個神秘的肌動蛋白結合位點,因此表現得像一個捕捉鍵。此外,有人提出隱秘的肌動蛋白結合位點被 K255E 點突變暴露,增加了 α-actinin-4 的結合親和力,但也消除了它的捕獲鍵行為。為了直接測試這個想法,研究人員通過 DNA 手柄將單個 α-actinin-4 分子連接到聚苯乙烯珠子上,并探測它們與熒光標記的肌動蛋白絲的結合。使用光鑷和熒光成像驗證了早期推測,即 α-actinin-4 形成弱捕獲鍵,而 K255E 點突變體形成強滑動鍵。
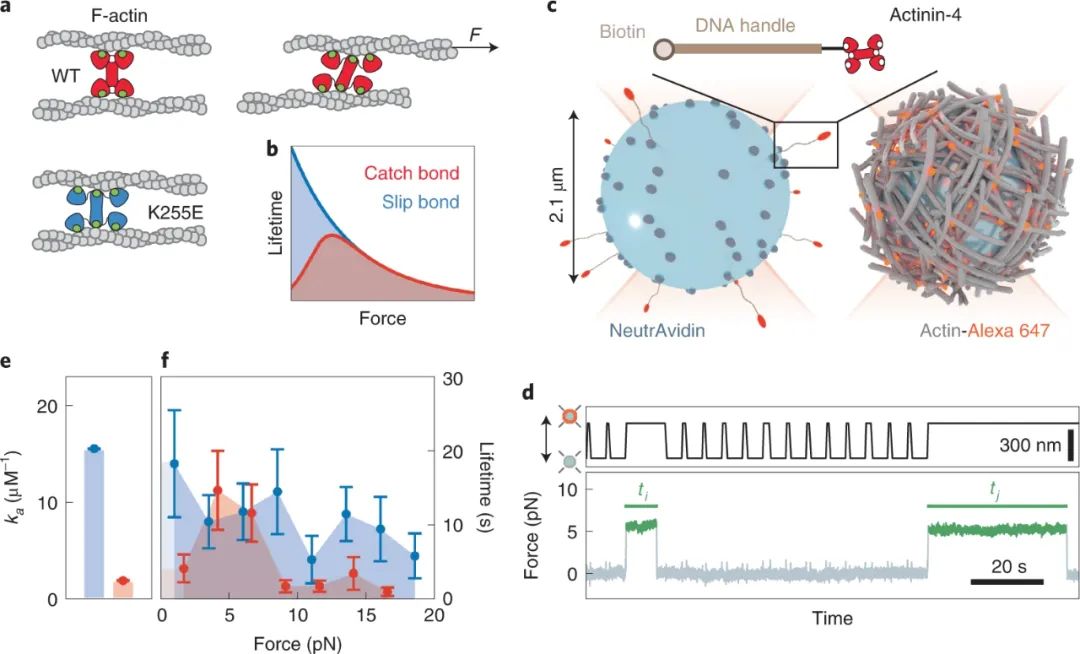
圖|肌動蛋白絲結合的單分子測量揭示了 WT α-actinin-4 的捕獲結合,而不是 K255E 突變體。
捕獲鍵單鍵雖弱,但網絡更強
捕獲鍵比滑動鍵弱的觀察提出了一個問題,它們是否也形成了較弱的網絡。為了測試交聯肌動蛋白網絡的強度,研究人員在流變儀的錐體和板之間將肌動蛋白與任一交聯劑共聚,并通過旋轉錐體及時線性增加機械載荷(剪切應力),直到網絡因網絡變形而破裂(應變)被記錄下來。研究發現,在 10?°C 下,由 α-actinin-4 捕獲鍵交聯的網絡不僅比任何一種滑移鍵網絡更易變形(斷裂應變為 221?±?16%),而且更強(斷裂應力24.5?±?2.7?Pa)。
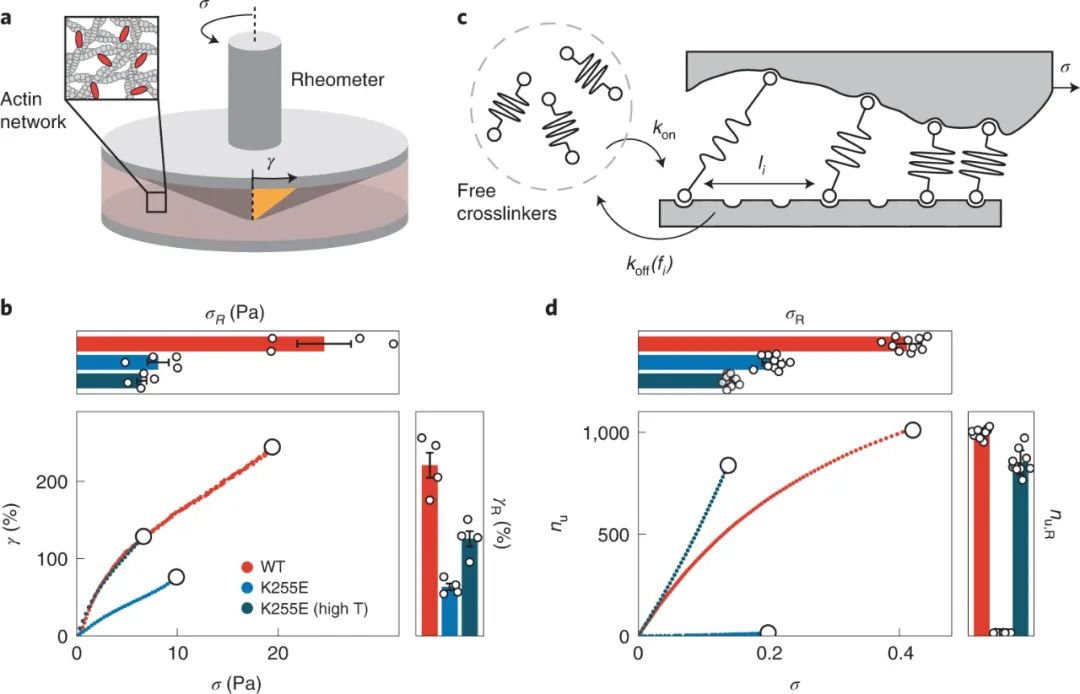
圖|捕捉鍵同時增強細胞骨架肌動蛋白網絡的機械強度和可變形性
模型模擬驗證
捕捉鍵如何擺脫正常(滑動)鍵固有的強度和可變形性之間的權衡?為了回答這個問題,研究人員開發了一個最小模型。模擬表明,較弱的捕捉鍵共同使網絡比滑動鍵網絡更強(在幾乎兩倍的壓力下破裂),但更易變形(在破裂前有十倍的鍵周轉)。該模型還證實了實驗觀察結果,即在保持滑動鍵響應的同時簡單地降低鍵壽命會導致較弱的網絡。
最小模型表明,捕獲鍵通過重新分配到緊張區域來加強網絡
機制分析
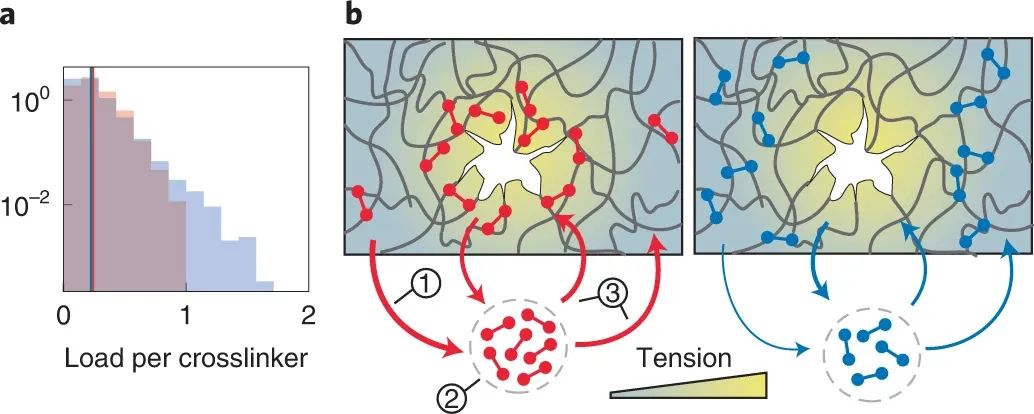
為了確定捕捉鍵顯著機械優勢背后的機制,研究人員量化了每個單獨交聯劑的負載的穩態分布。在給定的宏觀載荷下,與滑動鍵相比,捕捉鍵的每個鍵的平均力僅略高。然而,捕捉鍵的力分布比滑動鍵的分布要窄得多,這意味著滑動鍵網絡包含更多的承受高載荷的鍵,因此更容易斷裂。值得注意的是,與滑動鍵相比,斷裂捕獲鍵網絡需要兩倍大的間隙。這些發現表明,由于在較低負載下的壽命較短,捕獲鍵會從低應力區域“按需解離”,從而釋放可以在高應力區域重新結合的交聯劑,從而防止裂紋的產生。模擬還表明,當捕獲鍵不動時,捕獲鍵相對于滑動鍵的機械優勢確實會喪失。

圖|詳細的肌動蛋白網絡模擬證實了通過按需解離來加強捕獲鍵網絡
小結:
該工作揭示了細胞骨架中捕獲鍵的新作用,即同時提高其機械強度和變形能力。與通常的直覺相反,捕捉鍵按需提供強度,該模型表明,它們形成強大的網絡,因為按需解離使它們能夠重新分布到緊張區域,從而推遲裂紋萌生。這一機制可能也適用于活細胞,因為α-肌動蛋白-4在肌動蛋白皮質內是可移動的。α-肌動蛋白-4的力傳感器類似于其他蛋白的力傳感器,可以開發并以單分子分辨率進行解析,以直接可視化重組肌動蛋白網絡和活細胞中捕獲和滑動鍵的負荷依賴性重分布。
該研究結果還表明,捕捉鍵在細胞骨架和細胞界面中廣泛存在,以打破這種可變形性/強度折衷,研究更多交聯劑和粘附素的力依賴性結合將很有趣,例如細絲蛋白和免疫球蛋白樣細胞粘附分子。最后,本文的研究結果提供了一種受細胞啟發的途徑來制造水凝膠材料,這些材料既堅固又足夠可變形,可用于再生醫學。近年來,聚合物界的理論和實驗工作激增,以創造更堅韌的水凝膠,例如,通過在水凝膠中加入剛性元素。然而,這些方法主要集中在防止裂紋擴展而不是裂紋萌生。防止裂紋擴展可以很好地吸收有限量的機械能,但在恒定應力的情況下提供的優勢有限。對于未來的工作,將裂紋萌生和擴展的緩解策略結合起來會很有趣。最近發現了捕捉鍵的合成類似物,并為開發高動態但強大的仿生材料提供了一個極好的起點
參考文獻:
Mulla, Y., Avellaneda, M.J., Roland, A. et al. Weak catch bonds make strong networks. Nat. Mater. (2022).
https://doi.org/10.1038/s41563-022-01288-0











