
第一作者:穆曉宇,王駿瀅,何化
通訊作者:張曉東
通訊單位:天津大學
背景介紹
人工酶具有穩定性高、合成簡單、成本低廉等優點,在疾病診斷和生物技術領域引起了人們的廣泛關注。遺憾的是,人工酶的催化速率在很大程度上受限于其材料表面的電子轉移,這極大地制約了人工酶的催化活性和生物活性。天津大學張曉東教授團隊發現了一種具有超快電子轉移和超高催化活性的低聚納米酶(O-NZ)。研究結果顯示,O-NZ表現出1.8 ns的超快核心電子轉移,實現了較高的類超氧化物歧化酶(SOD)活性和可與天然酶媲美的類谷胱甘肽過氧化物酶(GPx)活性。同時,O-NZ在核心和表面基團之間也達到了1.2 ps的超快電子轉移,從而可在幾毫秒內清除O2?-、?NO 和 ONOO-自由基。動物實驗發現O-NZ能使重度急性腦損傷(TBI)小鼠的存活率從50%提高到90%,并促進長期神經認知功能的恢復。生化實驗表明O-NZ可通過核因子紅血球-2相關因子(Nrf2)介導的血紅素加氧酶-1(HO-1)表達上調來減輕急性神經炎癥。這項工作清楚地表明,具有催化活性和選擇性的超快納米酶是治療神經系統疾病的重要候選藥物。
研究結果
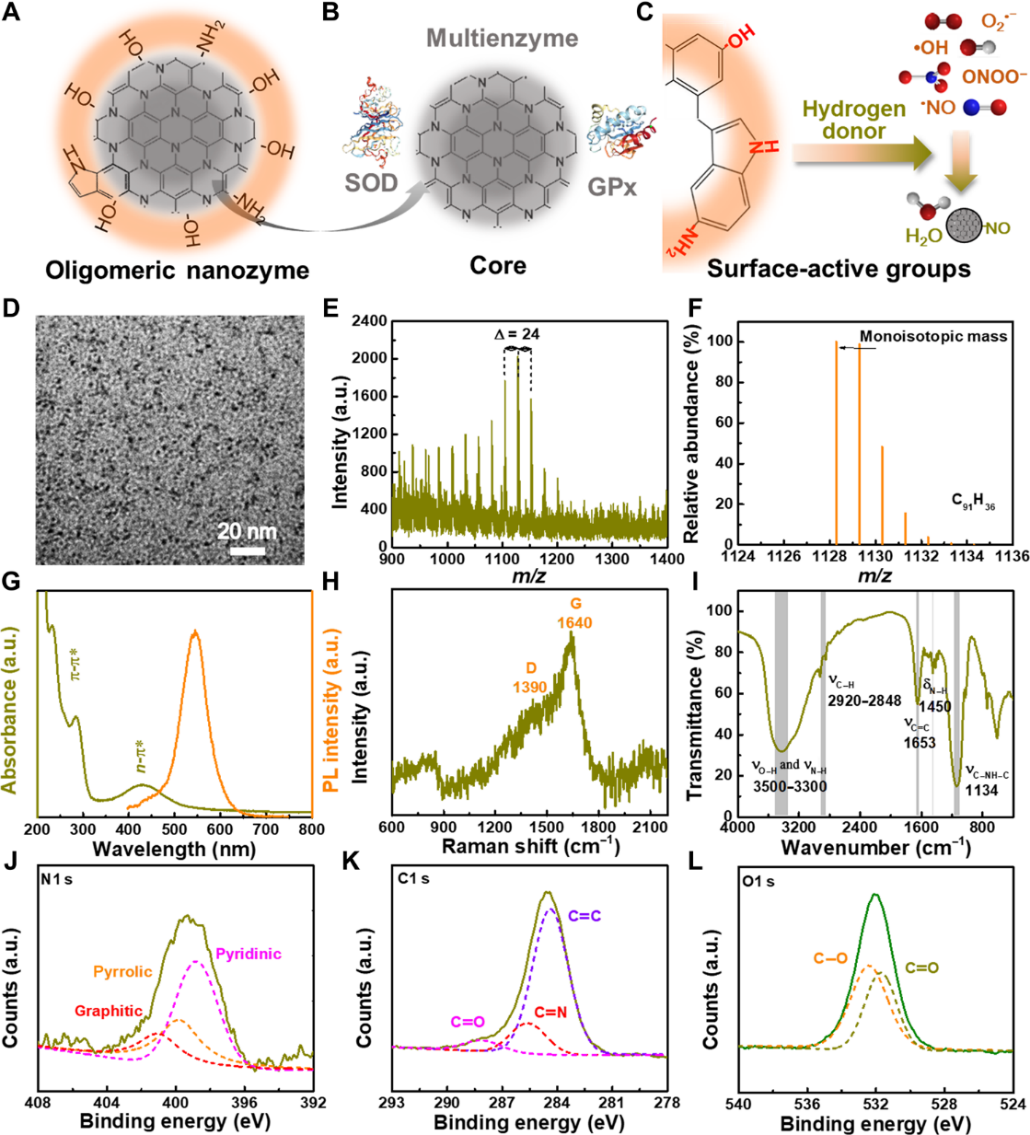
圖1:O-NZ的設計和表征:A/B/C 結構示意圖;D 透射電子顯微鏡圖;E 飛行時間質譜;F模型計算的同位素譜;G 紫外吸收和發射譜;H 拉曼光譜;I 傅立葉轉換紅外光譜;J/K/L X射線光電子能譜。
圖1表明O-NZ具有超小尺寸和半導體特性,主要以多氮摻雜的石墨結構作為核心,以酰胺、羥基、吡咯N基團作為表面活性官能團。
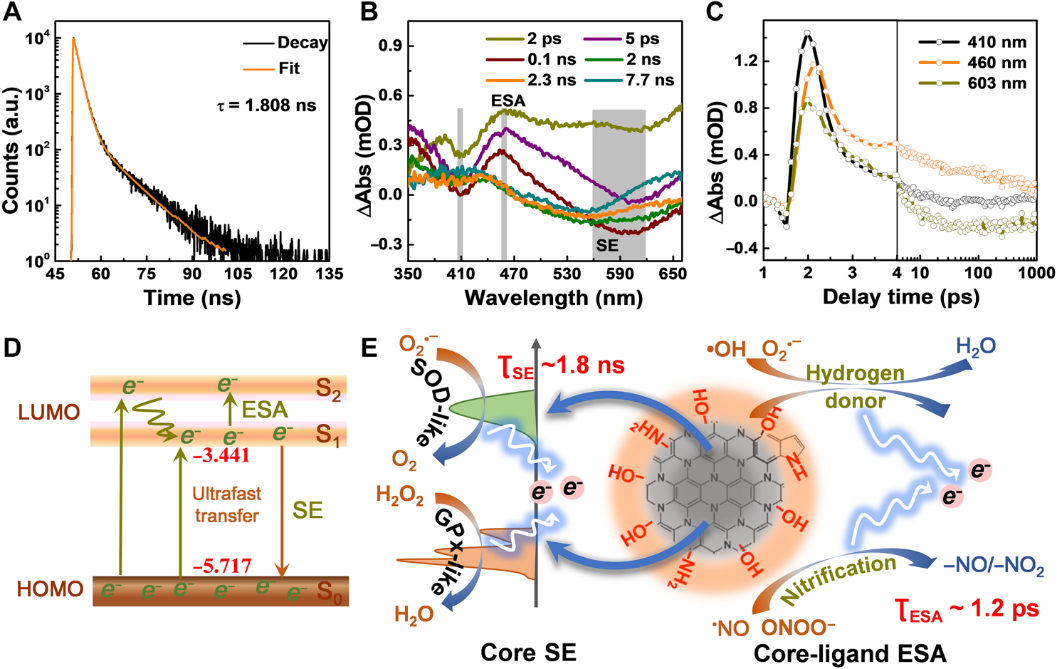
圖2:O-NZ的超快電子轉移動力學測試:A 時間分辨光致發光光譜;B/C 瞬時吸收光譜;D/E 超快電子轉移過程示意圖。
圖2表明O-NZ具有超快的電子轉移特性。考慮到石墨碳核的本質,O-NZ的π-共軛域可以促進電荷轉移和電子存儲。此外,O-NZ的結構缺陷可以促進界面電子轉移,O-NZ的表面官能團也可以作為電子給體。因此,O-NZ表現出1.8 ns的超快核電子轉移,這可能決定了其類酶特性。同時,在核和表面配體之間發生了1.2 ps的超快電子轉移,這可能決定了其自由基清除活性。
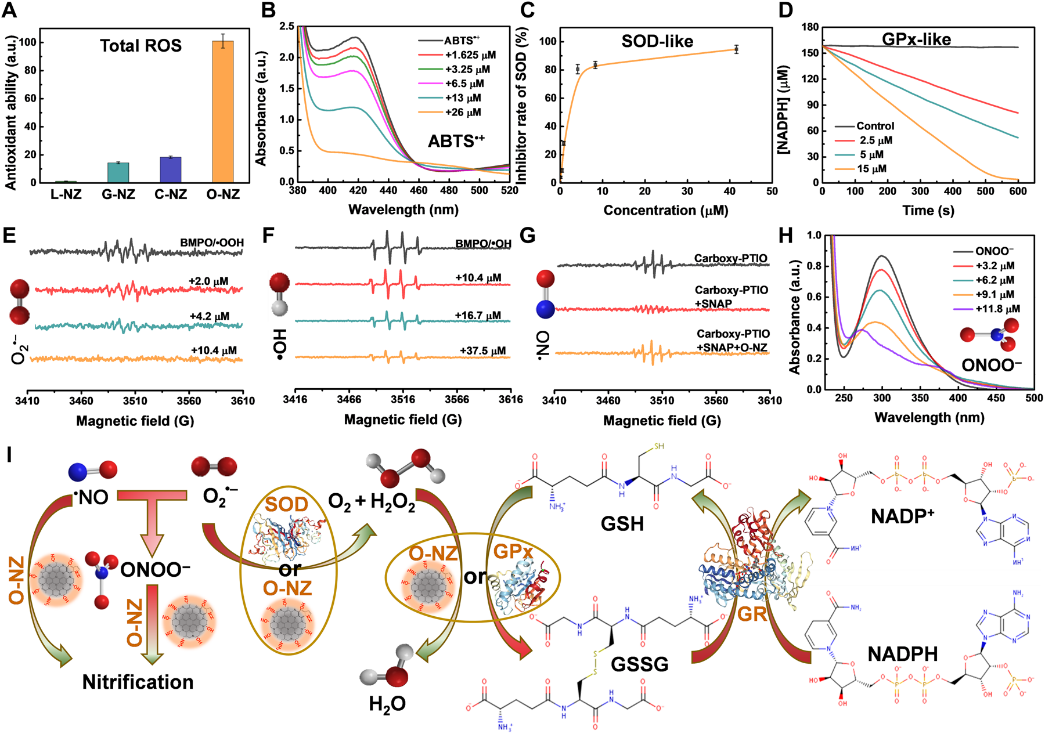
圖3:O-NZ的RONS清除特性:A 不同納米酶對ROS的總抗氧化能力的比較;B 不同濃度的O-NZ對ABTS?+的清除曲線;C/D O-NZ的類SOD/GPx活性;E/F/G/H O-NZ對不同自由基的清除實驗;I O-NZ清除RONS和類酶的路徑示意圖。
基于上述電子轉移研究,另一方面我們發現O-NZ其對RONS具有很強的供電子能力,其總抗氧化活性優于其他碳納米酶類似物(L-NZ、C-NZ和G-NZ)大約一個數量級(圖 3A)。O-NZ表現出優異的類SOD和類GPx活性(圖 3C/D),同時對RONS具有較高的清除活性,特別是對活性更高的O2??和?NO和ONOO?(圖 3E/F/G/H)。
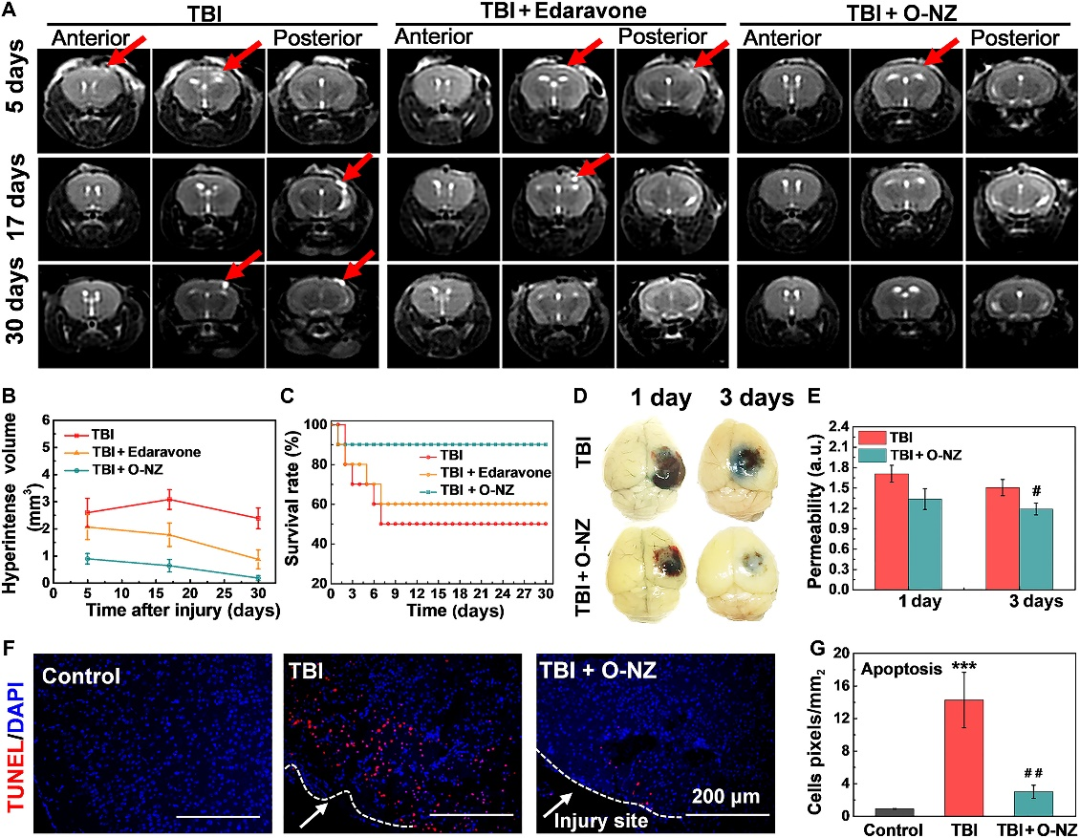
圖4:O-NZ減少小鼠TBI后繼發性損傷的擴散:A O-NZ治療后TBI小鼠腦T2加權MRI;B 量化不同治療組繼發性損傷的體積;C O-NZ治療后TBI小鼠在30天內的存活率;D/E 腦EB染色和血腦屏障通透性分析;F/G TUNEL檢測損傷后腦組織中的凋亡細胞。
該研究進一步構建了TBI動物模型并考察了經O-NZ治療后TBI小鼠存活率和繼發性損傷擴散水平。結果表明O-NZ 治療能夠有效減少繼發性損傷的擴散(圖4A和B),顯著提升TBI小鼠的存活率(圖4C),加速血腦屏障的修復(圖4D和E)。
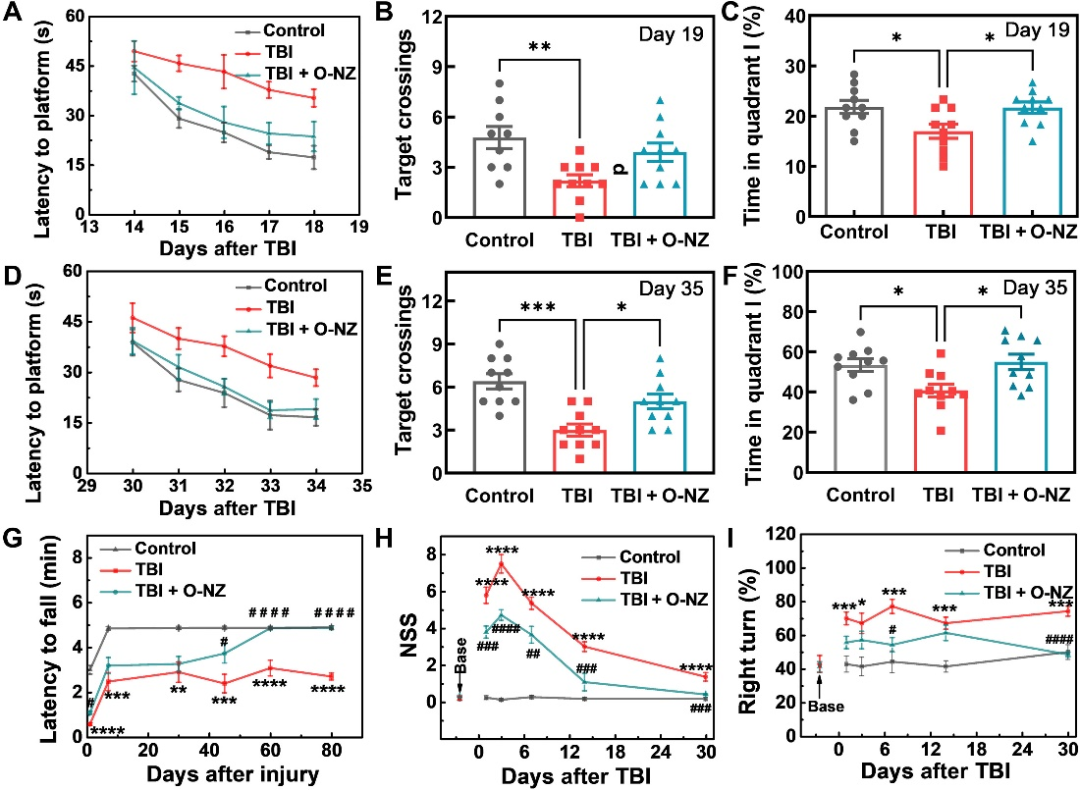
圖5:O-NZ治療后的小鼠行為學:A/D小鼠不同時間段訓練期間的變化;B/C/E/F小鼠不同時間段測試期間的變化;G 跑步訓練測試;H神經損傷嚴重缺損評分;I 轉角實驗。
為了進一步評估O-NZ治療對TBI后神經系統恢復的促進作用,該研究對小鼠進行了一系列行為測試。結果表明O-NZ治療有助于神經功能缺損評分(NSS)、運動功能、空間學習和記憶方面的明顯恢復。
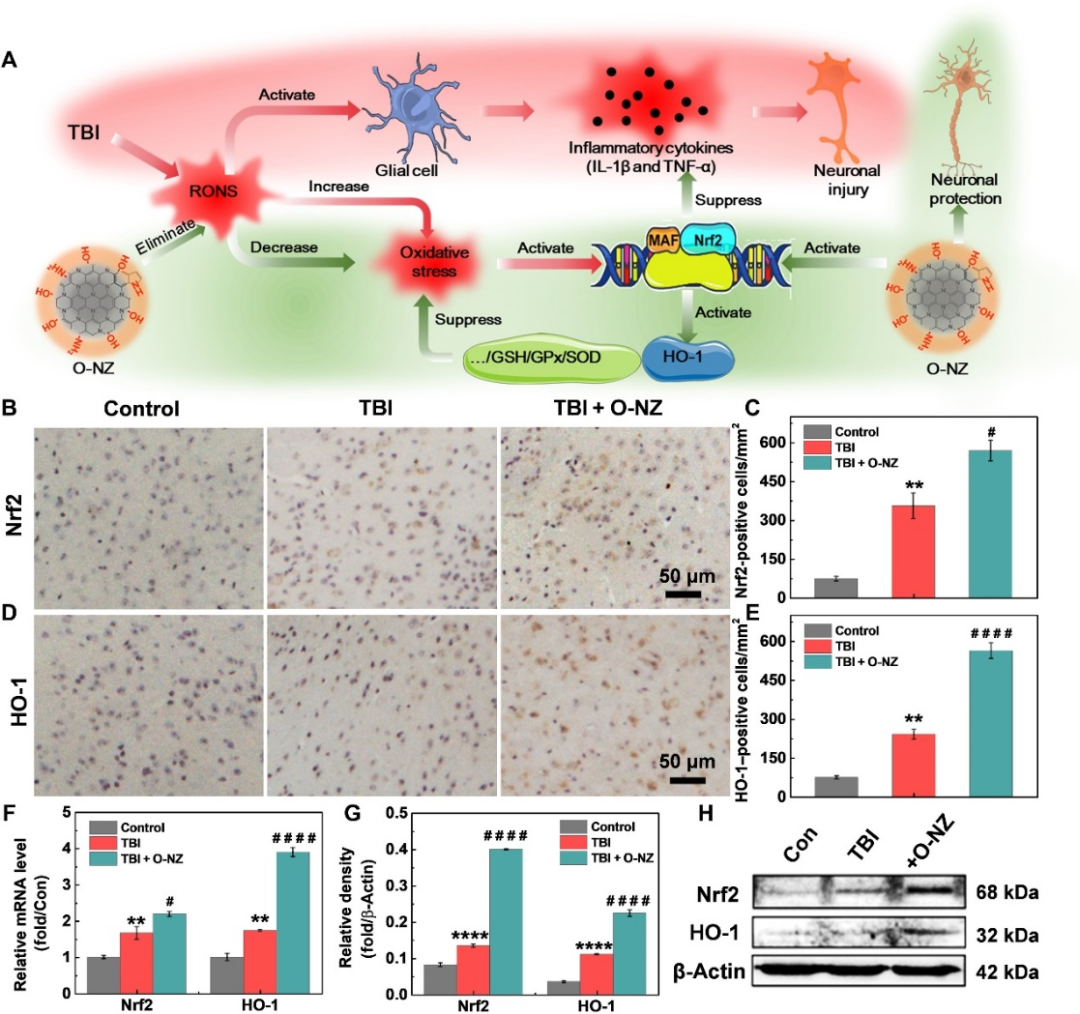
圖6:O-NZ治療腦損傷的分子機制:A 通過Nrf2介導上調HO-1表達的O-NZ治療TBI的分子機制示意圖;B/C/D/E Nrf2和HO-1的免疫組化分析;F Nrf2和HO-1的mRNA水平;G/H Nrf2和HO-1的WB水平。
最后進行了系統的定量聚合酶鏈反應(RT-qPCR)、Western blot實驗和免疫組化(IHC)染色(圖6)分析,結果表明O-NZ通過上調Nrf2和HO-1的表達改善氧化應激和神經炎癥。
研究總結
1. O-NZ通過超快電子轉移表現出高的總抗氧化活性和類SOD/GPx的催化選擇性。
2. O-NZ對高活性O2?-、ONOO-以及?NO表現出優異的清除能力。
3. O-NZ可將急性TBI小鼠的存活率從50%提高到90%,并且有效改善TBI小鼠的長期行為,包括空間記憶、認知和功能性肢體控制等。
4. O-NZ通過激活Nrf2/HO-1信號通路緩解神經炎癥。
參考文獻:
Xiaoyu Mu, et al. An oligomeric semiconducting nanozyme with ultrafast electron transfers alleviates acute brain injury, 2022, Sci. adv.
DOI: 10.1126/sciadv.abk1210











