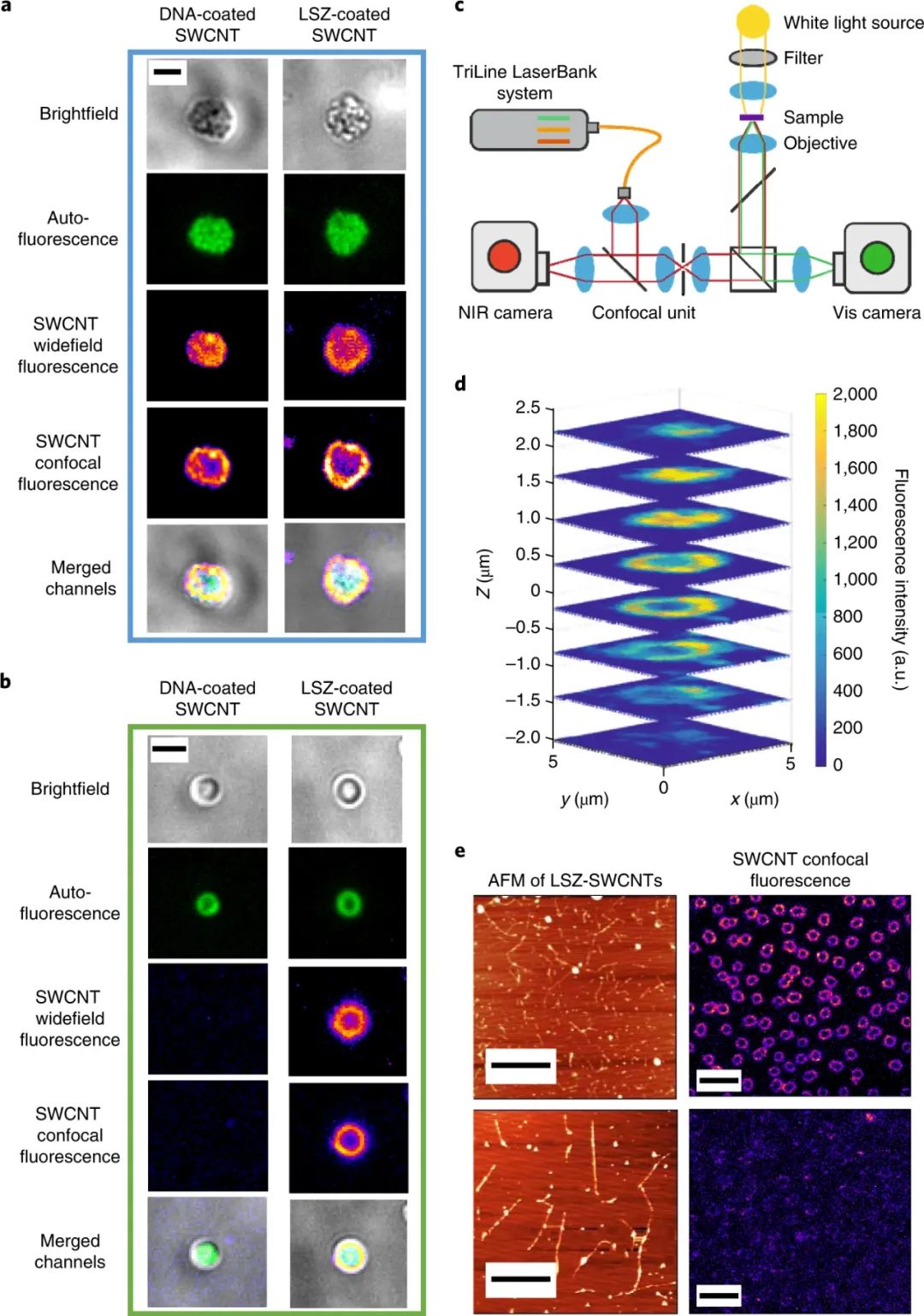
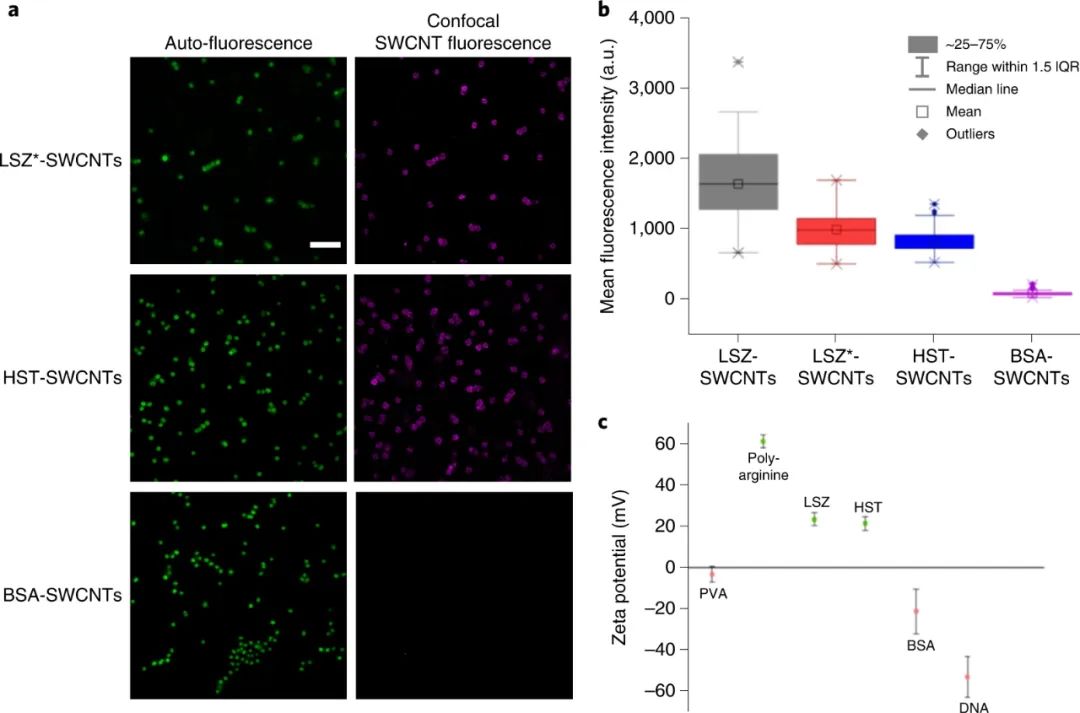
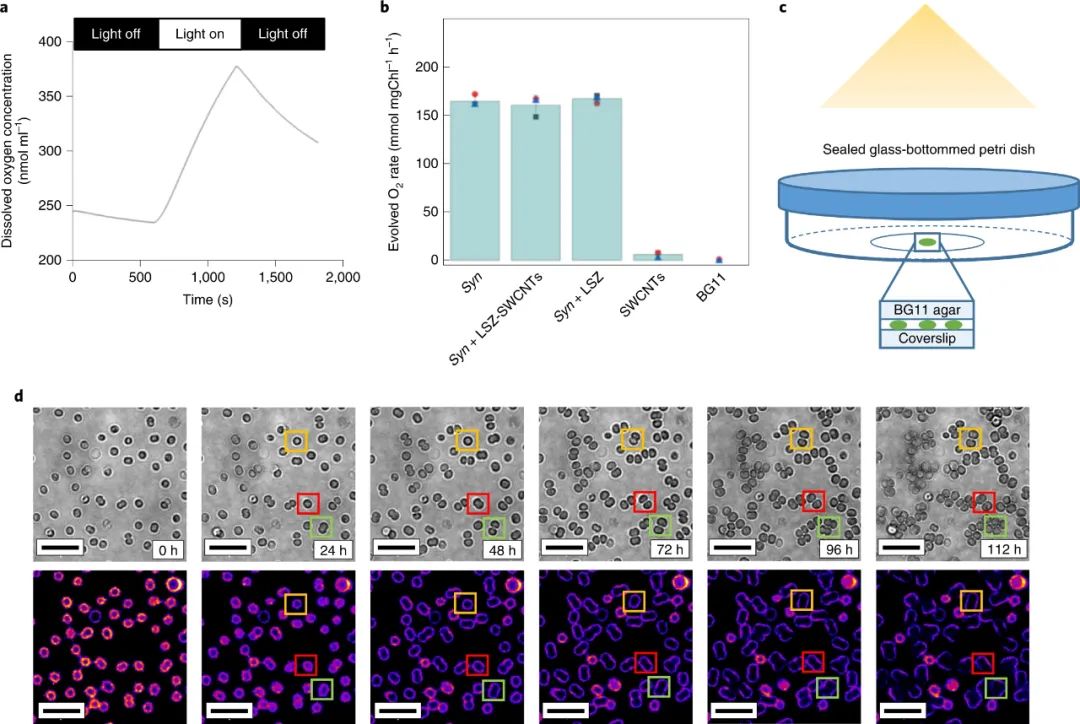
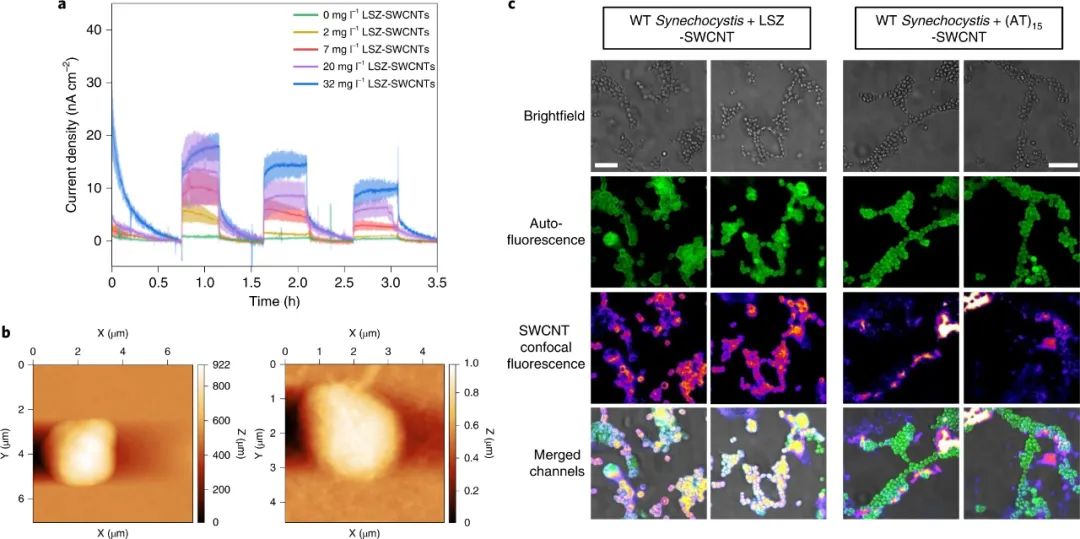
碳納米管在活細胞中的內化形成了細胞成像、基因和藥物遞送以及其他生物和醫學全細胞應用新技術的基礎。許多合成和生物分子可以固定在碳納米管的表面上,當適當地官能化時,它們能夠跨越生物屏障并結合到特定的分子靶標上。單壁碳納米管 (SWCNT) 具有獨特的光電特性,非常適合光療、成像和傳感。與傳統的熒光探針不同,半導體SWCNT的電子帶隙允許這些納米結構在很寬的電磁光譜范圍內吸收光,并將吸收的能量重新發射為近紅外 (NIR) 熒光。這種熒光在連續暴露于高強度照明時保持光穩定性,從而實現長期、連續和定量的光學傳感和成像。此外,熒光不同于在可見光范圍內發射的生物熒光團的自發熒光。單壁碳納米管已被用于細胞核和核周區域的亞細胞靶向,并且它們的半導體特性已被用于癌細胞的光療治療。鑒于此,洛桑聯邦理工學院Ardemis A. Boghossian等研究人員探索了 SWCNTs 在革蘭氏陰性藍藻中的吸收,并證明了用帶正電荷的生物分子裝飾的 SWCNTs 的被動長度依賴性和選擇性內化。該研究專注于光合營養的藍藻,它具有復雜的細胞壁,通透性降低。雖然 SWCNT 已用于真核生物的遞送應用,但它們在用于這些光合原核生物中具有額外的優勢。此外,可見區域藍藻的自發熒光與通常用于生物成像和傳感的熒光團的熒光重疊。但這種限制可以通過 SWCNT 的 NIR 發射來克服。研究人員將SWCNTs用各種涂層進行非共價功能化,以保持 SWCNT 熒光,隨后篩選它們的內化效率。研究人員表明,與DNA涂層相比,溶菌酶涂層的SWCNT 自發地穿透單細胞菌株和多細胞菌株的細胞壁。為了確定 LSZ-SWCNT 在細胞內的精確分布,研究人員使用定制的旋轉圓盤共聚焦顯微鏡對自體熒光細胞內明顯的近紅外 SWCNT 熒光進行成像,揭示了 SWCNT 的高度不均勻分布。通過共聚焦 NIR 熒光顯微鏡使用延時體內細胞成像研究細胞分裂前后的 SWCNT 分布。在用 LSZ-SWCNTs 處理后,大多數集胞藻細胞表現出持續生長,正常的細胞形態和分裂超過100 小時。對分裂后納米粒子分布的更仔細檢查表明,結合在原始細胞中的一部分 SWCNT 被轉移到子細胞中。與非分裂細胞相比,研究人員觀察到近紅外熒光更明顯的減少。每個分裂細胞的NIR熒光隨著每一代而降低。膜中納米管的稀釋主要是由于每一代新形成的膜的數量增加。因此,NIR 強度可用于從單個圖像推斷細胞的生成。因此,熒光強度也可用于區分分裂細胞和非分裂細胞,后者顯示出更高的近紅外熒光。雖然這里沒有徹底研究細胞內傳感應用,但納米管已證明的 NIR 熒光靈敏度為監測自體熒光細胞(如藍藻)中的代謝通量提供了有希望的途徑。重要的是,SWCNTs 也被證明可以提高體內和體外光合作用光反應的效率。存在SWCNT時光電流的增強可歸因于細胞粘附和內化隔室的跨膜橋接的差異。如本文所展示的,這種增強促進了它們在基于能量的應用中的使用,例如活光伏。綜上所述,該研究探索了基于活原核細胞的納米仿生應用。除了闡明原核納米顆粒吸收和蛋白質傳遞的基本機制外,研究人員還展示了基于 SWCNT 的納米仿生學在增強生物光伏器件和跨代成像方面的應用。這種跨代追蹤不僅可用于推斷細胞的倍增歷史,因為已知集胞藻細胞在交替的垂直平面上分裂,而且還可用于推斷細胞的膜進展。這些觀察最終指向了在沒有任何基因操作的情況下,幾代人之間生物體的合成增強。這一遺傳納米仿生學的演示為工程生命、分裂細胞提供了新的可能性,其能力超出了自然界中發現的能力。Antonucci, A., Reggente, M., Roullier, C. et al. Carbon nanotube uptake in cyanobacteria for near-infrared imaging and enhanced bioelectricity generation in living photovoltaics. Nat. Nanotechnol. (2022).https://doi.org/10.1038/s41565-022-01198-x