1. Nature:在超薄膜中通過分子的大環結構構建連續孔
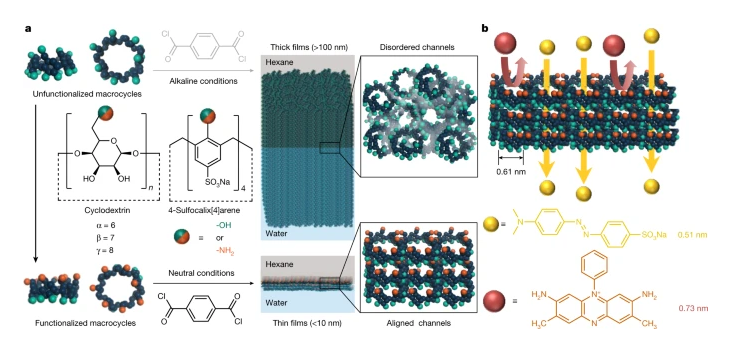
聚合物薄膜材料廣泛的應用于脫鹽、有機溶劑納濾、原油分餾等,但是聚合物材料的孔結構對分子的數目難以非常準確的進行定義,控制亞納米孔道的尺寸具有非常大的挑戰。具有本征孔的大環分子具有解決這個挑戰性問題的前景。但是沒有功能基團修飾的大環分子在堆疊過程中形成厚度為數百納米的薄膜時通常缺乏規律性,導致孔之間無法相互規則排列形成貫穿孔。有鑒于此,帝國理工學院Andrew G. Livingston等報道對大環分子進行選擇性的官能團化修飾,從而實現了選擇性的反應活性,能夠在超薄納米薄膜的過程中能夠優先排列并且形成結構明確的孔。1)通過這種選擇性的規則排列,能夠在形成的納米薄膜表面觀測發現亞納米尺寸的大環分子孔,而且通過調節大環分子的結構能夠實現精度達到?的精確控制。與非規則排列的對照薄膜相比,規則排列大環薄膜的甲醇滲透率提高兩倍。在一些高難度分離過程中,比如大麻酚油(cannabidiol oil)提純,比目前商業化的高性能薄膜相比,乙醇的穿透速率提高了一個數量級,大麻酚油的提純純度提高3倍。2)這項研究為聚合物薄膜構建亞納米通道提供一種簡單方便的方法,而且展示了精確分離分子的應用前景。Jiang, Z., Dong, R., Evans, A.M. et al. Aligned macrocycle pores in ultrathin films for accurate molecular sieving. Nature 609, 58–64 (2022)DOI: 10.1038/s41586-022-05032-1https://www.nature.com/articles/s41586-022-05032-1
2. Nature Catalysis:可見光催化惰性烯烴加成CO2
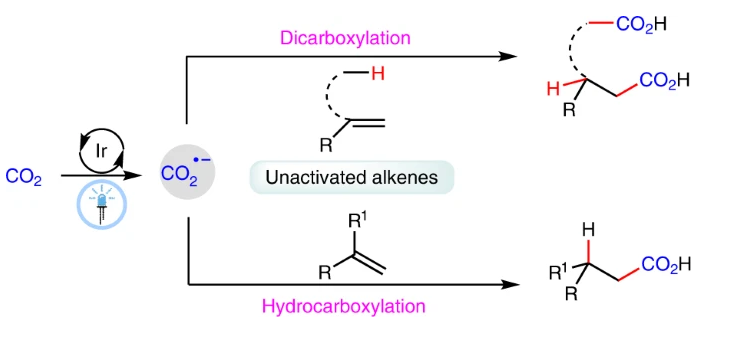
高效利用CO2目前受到全球相關研究者的廣泛關注,通過CO2對烯烴進行羧基化是合成具有價值的羧酸、二羧酸的重要方法。雖然目前人們知道通過光催化單電子轉移方式還原CO2能夠在反應中產生不同的化學/區域選擇性,但是還未曾用于羰基化反應。而且,通過可見光催化的方式使用CO2·-對惰性烯烴進行羧基化從未見諸報道。有鑒于此,四川大學余達剛等報道可見光催化使用CO2對惰性烯烴進行羧基化/雙羧基化。1)與以往報道的方法只能對活化烯烴進行反應不同,這種方法能夠對惰性脂肪族烯烴進行選擇性的羧基化,以適中或者優異的選擇性生成羧酸、雙羧酸、α-氨基酸衍生物。反應機理。反應機理研究結果顯示,該反應通過協同光電子轉移過程CO2還原為CO2·-,隨后與惰性烯烴反應、并且進行氫原子轉移等過程,生成相應產物。2)該反應方法學具有條件溫和(室溫、1 atm CO2)的優勢,兼容廣泛的底物,表現很好的官能團容忍性,操作簡單方便。反應能夠對丙烯(大宗化學品)、來自工業混合物的端基烯烴進行選擇性氫羧基化。與之前只能夠對活化的烯烴進行反應的方法不同,這種方法通過CO2·-中間體實現了對包含惰性烯烴的廣泛底物進行轉化,為將對惰性底物直接使用CO2進行轉化提供機會。Song, L., Wang, W., Yue, JP. et al. Visible-light photocatalytic di- and hydro-carboxylation of unactivated alkenes with CO2. Nat Catal (2022)DOI: 10.1038/s41929-022-00841-zhttps://www.nature.com/articles/s41929-022-00841-z
3. Nature Chemistry:硼烷作為Lewis酸輔助還原硝酸鹽
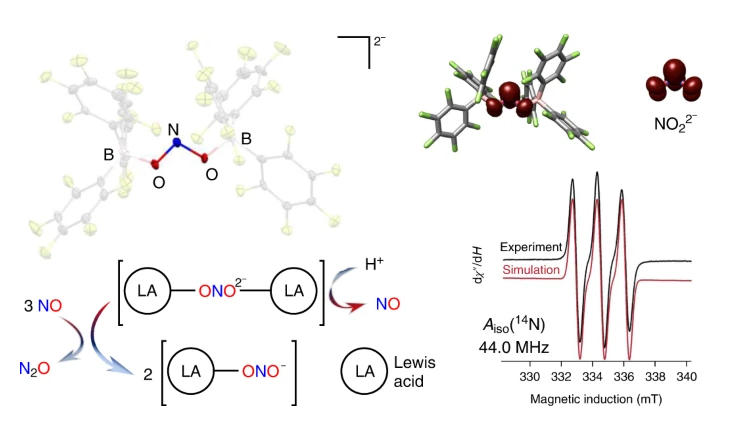
將NO2-還原為NO、N2O、最終還原為N2,發生于多種環境體系,包括土壤中作為生物氮循環的過程、以及酸化的核廢料。通常NO2-還原在具有氧化還原活性的過渡金屬的配位球內進行。有鑒于此,喬治敦大學Timothy H. Warren、康奈爾大學Kyle M. Lancaster等報道發現通過Lewis酸配位的方式能夠顯著降低NO2-的還原電勢,從而能夠在非溶液相中進行還原(還原電勢為-0.74 V vs NHE),還原反應過程生成獨特的NO22-自由基中間過程。1)通過詳細的表征,發現當NO2-修飾硼烷后氮原子形成N(II)氧化態(NO22-)。隨后通過質子化反應,非常容易消除NO。當NO22-與NO反應時,將發生歧化反應生成N2O和NO2-。通過使用B(C6F5)3作為Lewis酸,NO2-還原反應的電子轉移和質子轉移過程與N-O化學鍵切斷反應解耦,從而能夠分離得到穩定存在的NO22-物種。2)B(C6F5)3作為一種Lewis酸,能夠與體系中的O22-反應,或者與大體積的強Lewis堿生成NO2和NO的受阻Lewis酸堿對,但是通過Lewis酸B(C6F5)3能夠穩定并且分離得到純的NO22-。這種含有+2價態氮原子的新型多氧陰離子為NO2-還原為NO提供更加豐富的認識。此外,這種NO22?物種能夠將NO還原為N2O,因此將+3、+2、+1三種價態的氮原子連接起來。這個反應體系包括氮還原體系三個不同氧化還原態,為研究NO2-還原為NO的反應提供經驗。這種不具有氧化還原活性的Lewis酸能夠在不打破化學鍵的情況將小分子以及離子還原,因此為還原其他相關物種提供經驗,可能為催化反應領域打開新大門。Hosseininasab, V., DiMucci, I.M., Ghosh, P. et al. Lewis acid-assisted reduction of nitrite to nitric and nitrous oxides via the elusive nitrite radical dianion. Nat. Chem. (2022)DOI: 10.1038/s41557-022-01025-9https://www.nature.com/articles/s41557-022-01025-9
4. Angew:具有精確結構的硫醇保護的還原的Pd團簇用于電催化氧還原
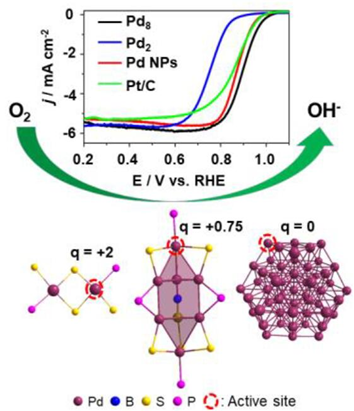
盡管在過去十年中具有原子單分散性的硫醇保護的還原的第 11 族金屬納米團簇已被廣泛報道,但迄今為止其Pd類似物尚未見報道。近日,中科院固體物理所伍志鯤,中科院過程工程研究所Jun Yang等報道了首例硫醇保護的還原的Pd(q=+0.75)團簇,Pd8B(PPh2)3(PPh3)2(2,4-DMBT)6(2,4-DMBT=2,4-二甲基苯硫酚)。1)作者將PPh3和Pd(CH3COO)2溶于THF溶液中,攪拌五分鐘后加入硼氫化鈉和硫醇配體,5分鐘后停止反應,獲得的粗產物用制備薄層色譜法進行分離。2)單晶結構分析表明,該團簇具有雙四面體Pd8內核,中心有一個+3價μ-6 配位的B原子。這是μ-6 B首次在第10族和第11族金屬納米團簇中被發現。3)與新合成的~1.4 nm Pd 納米顆粒、Pd2配合物甚至用于氧還原反應 (ORR) 的商業Pt/C催化劑相比,所獲得的Pd納米團簇顯示出更好的催化活性。Shengli Zhuang, et al. Thiolated, reduced Pd nanoclusters with resolved structures for the electrocatalytic reduction of oxygen. Angew. Chem. Int. Ed., 2022DOI: 10.1002/anie.202208751https://onlinelibrary.wiley.com/doi/10.1002/anie.202208751
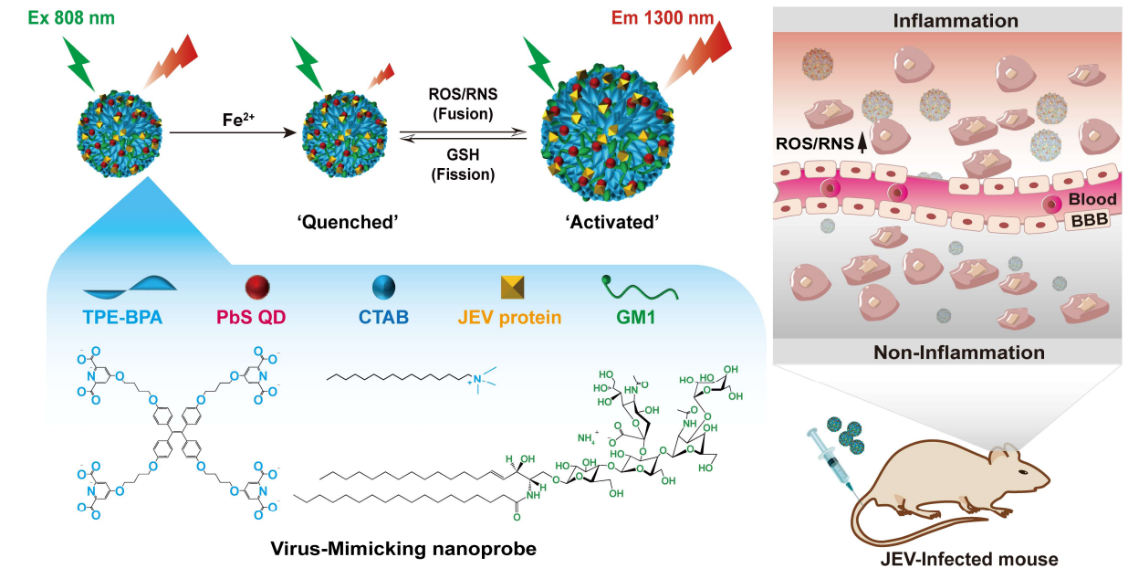
5. Angew:可激活、可逆的類病毒NIR-II納米探針用于監測病毒性腦炎的發展
病毒性腦炎是由多種病毒感染所引起的腦實質炎癥性疾病。監測病毒感染的體內進展情況有助于實現對病毒性腦炎的準確診斷和有效干預。有鑒于此,南開大學劉書琳研究員和趙東兵研究員利用Fe2+配位、病毒蛋白修飾的囊泡封裝PbS量子點(發出1300 nm的熒光),開發了一種可激活、可逆型類病毒NIR-II納米探針。1)該探針可穿越血腦屏障,并能夠通過調控量子點的猝滅水平和改變Fe氧化態以調控小泡的融合-裂變行為實現對病毒感染過程中活性氧和活性氮物種濃度變化的實時監測。2)實驗結果表明,這種切換策略能夠降低背景噪聲,并提高檢測靈敏度。綜上所述,該納米探針有望成為一種用于對病毒性腦炎進行動態可視化成像的臨床顯像劑。Hua-Jie Chen. et al. An Activatable and Reversible Virus-Mimicking NIR-II Nanoprobe for Monitoring the Progression of Viral Encephalitis. Angewandte Chemie International Edition. 2022DOI: 10.1002/anie.202210285https://onlinelibrary.wiley.com/doi/10.1002/anie.202210285
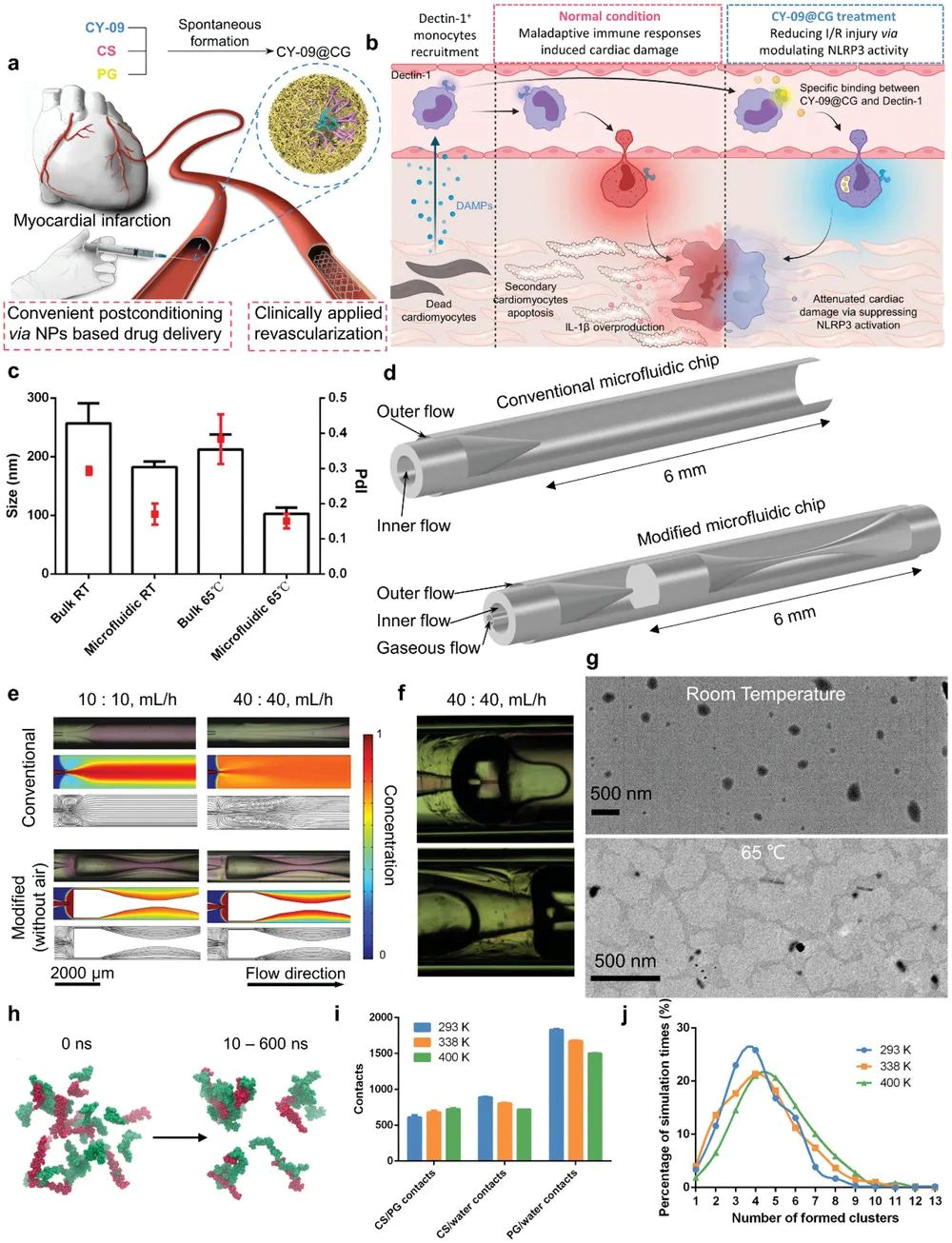
6. AFM: 通過耐熱微流控平臺對心肌再灌注損傷的獨特靶向能力的納米粒子的簡單工程,促進心臟修復
基于納米顆粒 (NP) 的靜脈內給藥代表了最方便的心臟靶向遞送程序,但由于缺乏靶向效率和特異性,仍然存在治療問題。使用配體功能化到 NPs 表面的主動靶向方法可能會受到簡單的修飾程序和體內靶向產量降低的限制。鑒于此,廈門大學鄧賢明、上海交通大學趙強、葉曉峰和荷蘭格羅寧根大學醫學中心Hélder A. Santos等人介紹了一種微流體輔助的一步綠色合成方法,用于以量身定制的方式生產無靶向配體的心臟歸巢 NP。1)生成的基于 β-葡聚糖的NPs對Dectin-1+單核細胞/巨噬細胞表現出精確和有效的靶向能力,這些細胞被證實是心臟缺血/再灌注 (I/R) 損傷的主要發病機制介質,心臟NP累積依次增強,這種靶向策略僅適用于心臟 I/R,但不適用于其他心血管疾病,這一點在小鼠和人體模型中均得到證實。2)與 FDA 批準的納米膠束制劑相比,負載 NACHT、LRR 和 PYD 結構域的蛋白 3 (NLRP3) 炎性體抑制劑 (CY-09) 的 β-葡聚糖 NP 在改善手術誘導的心肌損傷和心力衰竭方面表現出更好的效率誘導 I/R。這些發現表明了一種簡單的無靶向配體 NPs 的生產,并證明了它們在臨床前 I/R 誘導的心臟損傷改善方面的潛在治療應用。Liu, Z., et al., Promoting Cardiac Repair through Simple Engineering of Nanoparticles with Exclusive Targeting Capability toward Myocardial Reperfusion Injury by Thermal Resistant Microfluidic Platform. Adv. Funct. Mater. 2022, 2204666.https://doi.org/10.1002/adfm.202204666
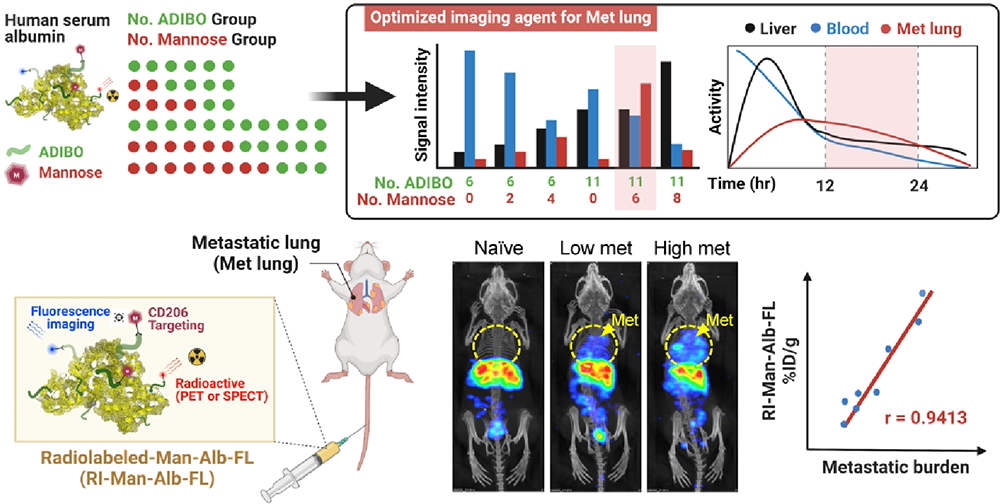
7. ACS Nano:循環時間優化的白蛋白納米平臺可通過靶向巨噬細胞以定量可視化肺轉移
用于識別肺轉移瘤關鍵細胞變化的分子成像探針能夠對肺轉移病變進行非侵入性檢測。首爾國立大學Seung Hyeok Seok和Yun-Sang Lee通過點擊反應構建了以甘露糖為靶向配體、靶向巨噬細胞的可點擊型白蛋白納米平臺(CAN),其能夠保持白蛋白在體內的內在特性。1)實驗通過調整CAN上甘露糖分子的數量發現,含有6個甘露糖分子的甘露糖糖化血清白蛋白(MSA)具有出良好的藥代動力學行為,能夠在肺中進行高對比度成像,適合用于對肺轉移進行體內可視化。由于對功能化和表面修飾進行了優化控制,因此MSA具有增強的血液循環時間和主動/被動靶向能力,并能夠被肺轉移中表達甘露糖受體(CD206)的巨噬細胞特異性攝取。2)此外,實驗也利用單光子發射計算機斷層掃描(SPECT)/CT和正電子發射斷層掃描(PET)進行了大量的體內成像研究,結果表明循環時間優化的MSA可以被用于識別轉移病灶,其信號與肺轉移之間有很強的相關性。Hyewon Chung. et al. Circulation Time-Optimized Albumin Nanoplatform for Quantitative Visualization of Lung Metastasis via Targeting of Macrophages. ACS Nano. 2022DOI: 10.1021/acsnano.2c03075https://pubs.acs.org/doi/10.1021/acsnano.2c03075
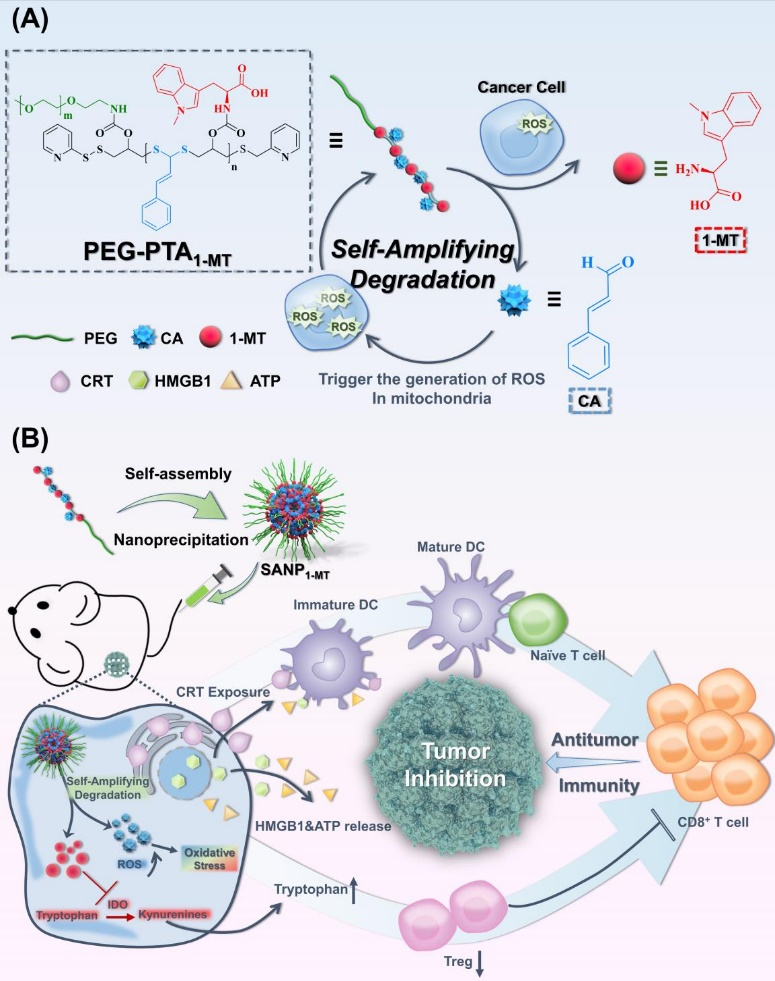
8. Biomaterials:ROS喚醒的自放大可降解聚合物用于增強癌癥免疫治療
盡管刺激響應型聚合物已發展成為實現智能型癌癥治療的有效策略,但有限的聚合物降解和藥物釋放不足仍然是其所面臨的一項嚴峻挑戰。有鑒于此,華南理工大學袁友永教授構建了一種新型、活性氧(ROS)喚醒的自放大可降解肉桂醛(CA)基聚硫縮醛聚合物。1)該聚合物由對活性氧響應的硫縮醛(TA)和ROS產生試劑CA所組成。內源性ROS能夠誘導TA基團裂解以釋放CA,從而觸發自放大的聚合物降解。此外,釋放的CA也能夠通過線粒體功能障礙以促進更多ROS的產生,進一步導致聚合物降解增強。2)研究表明,聚硫縮醛本身可觸發腫瘤細胞的免疫原性細胞死亡(ICD),其側鏈可與吲哚胺2,3-雙加氧酶1 (IDO-1)抑制劑偶聯,逆轉免疫抑制型腫瘤微環境,實現協同型癌癥免疫治療。綜上所述,這項工作中開發的自放大型可降解聚硫縮醛能夠為構建新型刺激響應型聚合物以增強癌癥免疫治療提供新的見解。Yalan Tu. et al. Cinnamaldehyde-based poly(thioacetal): A ROS-awakened self-amplifying degradable polymer for enhanced cancer immunotherapy. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004355
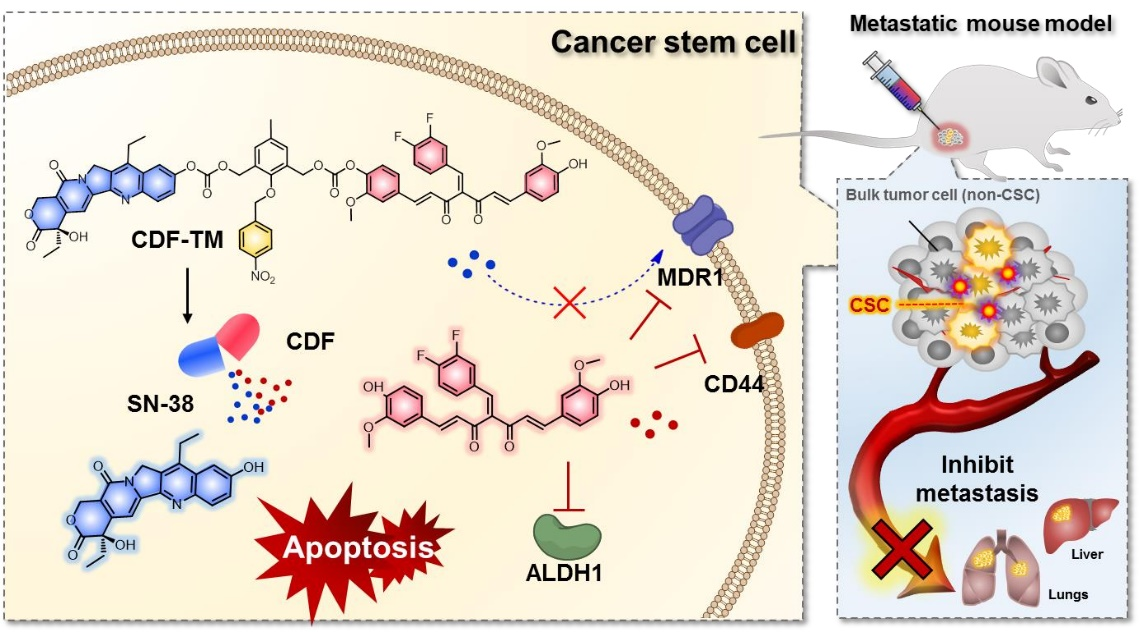
9. Biomaterials:能夠靶向腫瘤干細胞的同步雙藥遞送分子
癌癥干細胞樣細胞(CSCs)是實現三陰性乳腺癌(TNBC)成功治療的主要障礙之一。CSCs會促進化療耐藥的出現,進而引發腫瘤復發和導致預后不良。有鑒于此,高麗大學Jong Seung Kim、Jae Hong Seo、Ji Young Kim和Yoon-Jae Kim開發了一種基于小分子的二元前藥CDF-TM,它能夠與SN-38和3,4-二氟聯酶姜黃素(CDF)結合,進而在乏氧條件下被特異性激活。1)CDF-TM治療能夠顯著誘導TNBC源性的3D球體凋亡,并導致caspase-3激活以及腫瘤干細胞特性發生衰減,醛脫氫酶1 (ALDH1)活性和CD44high/ CD24low表型均有降低。實驗也采用體內原位同種異體移植模型研究了CDF-TM治療對于腫瘤生長和轉移的影響。2)實驗結果表明,CDF-TM可阻止來自原發同種異體移植腫瘤的CSCs的播散,并通過根除CSCs和下調耐多藥1 (MDR1)抑制腫瘤生長。綜上所述,該研究開發的新型小分子基二元前藥能夠為治療轉移性TNBC提供一種新的選擇。Ji Hyeon Kim. et al. A synchronized dual drug delivery molecule targeting cancer stem cells in tumor heterogeneity and metastasis. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004215