1. Nature:甲殼素合成酶的結構表征與反應機理
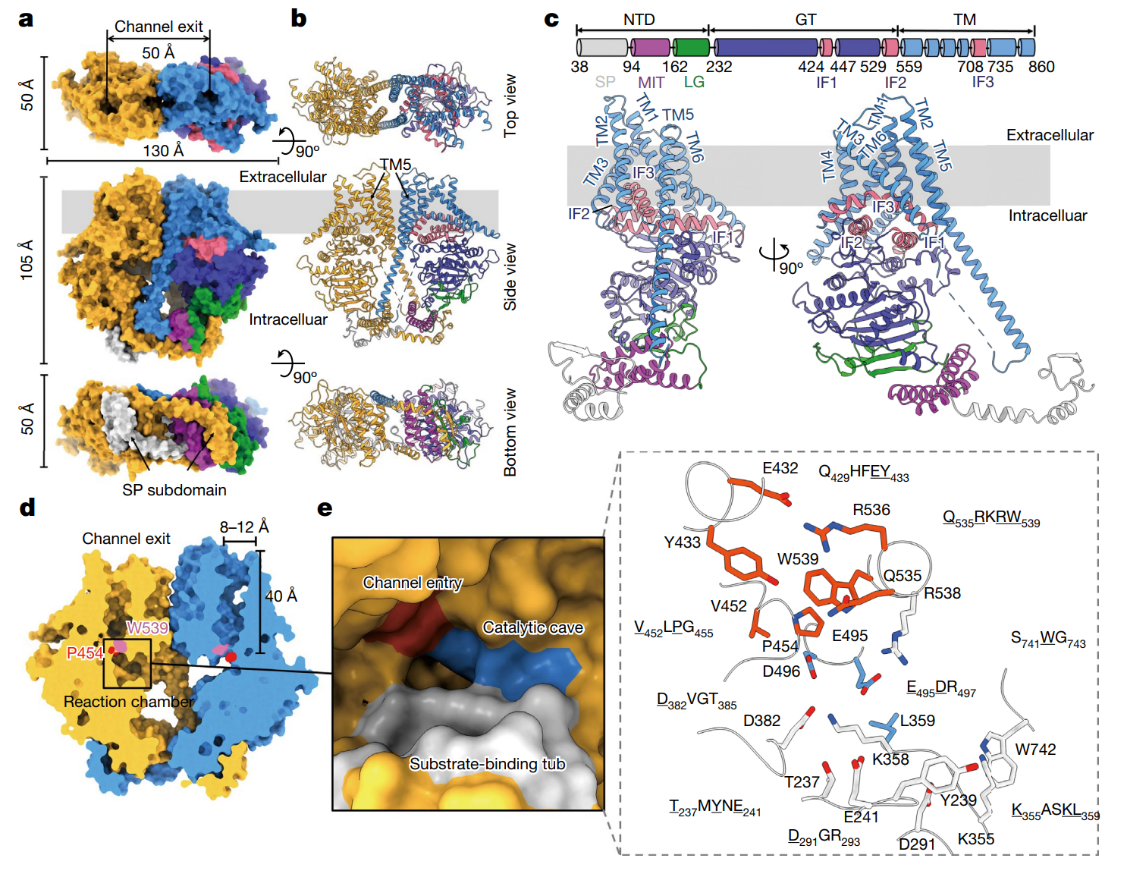
甲殼素是自然界中分布最廣泛的氨基多糖,甲殼素是一種含有N-乙酰氨基葡萄糖結構的細胞外聚合物GlcNAc(N-acetylglucosamine),甲殼素的生物合成反應中的關鍵反應的催化劑是甲殼素合成酶(chitin synthase),是一種整合到膜上的糖基轉移酶,能夠從UDP-GlcNAc將GlcNAc轉移到甲殼素的分子鏈。目前人們對這個反應過程并沒有清楚的理解和認識。有鑒于此,中國農業科學院植物保護研究所楊青、中科院高能物理所龔勇等報道了從強大的大豆根腐病病原卵菌Phytophthora sojae (PsChs1)中通過冷凍電子顯微鏡表征技術,解析了5個甲殼素合成酶的冷凍電子顯微鏡結構,分別對應于載脂蛋白(apo)、GlcNAc-結合、甲殼素低聚體結合的初態、UPD-結合(合成后的狀態)、甲殼素合成酶的抑制劑煙霉素Z-結合態,通過對甲殼素的生物合成過程、抑制作用進行深入理解,對甲殼素的合成過程進行深入理解。1)研究和表征發現,甲殼素合成的反應區域含有底物結合位點、催化活性中心位點、用于生成的聚合物離去的聚合物轉運通道入口。這種現象說明甲殼素生物合成過程包含的連續多個重要過程,包括UDP-GlcNAc結合態、聚合物生長、產物釋放。2)研究發現甲殼素傳輸通道含有一個搖擺回路結構,該結構作為“門禁”阻止底物離去、同時引導產物聚合物分子向產物傳輸通道轉移,從而將產物分子排放到細胞膜的外側。這項研究工作指明了甲殼素的生物合成過程的多個步驟,揭示了如何設計抑制甲殼素合成。Chen, W., Cao, P., Liu, Y. et al. Structural basis for directional chitin biosynthesis. Nature (2022)DOI: 10.1038/s41586-022-05244-5https://www.nature.com/articles/s41586-022-05244-5
2. Nature:構建光催化酶進行立體選擇性[2+2]環加成
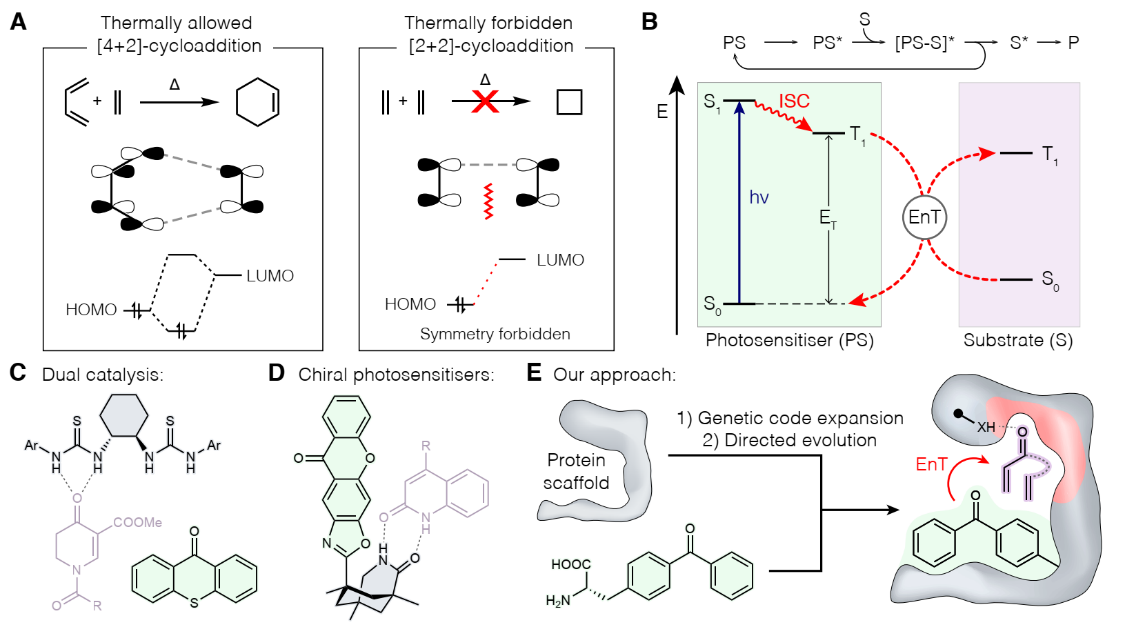
通過向蛋白中編輯新型催化劑的方式能夠發展超越自然酶催化的功能,為了實現這個目標,基因編碼擴展方法具有較高的前景,基因編碼擴展能夠向蛋白中以位點選擇性的方式引入非常見的氨基酸側鏈作為新型功能結構。有鑒于此,曼徹斯特大學Anthony P. Green等報道通過擴展基因編輯方法,將酶催化領域未曾有但是有機合成領域常用的三重態能量轉移催化引入酶催化領域,發展了新型光-酶催化劑,能夠在溫和好氧條件實現高效率的立體選擇性[2+2]環加成。1)通過將基因編碼的方式將光敏劑組裝到DA_20_20的β螺旋結構中,從而將Diels Alderase轉變為光酶催化劑,成功的用于[2+2]環加成(EnT1.0)。隨后通過發展和應用光酶結構進化的方式得到一種具有立體選擇性的高效光酶(EnT1.3),產率最好達到99 % e.e.,能夠進行分子內環加成、生物活性分子環加成反應,甚至能夠對小分子催化劑而言非常困難的分子進行催化。與小分子光催化劑不同,EnT1.3的催化轉化TON達到>300,能夠在好氧條件和溫和反應溫度進行高效率的立體選擇性催化反應。2)通過對EnT1.3-產物復合物進行X射線晶體學表征測試,研究多功能結構是如何相互配合實現高效率的進行選擇性光催化反應。這項研究工作為發展立體選擇性光催化劑提供幫助和指導,為蛋白的活性位點引入激發態相關大量研究提供機會。Trimble, J.S., Crawshaw, R., Hardy, F.J. et al. A Designed Photoenzyme for Enantioselective [2+2]-Cycloadditions. Nature (2022)DOI: 10.1038/s41586-022-05335-3https://www.nature.com/articles/s41586-022-05335-3
3. AM:“紅碳”半導體聚合物的合成和應用
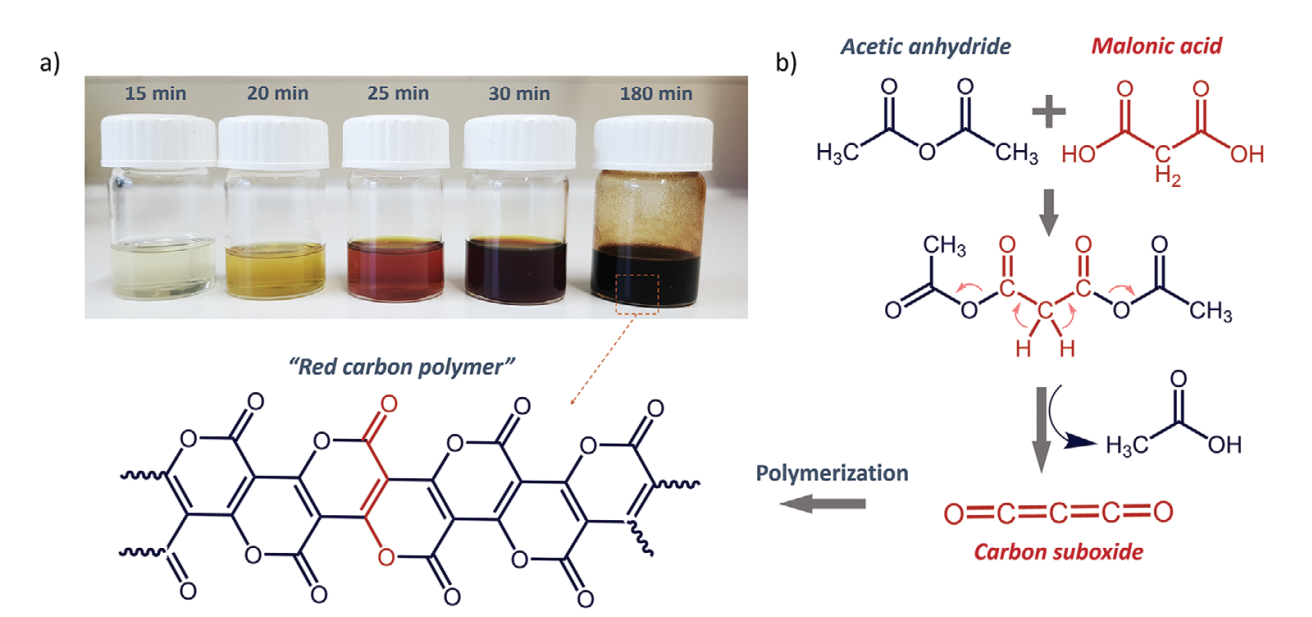
二氧化三碳C2O3(Carbon suboxide)是一種非常獨特的分子,能夠在0 ℃就能夠自發聚合生成具有高度共軛結構的光吸收材料。雖然這種材料具有的顯著優勢,但是人們對這種碳基材料的特點和功能并不清楚。有鑒于此,馬克思·普朗克固體與界面研究所Nieves López-Salas、Mateusz Odziomek等報道研究這種被人們遺忘的“紅碳”聚合物半導體材料。通過發展一種溶液相聚合反應方法,能夠更加簡單方便的控制合成和結構,從而能夠在非常低的溫度得到聚合物材料。1)一般通過丙二酸MA(malonic acid)在P2O5上縮水的方式生成C3O2,隨后在室溫自發聚合生成深色固體材料,反應的速率能夠通過溫度和雜質進行調控,作者發現不同文獻給出的合成時間互不相同,說明其合成過程對反應條件非常敏感。在此基礎上,作者通過丙二酸與乙酸酐混合的方法活化羧酸官能團,生成丙二酸和乙酸的混合酸酐,因此首次實現了通過液相合成p(C3O2)x。通過表征技術,驗證結果與以往報道的p(C3O2)x相同。通過光譜表征和元素分析,驗證材料的結構為共軛梯狀聚吡咯帶狀結構。使用DFT計算,驗證半導體碳材料具有直接的能帶結構半導體,光學數據分析結果顯示其具有寬度適中的帶隙。與C3N4等相比,這種碳材料的合成更加容易操作。2)紅碳能夠溶解于中等極性溶劑,并包覆在不同基底表面,因此可能用于多種多樣的領域,包括OLED、有機場效應晶體管、太陽能電池、光催化等。這種碳材料在藍光光照條件具有非常好的光催化活性,能夠將苯甲醇轉化為苯甲醛、將苯甲硫醚轉化為亞砜/砜。材料通過非常簡單的縮合-芳構化方法(condensation–aromatization route)能夠直接合成梯狀聚合物,這項研究為低溫合成碳基材料提供一種普適性方法。Mateusz Odziomek, et al, “Red Carbon”: A Rediscovered Covalent Crystalline Semiconductor, Adv. Mater. 2022DOI: 10.1002/adma.202206405https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202206405
4. Biomaterials:線粒體解偶聯劑協同光動力納米平臺以實現促死亡自噬/線粒體自噬
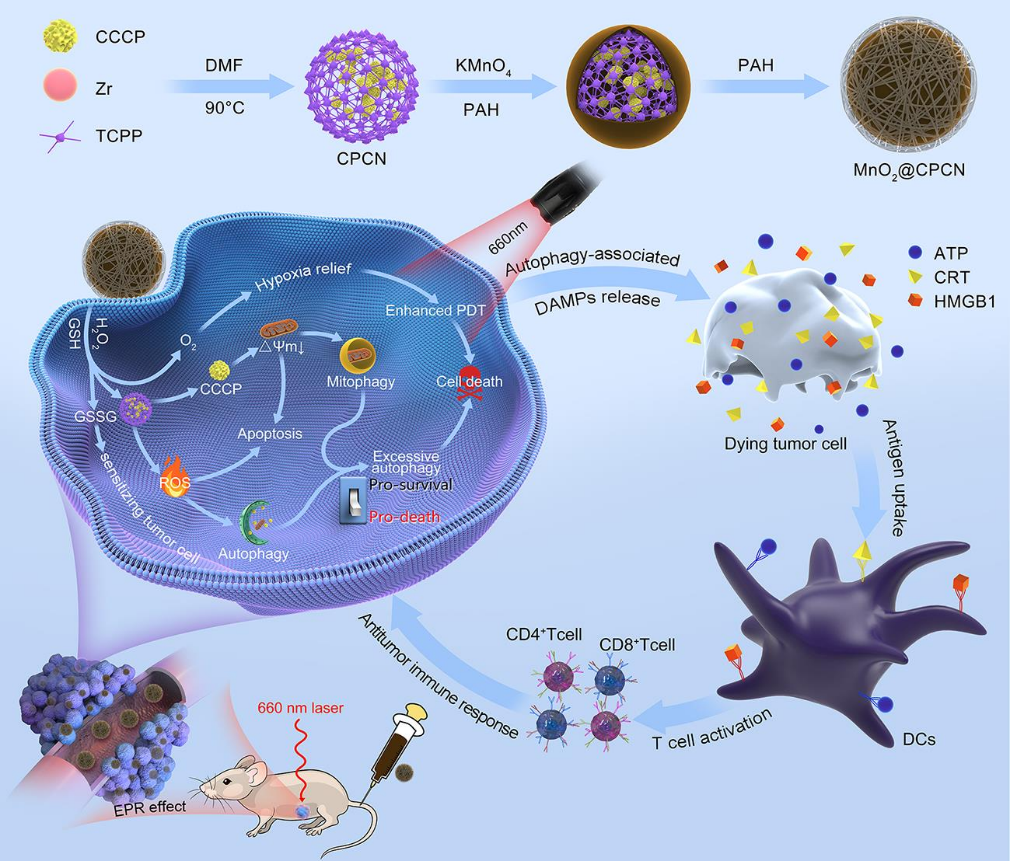
自噬/線粒體自噬是一種基于溶酶體的分解代謝途徑,其可通過增加腫瘤細胞對活性氧(ROS)觸發的蛋白質損傷和線粒體破壞的適應來降低光動力治療(PDT)的效率。另一方面,過度激活的自噬/線粒體自噬級聯也會引起自噬細胞死亡,促進死亡細胞內源性抗原釋放,從而在啟動抗腫瘤免疫反應的過程中發揮重要作用。為了充分利用細胞自噬/線粒體自噬的免疫調節作用,安徽中醫藥大學尹登科教授和楊曄教授合理構建了MnO2殼層包覆的多功能卟啉金屬有機骨架(MOF)來負載羰基氰酯-3-氯苯基腙(CCCP)。1)包裹的MnO2外殼不僅可以防止CCCP在血液循環中被過早釋放,還可以通過催化腫瘤內H2O2的分解來克服腫瘤乏氧。進入腫瘤細胞后,MnO2殼層可清除過表達的谷胱甘肽(GSH),導致CCCP釋放、GSH消耗和O2生成,有效增強PDT。與此同時,釋放的CCCP能夠作為線粒體解偶聯劑以誘導線粒體去極化和線粒體自噬,顯著提高PDT過程中產生的自噬/線粒體自噬水平,從而將促生存的自噬/線粒體自噬轉化為促死亡形式,導致腫瘤細胞自噬和免疫原性細胞死亡發生。2)體內實驗結果表明,CCCP協同PDT可誘導與T細胞反應和免疫記憶相關的過度免疫刺激性自噬/線粒體自噬,導致原發性腫瘤完全消融,并能有效預防腫瘤復發和肺轉移。綜上所述,該研究充分證明了自噬/線粒體自噬在癌癥治療中的促死亡作用和免疫調節作用,從而為提高癌癥治療的療效提供了一種新穎、通用的策略。Quanwei Sun. et al. Engineering mitochondrial uncoupler synergistic photodynamic nanoplatform to harness immunostimulatory pro-death autophagy/mitophagy. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004367
5. Biomaterials:H2O2活化的苯胺衍生物原位聚合用于傷口細菌感染的實時監測和抑制
創面極易發生細菌感染,并且會引起慢性創面以及一系列并發癥。然而,目前仍然缺乏能夠對傷口狀態進行實時監測和有效治療的系統。有鑒于此,廣西師范大學沈星燦教授和蔣邦平教授首次利用生物微環境技術以在人工水凝膠中原位生物合成功能共軛聚合物,并將其用于實現對傷口感染的實時監測和對細菌的抑制。1)預負載的辣根過氧化物酶(HRP)能夠催化感染創面過表達的過氧化氫(H2O2)產生羥基自由基(?OH),進而將一種易聚合的苯胺二聚體(N-(3-磺丙基)對氨基二苯胺,SPA)在海藻酸鈣水凝膠中原位聚合為聚SPA (PSPA)。由于PSPA具有出色的近紅外(NIR)吸收特性,因此這種聚合可以巧妙地通過肉眼觀察和光聲信號實現對H2O2的實時監測,并利用近紅外光介導的光熱治療抑制細菌。2)體內實驗結果表明,結合?OH具有的持續性化學動力學治療性能,該治療策略能夠在第11天實現99.03%的創面愈合率。綜上所述,該研究為在人工水凝膠中實現功能共軛聚合物的原位生物合成開辟了道路,能夠有效解決傷口治療所面臨的嚴峻挑戰。Aihui Wang. et al. H2O2-activated in situ polymerization of aniline derivative in hydrogel for real-time monitoring and inhibition of wound bacterial infection. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004380
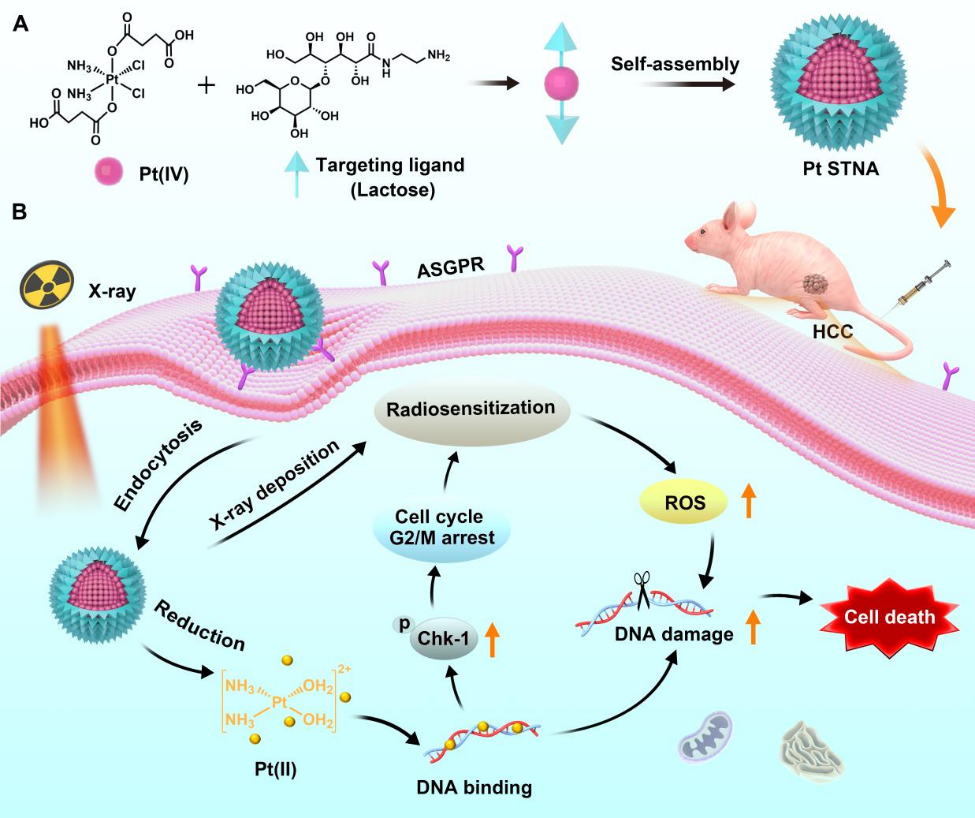
6. Biomaterials:自靶向鉑(IV)兩親性前藥納米組裝體可作為放療增敏劑以對肝癌進行放射化學治療
放化療是一種被廣泛應用于肝癌等惡性腫瘤患者的治療方法。然而,如何實現安全、協同的化療和放療增敏仍然是一個嚴峻的挑戰。中山大學潘越教授和南方醫科大學周東方教授設計了一種基于鉑(IV)-乳糖兩親性前藥的自靶向納米組裝體(STNA),并將其用于對肝癌進行協同放射化學治療。1)由于乳糖對HCC細胞具有靶向性,因此Pt STNA可以在腫瘤內有效積累。經受體介導內吞,Pt STNA可在癌細胞中釋放順鉑(II)以與DNA結合,從而誘導產生DNA損傷和細胞凋亡。同時,這種與DNA的結合作用還可通過上調磷酸化檢查點激酶1 (p-Chk1)的表達以導致對輻射敏感的G2/M期細胞周期阻滯。2)在x射線照射下,Pt STNA能夠表現出較強的x射線衰減能力,以沉積更多的能量,從而在G2/M期提高活性氧(ROS)水平,增強放療的癌細胞殺傷作用,使得DNA損傷增加。實驗結果表明,Pt STNA可在放化療中表現出顯著的協同治療作用,且不會再體內外產生不良反應。綜上所述,該研究提出了一種新型的自靶向納米組裝策略,可通過協同化療和放療增敏實現肝癌治療。Xiaohui Xiao. et al. Self-Targeting Platinum(IV) Amphiphilic Prodrug Nano-Assembly as Radiosensitizer for Synergistic and Safe Chemoradiotherapy of Hepatocellular Carcinoma. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004331