
抑制免疫細(xì)胞功能的細(xì)胞表面受體(即所謂的“抑制性免疫檢查點(diǎn)”受體)的藥理學(xué)阻斷是過(guò)去十年癌癥治療中最成功的進(jìn)展之一。盡管這些療法所針對(duì)的受體,例如程序性細(xì)胞死亡蛋白 1 (PD-1),通常存在于 T 細(xì)胞上,但在其他免疫細(xì)胞譜系上表達(dá)的受體,特別是巨噬細(xì)胞,也可以作為治療益處的目標(biāo)。一個(gè)這樣的例子是信號(hào)調(diào)節(jié)蛋白 α (SIRPα) 受體。
巨噬細(xì)胞是具有“吞噬”和破壞癌細(xì)胞能力的免疫細(xì)胞,這一過(guò)程稱為“吞噬作用”。它們還將攝入的癌細(xì)胞蛋白降解成小肽,然后它們可以作為抗原呈遞給 T 細(xì)胞,從而產(chǎn)生針對(duì)腫瘤的抗原特異性免疫反應(yīng)。吞噬作用受到巨噬細(xì)胞上“吃我”(促吞噬)和“別吃我”(抗吞噬)受體之間的平衡的嚴(yán)格控制,配體可能存在或不存在于腫瘤上細(xì)胞。對(duì)于非凋亡性腫瘤細(xì)胞,巨噬細(xì)胞上的“吃我”受體包括抗體的不變片段可結(jié)晶(Fc) 部分的受體(FcR)和信號(hào)淋巴細(xì)胞活化分子家族 7 (SLAMF7),一種將其他 SLAMF7 識(shí)別為配體的同型受體腫瘤細(xì)胞上的分子。由于 SLAMF7 僅限于造血細(xì)胞,因此它僅用于造血細(xì)胞的吞噬作用。最典型的別吃我的受體是 SIRPα,它識(shí)別為在腫瘤細(xì)胞上廣泛表達(dá)的配體 CD47。癌細(xì)胞通常通過(guò)增加其細(xì)胞表面的 CD47 量來(lái)逃避吞噬作用。
仔細(xì)研究表明,單純阻斷 SIRPα-CD47 免疫檢查點(diǎn),使用針對(duì) SIRPα 或 CD47 的阻斷抗體或使用可溶性 SIRPα,不足以在體外觸發(fā)吞噬作用并誘導(dǎo)體內(nèi)腫瘤細(xì)胞的消除。需要共同參與諸如 FcR(通過(guò)針對(duì)腫瘤細(xì)胞表面分子的抗體)或 SLAMF7(在SLAMF7陽(yáng)性造血癌細(xì)胞如淋巴瘤和多發(fā)性骨髓瘤中)等“吃我”受體。這些要求可能解釋了為什么在SIRPα-CD47阻斷療法的1期和2期臨床試驗(yàn)中,造血惡性腫瘤,特別是淋巴瘤和Sezary綜合征獲得了最令人鼓舞的結(jié)果。在炎癥環(huán)境中,促吞噬細(xì)胞受體如CD11a和CD11c也可以介導(dǎo)吞噬作用。這種獲得的能力可能解釋了為什么一些研究人員報(bào)告在SIRPα-CD47 阻斷期間通過(guò) FcR 和 SLAMF7 獨(dú)立過(guò)程吞噬 SLAMF7 陰性腫瘤細(xì)胞。
為了擴(kuò)大對(duì) SIRPα-CD47 阻斷敏感的癌癥類型的范圍,德克薩斯大學(xué) MD 安德森癌癥中心Wen Jiang、Betty Y. S. Kim等人開(kāi)發(fā)了雙特異性納米顆粒(命名為BiTN),其中納米顆粒與抗人表皮生長(zhǎng)因子受體 2(HER2)單克隆抗體和重組 SLAMF7 結(jié)合,進(jìn)而誘導(dǎo)強(qiáng)大的吞噬作用并激活吞噬細(xì)胞cGAS-STING通路,使腫瘤對(duì)免疫檢查點(diǎn)抑制劑敏感。
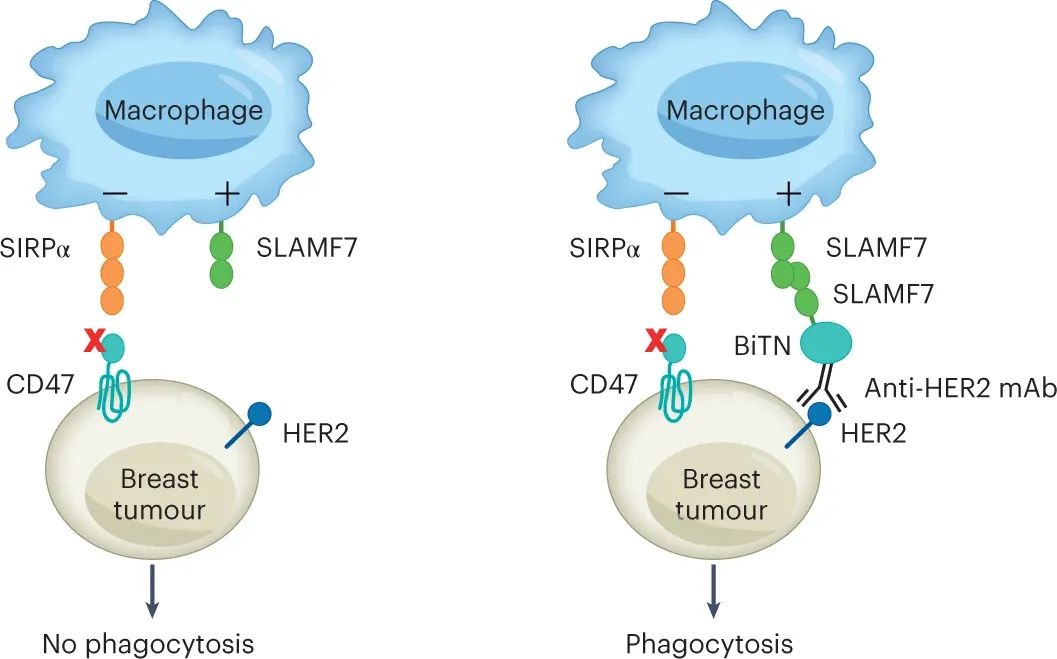
圖|納米綴合物可擴(kuò)大對(duì)巨噬細(xì)胞免疫治療敏感的實(shí)體腫瘤細(xì)胞的范圍
這些抗 HER2-SLAMF7 納米綴合物專門靶向表達(dá) HER2 的乳腺癌細(xì)胞,用 SLAMF7 人工修飾乳腺癌細(xì)胞。該過(guò)程導(dǎo)致響應(yīng)于 SIRPα-CD47 阻斷的吞噬作用顯著改善。它還改善了小鼠體內(nèi) SIRPα-CD47 阻斷期間的腫瘤細(xì)胞消除,且沒(méi)有毒性證據(jù)。
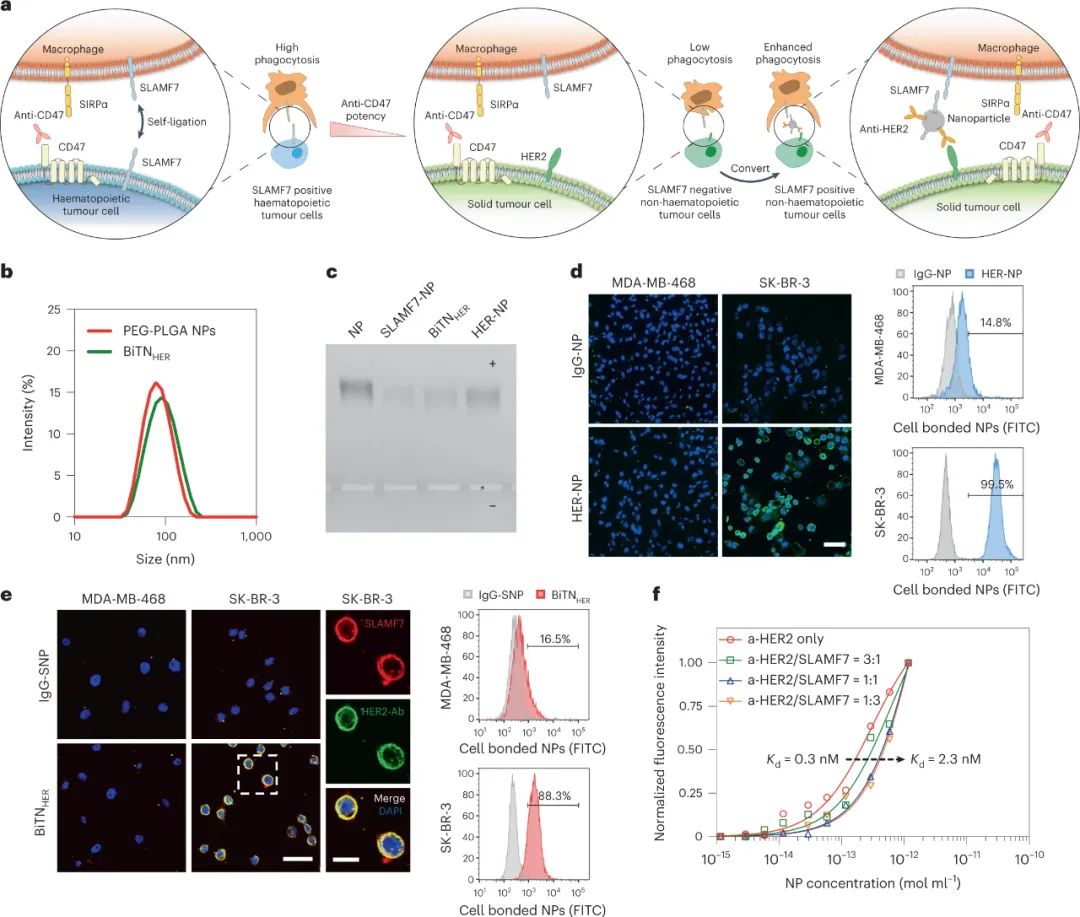
圖|BiTNHER納米顆粒靶向特定的非造血癌細(xì)胞并將其轉(zhuǎn)化為造血樣癌細(xì)胞
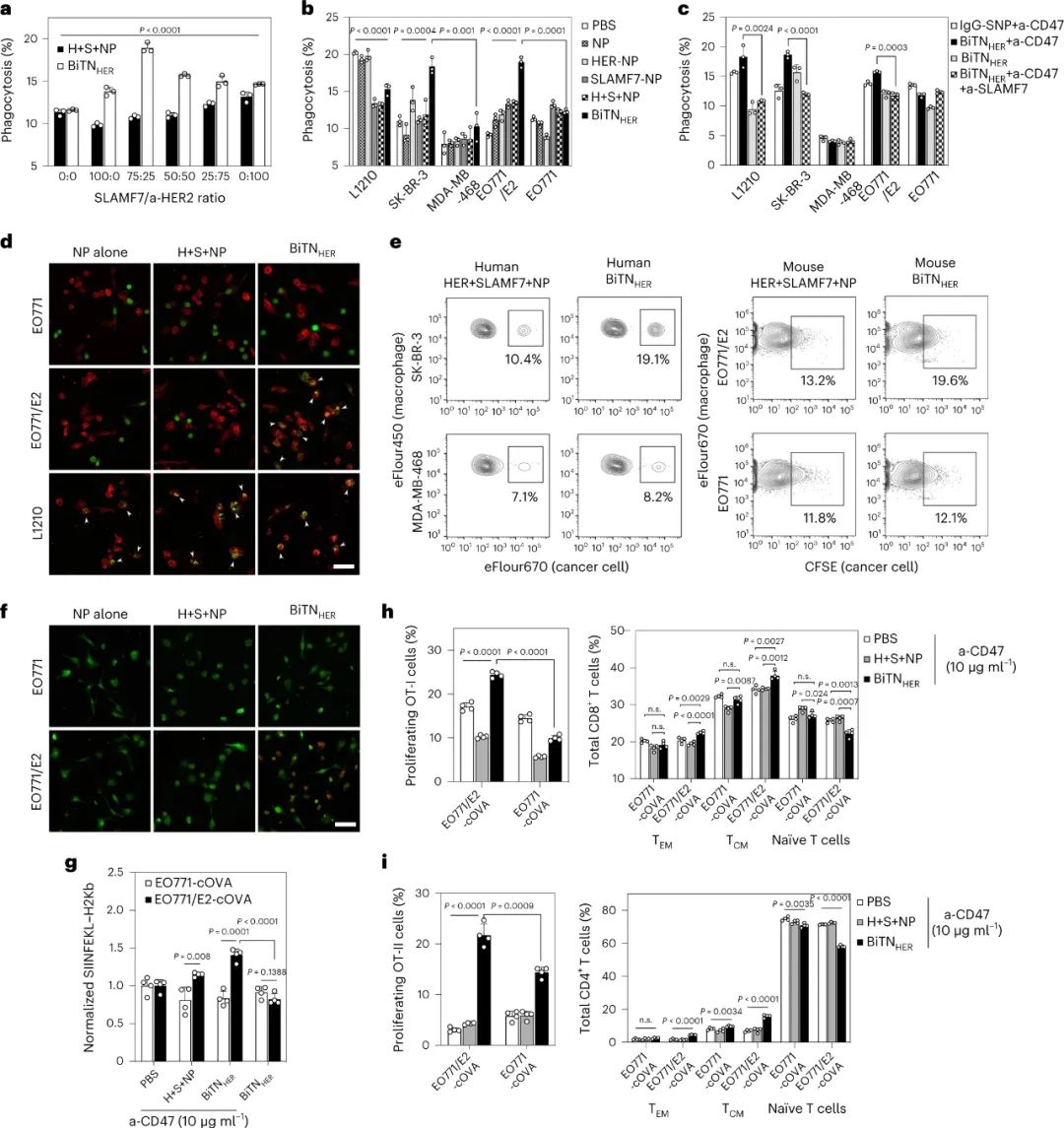
圖|抗 CD47 和 BiTNHER 的組合誘導(dǎo)癌細(xì)胞的靶向吞噬作用和隨后的巨噬細(xì)胞活化
納米綴合物的部分體內(nèi)作用是由巨噬細(xì)胞在吞噬作用后啟動(dòng)抗原特異性抗腫瘤 T 細(xì)胞反應(yīng)的能力介導(dǎo)的。通過(guò)同時(shí)阻斷T 細(xì)胞抑制性免疫檢查點(diǎn) PD-1,進(jìn)一步增強(qiáng)了納米綴合物在SIRPα-CD47 阻斷期間的體內(nèi)抗腫瘤作用。納米綴合物的影響需要用SLAMF7修飾腫瘤細(xì)胞和SLAMF7在巨噬細(xì)胞上的表達(dá),但與抗HER2抗體的Fc部分無(wú)關(guān)。因此,它是通過(guò)觸發(fā)巨噬細(xì)胞上的 SLAMF7 而不是 FcR 來(lái)介導(dǎo)的。
通過(guò)改變綴合物中SLAMF7與抗HER2抗體的比例,發(fā)現(xiàn)3:1的SLAMF7:anti-HER2比例觸發(fā)了最高程度的吞噬作用。盡管未測(cè)試較高的比率,但較低的比率在增強(qiáng)吞噬作用方面的效率較低。這一觀察結(jié)果表明,腫瘤細(xì)胞上存在的SLAMF7分子的數(shù)量可能對(duì)于通過(guò)這種機(jī)制導(dǎo)致高效吞噬作用至關(guān)重要。對(duì)于大多數(shù)受體(包括吃我受體)而言,它們的正常功能需要最佳的受體聚類。
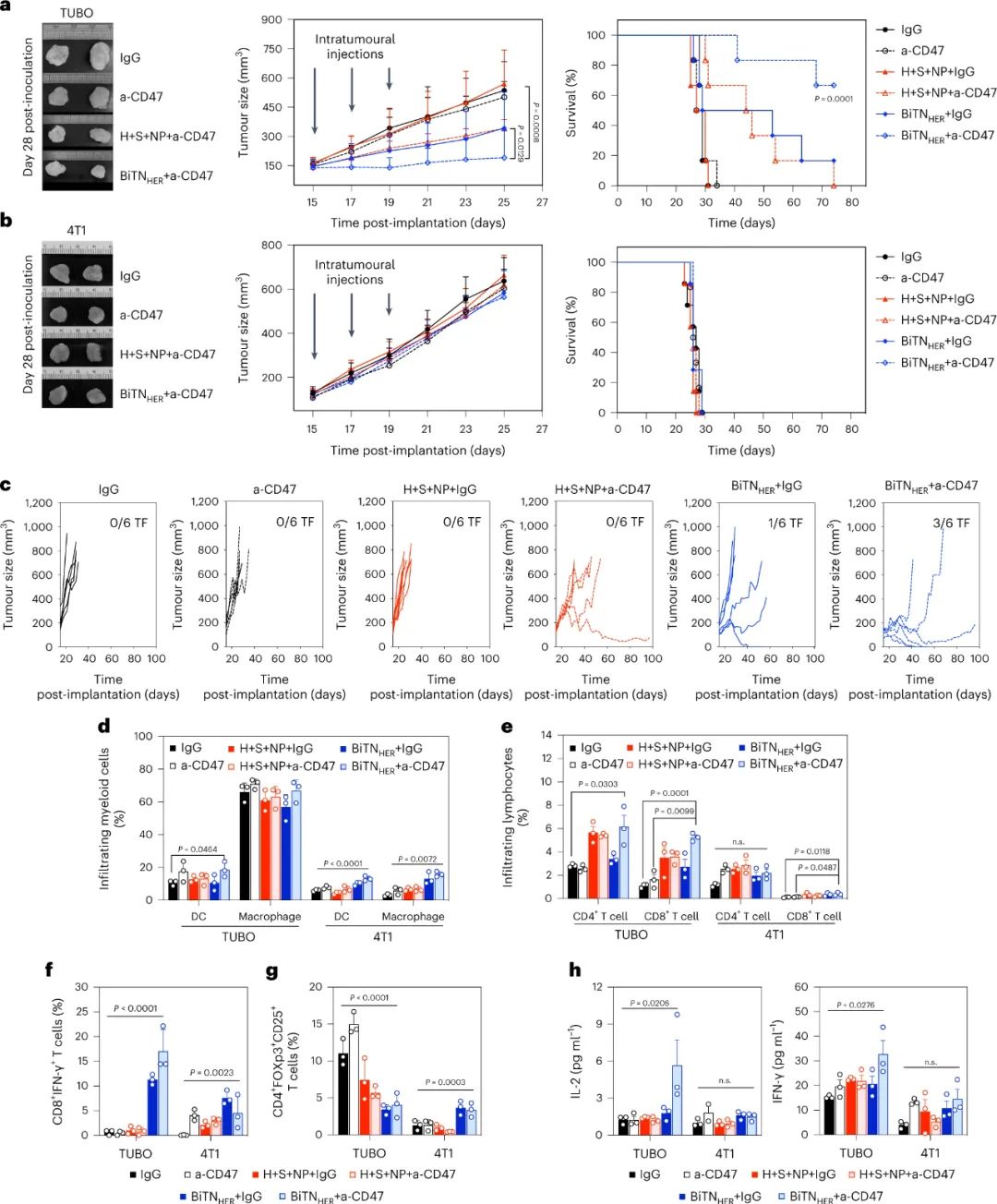
圖|BiTNHER和抗 CD47 的聯(lián)合治療在 HER2/neu 表達(dá)的小鼠腫瘤模型中誘導(dǎo)抗腫瘤免疫反應(yīng)
當(dāng)配體用量不足甚至過(guò)量時(shí),這些功能可能受損。當(dāng)工程綴合物用于實(shí)驗(yàn)或治療目的時(shí),適當(dāng)?shù)幕瘜W(xué)計(jì)量值得仔細(xì)考慮。沿著這些思路,值得注意的是,淋巴瘤細(xì)胞和正常活化的 B 細(xì)胞在SIRPα-CD47阻斷期間可以抵抗吞噬作用,盡管它們表面似乎表達(dá)了非常大量的 SLAMF7。一種可能性是這些細(xì)胞上的 SLAMF7 分子數(shù)量不適合適當(dāng)?shù)氖荏w聚類。也許,他們太高了。在這種情況下,有趣的是,進(jìn)一步增加納米綴合物中SLAMF7的量是否也會(huì)抑制吞噬作用將是很有意義的。
盡管用 SLAMF7 修飾腫瘤細(xì)胞促進(jìn)了吞噬作用,但有人可能認(rèn)為,只需用具有完整 Fc 部分的抗腫瘤抗體包被腫瘤細(xì)胞即可實(shí)現(xiàn)類似的結(jié)果,然后可以觸發(fā)巨噬細(xì)胞上的 FcR,導(dǎo)致吞噬作用。值得注意的是,在 SIRPα-CD47 阻斷的情況下,已知向許多類型的癌細(xì)胞添加抗腫瘤抗體會(huì)通過(guò) FcR 刺激抗體依賴性吞噬作用。然而,抗腫瘤抗體對(duì) FcR 的長(zhǎng)時(shí)間刺激會(huì)導(dǎo)致巨噬細(xì)胞功能的有害變化,從而獲得免疫抑制特性。這種改變可能會(huì)導(dǎo)致抑制性免疫檢查點(diǎn)治療期間出現(xiàn)的腫瘤“過(guò)度進(jìn)展”綜合征,從而影響患者的預(yù)后。因此,最好避免長(zhǎng)期與治療性抗體接觸 FcR。用 SLAMF7 等天然配體修飾腫瘤細(xì)胞可能更合適。
總之,研究人員發(fā)現(xiàn)為“免疫轉(zhuǎn)化”策略提供了一個(gè)引人注目的例子,該策略拓寬了適用于某些類型免疫治療的腫瘤類型的范圍。盡管報(bào)道的研究集中于乳腺癌細(xì)胞,但有理由提出類似的方法可能適用于其他類型的實(shí)體腫瘤,如結(jié)腸癌和肺癌。作者還強(qiáng)調(diào)了T細(xì)胞以外的免疫細(xì)胞,特別是巨噬細(xì)胞,作為抗腫瘤免疫治療的效應(yīng)器的有用性。最后,這些結(jié)果進(jìn)一步支持了SLAMF7是巨噬細(xì)胞上的一種有效的“吃我”受體的觀點(diǎn),并且SLAMF7可能是治療人類癌癥的有效治療益處。
參考文獻(xiàn):
Lu, Y., Huntoon, K., Lee, D. et al. Immunological conversion of solid tumours using a bispecific nanobioconjugate for cancer immunotherapy. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01245-7











