特別說明:本文由學研匯技術中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。
原創丨愛吃帶魚的小分子
編輯丨風云
目前,與開發陰陽極的相比,電解質的開發較少受到關注,而電解質控制著離子和電荷的流動,它在物理上將兩個電極與直接電子轉移隔離,同時允許工作離子將電荷和質量傳輸到整個電池,從而使電池反應可持續進行,是與所有其他物質緊密接觸的唯一成分,同時電解質也參與了動力學形成的界面以增強電池的穩定性。電解質決定了電池反應的速度(功率密度)和電池的充放電次數(可逆性)。
同時,為了最大限度地提高能量密度,電池中的電極經常被推到極端電位下工作,在這種情況下,沒有已知的電解質是熱力學穩定的。而在鋰離子電池(LIB)等電池中,必須在動力學上實現電解質和電極之間的穩定性。因此,微量電解質被犧牲性地分解,其固體產物沉積在電極表面上(形成固體電解質界面(SEI)),形成保護層(“相間”)防止進一步分解的保護,但幾個不太確定因素使其變得復雜:(i)大多數過渡金屬氧化物陰極材料已經帶有Li2CO3的天然鈍化層,而Li2CO3又通過純化學途徑與電池環境中的酸性電解質反應;(ii)通過電化學途徑進一步進化,最終形成陰極電解質界面(CEI)化學; (iii)陰極材料的表面也可能參與演變,形成中間階段,影響CEI的作用。
基于此,美國芝加哥大學孟穎(Y. Shirley Meng)教授等研究綜述了目前設計和開發新型電解質的關鍵:由于電解質在電池設計的獨特的作用,必須同時滿足許多約束條件:(i)快速傳輸離子和質量、(ii)有效地絕緣電子以及(iii)保持對強氧化陰極和強還原陽極的穩定性。同時電解質又和界面化學密切相關,所以設計更好的電解質意味著調整和平衡一系列屬性,范圍從本體到界面結構和穩定性到界面化學和形態。論文以《Design better electrolytes》題發表在Science上。
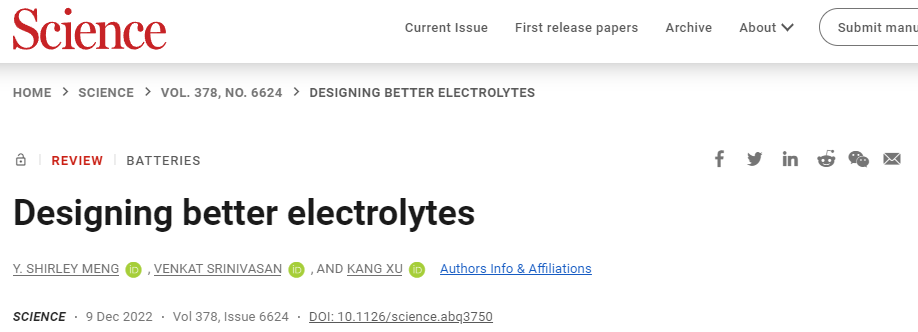
由相間啟用的鋰離子電池
鋰離子電池(LIB)的能量密度和可再充電性取決于界面(圖1)。目前商用電解質幾乎完全遵循由溶解在碳酸酯溶劑混合物中的六氟磷酸鋰(LiPF6)組成的骨架組合物。由于LIB中石墨陽極的電勢遠遠超出電解質的熱力學穩定性窗口,可逆鋰化/脫鋰化學依賴于對界面的保護。目前普遍認為LIBs中的SEI主要來自碳酸鹽溶劑和鹽陰離子的還原分解,Li+的溶劑化鞘結構已被確定為SEI化學中的關鍵因素。第一個循環中,當帶負電的陽極將溶劑化的Li+吸引到其表面時,溶劑化鞘中的溶劑分子最初經歷還原分解,從而成為新生SEI的前體。
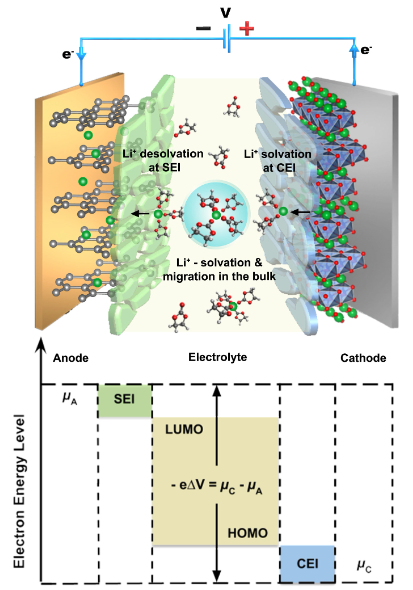
圖 1. 電解質原理展示
碳酸亞乙酯(EC)在強溶劑化Li+和在石墨陽極上形成保護性界面的能力使其幾乎成為所有LIB中不可或缺的電解質組分。然而,電解質中EC的普遍存在也會導致LIB的低溫性能不佳和充電速率緩慢。使用用無環碳酸酯作為主要溶劑的無環電解質逐漸取代EC。與完全覆蓋陽極的SEI不同,陰極表面上的沉積物,主要是無機氟化物和氧化物,通常被發現是分散的和不連續的,這也說明CEI化學更加復雜,不僅涉及電解質,還涉及陰極本身的分解和相變,從而導致了定義界面應該開始和結束的位置的問題。因此,電解質和界面是復雜的,在設計新的電解質系統時,Li+(或Na+等)的溶劑化結構至關重要。
電池化學設計電解質和界面
目前電池化學反應要么在極端電位下運行,具有劇烈的形態和體積變化,要么涉及極強的反應性表面,要么依賴難以移動的工作離子,電解質和相關界面的設計必須解決不同的挑戰。
鋰金屬(Li0)陽極面臨著更嚴峻的挑戰,由于其能量密度,鋰金屬陽極被重新視為最終的陽極材料。識別具有有效SEI化學的電解質已成為一個投入巨大的研究方向,目的是Li0沉積可以在高庫侖效率(CE%)下均勻地進行。特別是要避開分形狀的長寬比晶體(圖2),這可能會穿透電池并產生內部短路,或者在根部附近容易切斷,形成高度危險的死Li0。相對鋰電,參與反應的多個電子將有利于提高比容量使得與多價陽離子相對應的金屬作為陽極材料具有更多的可能,但多價陽離子對環境施加的庫侖力非常強導致多價鹽在電解質中的溶解度有限,或溶劑分子與多價離子的結合非常強它們被靜電分解。因此此類電池種電解質設計一般是:(i)形成弱配位電解質,以使陽離子較少溶劑化,并且可以更容易地克服去溶劑化能壘,(ii)使用各種氫化物和有機金屬格氏試劑的抗還原電解質,從而不形成SEI,或(iii)超濃縮電解質,其中聯網的陰離子簇可以幫助釋放陽離子以進行移動。
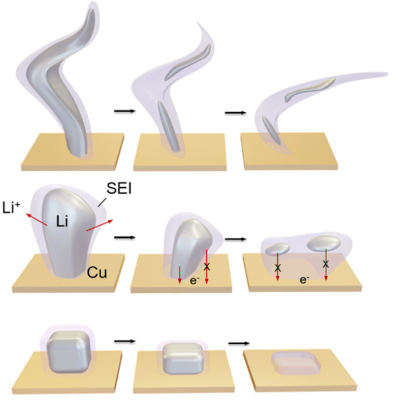
圖 2. Li0陽極的挑戰
在陰極方面,一直集中在尋找極高的能量密度或獨立于鈷或鎳的材料上,但這兩種元素要么在地殼中極為罕見,要么高地緣政治風險。目前已經探索了相對更成熟的材料,即設計為具有更高的HOMO,它們的氧化分解仍然可以主導CEI化學,并對本體電解質和陰極本身形成更好的保護,如插層化合物的改進版本,其晶格的結構修改允許它們在更高的電勢下容納更多的Li+,晶格中的氧可以被用于增加容量。
利用轉化反應化學的更成熟材料被視為長期目標,包括金屬氟化物、硫化物等。與具有最小結構變化的插層型電極不同,這些電極材料在放電期間經歷了完全重組,從而實現了顯著更高的容量,但以可逆性為代價,因為幾乎不可能完全恢復原始電極結構(圖3)。因此,需要相應的電解質和界面來抵抗金屬氟化物或硫化物產生的納米金屬顆粒的強烈催化活性,抑制可溶性多硫化物在電池中的穿梭,并保持對氧還原反應性過氧化物或超氧化物中間體的惰性。
圖 3. 新興的轉化反應電池化學
新概念電解質和界面
在設計和合成新的電解質組分(溶劑、鹽和添加劑)方面,正在做出大量努力。這些可以歸納為幾種通用方法:
超濃縮
傳統上,電解質被限制在大約1 M的鹽濃度,以最大化離子傳輸。在研究人員意識到,超高的鹽濃度可以帶來一系列好處(不可燃性、高壓防腐、高陽離子轉移及新的界面化學)抵消粘度增加導致的離子傳輸損失。超濃縮概念適用于水性、非水性甚至混合電解質系統。一種特殊的修改是所謂的局部高濃度電解質中引入非配位共溶劑(通常是多氟化醚)以進一步破壞母體電解質的液體結構,從而使總鹽濃度接近1.0 M,但局部陽離子仍呈現類似于超濃縮狀態的溶劑化結構。
單一化
由于在電極上原位形成的界面在化學和形態上都是高度不均勻的,因此確定哪種化學物質是確保電池可逆性的唯一最有效成分是關鍵。SEI和CEI中都存在各種有機或無機氟化物,但在氟化物含量和界面性能之間無法建立簡單的線性關系。氟是最耐氧化和還原的元素,是設計用于支持電池化學腐蝕的界面的理想成分。界面中的氟化物分布以及與其他物種的相互作用比單獨的氟化物含量更為關鍵。目前為止,關于精確調整這些氟化物物種納米形態的知識仍然缺乏。根據低溫電子顯微鏡下的觀察和分析,Li2O最近被確定為Li0上的替代界面成分,但沒有任何可檢測的氟化物。因此,嘗試了單一化學成分的更純的界面來觀察。
固化
固體電解質(SE)提供不可燃性、零泄漏和對Li0枝晶生長的機械阻力,提供了在寬工作溫度范圍內實現Li0陽極的更令人信服的可行性。聚合物離子導體由于其靈活性和可加工性而備受關注,但寡醚鏈的節段運動和離子傳輸之間的耦合構成了在環境溫度下實現足夠的離子傳導率的不可逾越的障礙。為了將離子傳輸與聚合物節段弛豫分離,需要取得根本性突破。無機固體材料中,硫化物已成為最高的競爭者,在室溫下具有高離子電導率和高順應性以加工成超薄致密層,但其適度的電化學穩定性需要額外的界面保護,以防止多種陰極和陽極化學物質的極端電勢。陰極材料上各種類型的可擴展、低成本、均勻的涂層策略仍在探索中,涂層不僅在化學和電化學上保護界面不被分解,而且作為機械緩沖層穩定固體-固體界面。
SE的最大挑戰仍然來自固體-固體界面,因為SE不能流動或滲透到電極的孔隙結構中。克服物理接觸問題的常見方法是添加受控量的液體電解質以填充空隙和間隙。這使得系統不那么堅固,并導致混合電解質或半SE。相反,固體-固體接觸挑戰也可以轉化為實現Li或Si陽極的三維(3D)結構的優勢,因為界面反應只能發生在這些接觸點,而大體積膨脹和收縮可以通過適當的3D設計和動態壓力控制來適應(圖4)。SE的單離子傳導特性消除了濃度極化,并允許調節導致不均勻反應和最終容量衰減的局部效應。
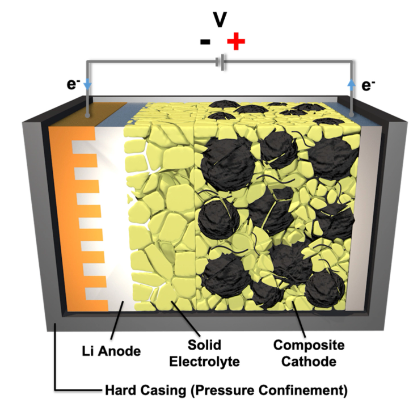
圖 4. 固體電解質界面
液化
除了液體和固體之外,還創造了一個新的前沿領域,即準氣體被用作電解質溶劑。這些努力使得在較低的溫度下操作成為可能。相對極性的氣態氫氟碳分子如氟甲烷可在中等壓力下液化,該壓力在室溫下溶解鹽以形成液化氣體電解質。這些電解質是無毒的,并且具有相對強的共價鍵,允許寬的電化學窗口。由于其小分子尺寸和弱分子間吸引力,這些溶劑顯示出異常低的粘度,這使得能夠獲得比典型電解質溶劑更高的優異的溶劑介電流動性因子。其他類型的共溶劑也可用于拓寬操作溫度范圍,特別是在鹽沉淀和離子傳輸關閉發生的上限。這些非常規電解質雖然僅限于有限的應用,因為它們需要密封的不銹鋼外殼,但仍有很大的發展潛力。
納米限制
根據溶劑分子和溶劑化數,大多數離子溶劑化鞘的尺寸從1埃到近1納米不等。那么溶劑化離子在這些亞納米結構中的行為如何?當將常規LIB電解質注入平均直徑約為40 nm的陶瓷-聚合物復合主體的納米孔中時,Li0陽極的界面行為和形態發生了顯著不同。當醚基電解質凍結到由金屬-有機框架結構形成的0.29 nm亞納米通道中時,電化學穩定性窗口顯著擴大。最后,當相同的聚合物嵌入直徑小至40nm的陶瓷基質的通道中時,沿著陶瓷-聚合物界面發生了非常快的離子傳輸,遠高于相應的本體聚合物電解質。所有這些現象都有一個共同的因素:在納米結構環境中,溶劑化的離子很可能與宿主材料的表面相互作用(圖5),在此過程中,離子發生了部分或甚至完全脫溶劑化,產生尚未完全理解的化學狀態的電解質。

圖 5. 納米約束中的溶解
展望:充滿憂慮的美好未來
電池的故障通常不是由單個故障部件引起的,而是由不同部件之間的相互作用引起的。其中電解質通常是衰減部件,許多基本問題仍然沒有得到解答,如:(i)離子如何確切地穿過由本質絕緣材料組成的界面?(ii)如何精確測量界面內的電子和離子電導率?(iii)哪些部件在相間有效且功能正常,哪些部件不必要且冗余?
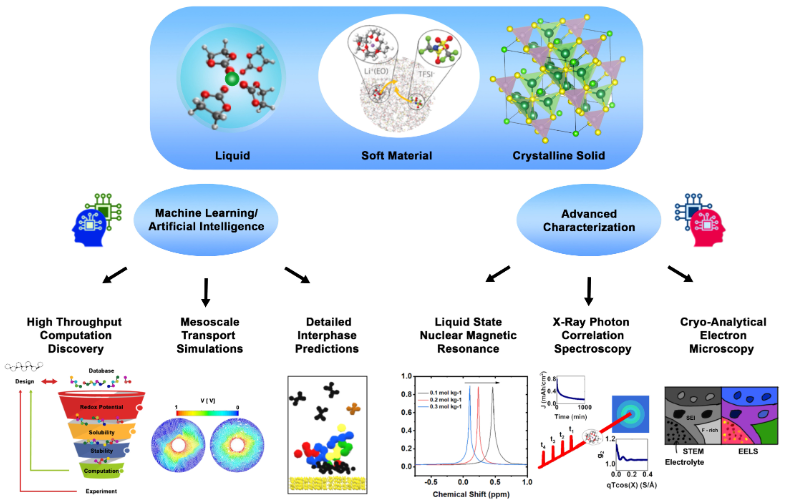
圖 6. 以分子分辨率觀察電解質動力學
結語:加強文獻中電池性能數據的再現性和可比性,強烈鼓勵研究人員進行嚴格的實踐和標準化方案。這些是電池、化學和材料研究界都應該嚴格遵守的不可或缺的準則。
參考文獻:
Y. Shirley Meng et al. Designing better electrolytes. Science. (2022), 378.
DOI:10.1126/science.abq3750
https://www.science.org/doi/10.1126/science.abq3750











