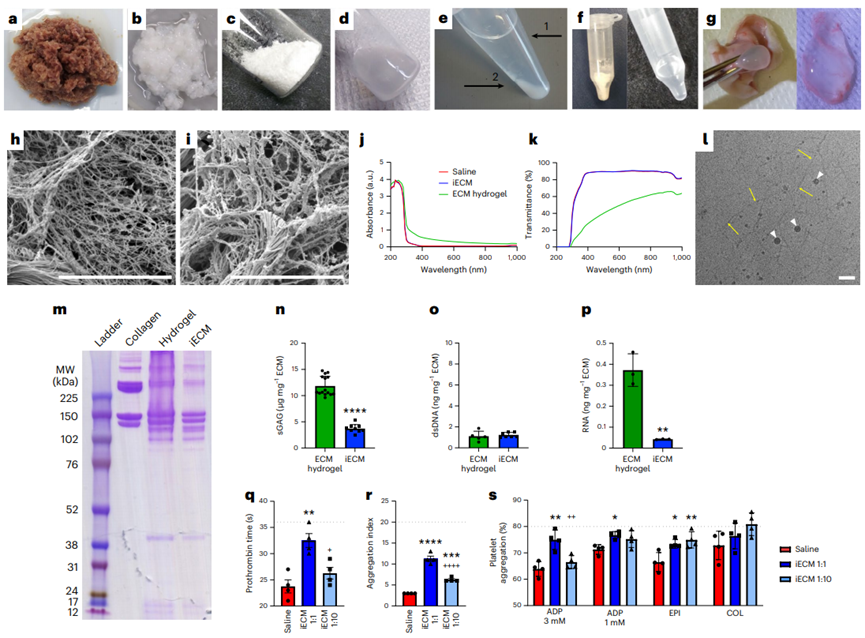
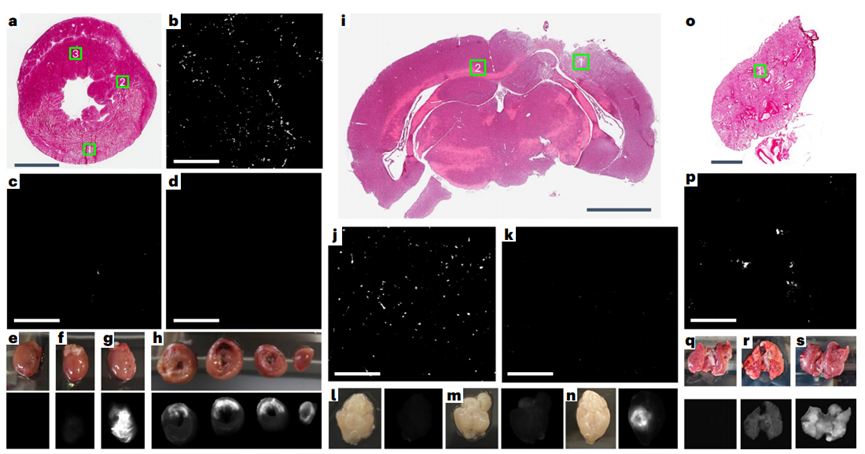
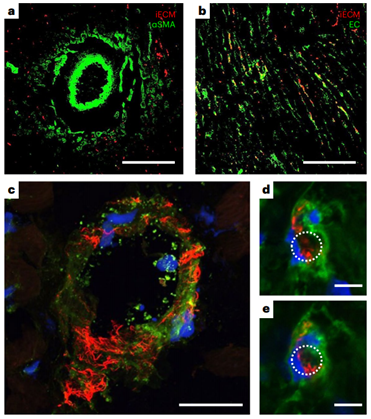
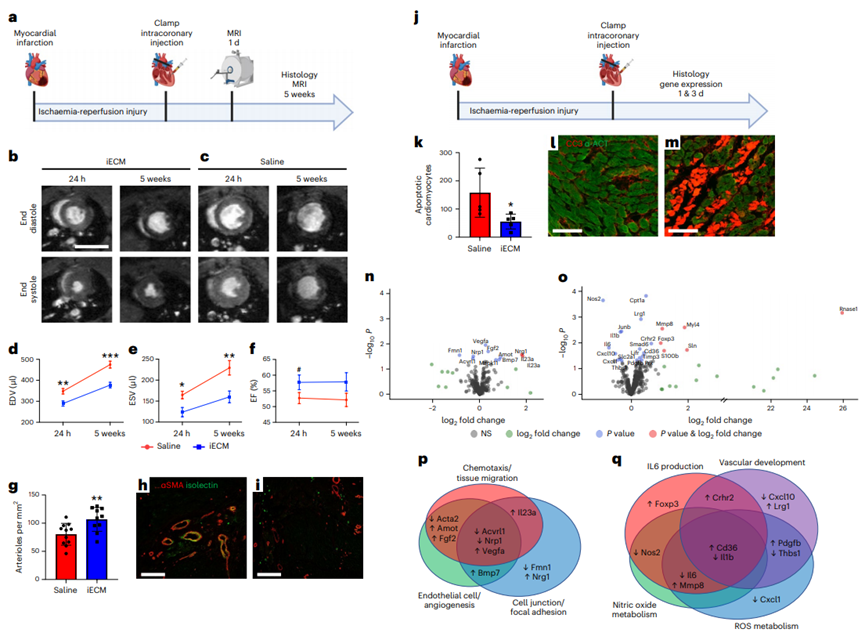
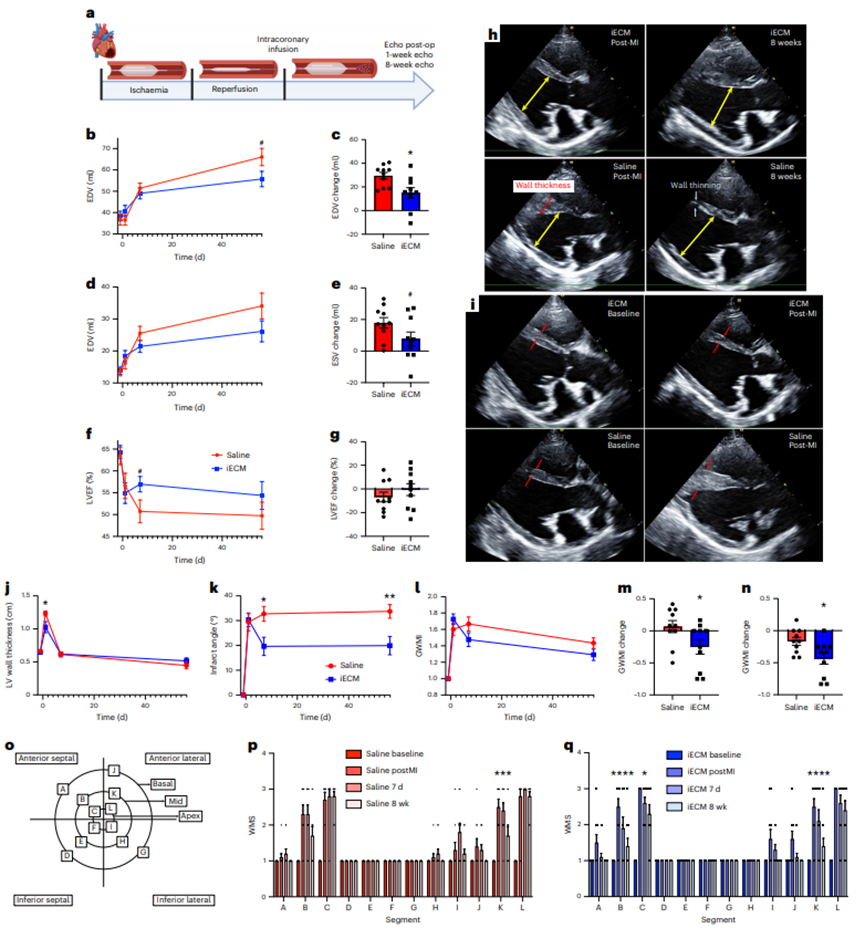
來自脫細(xì)胞組織的細(xì)胞外基質(zhì)(ECMs)作為組織工程支架和再生醫(yī)學(xué)的一種脫細(xì)胞策略顯示了有良好的性能。特別是,脫細(xì)胞ECM可以通過酶消化加工成可誘導(dǎo)的水凝膠,可注射到組織中進(jìn)行微創(chuàng)遞送。這些可降解的水凝膠具有促生存、免疫調(diào)節(jié)和促進(jìn)血管化等多種促再生功能。目前脫細(xì)胞ECM生物材料僅限于手術(shù)植入貼片或局部注射。開發(fā)一種ECM的配方,可以通過血管內(nèi)輸注來靶向滲漏的血管,允許更小的侵入性,更均勻的分布和潛在的更早的輸送。損傷后急性分娩可減少細(xì)胞死亡,促進(jìn)組織搶救和維護(hù)。在轉(zhuǎn)譯方面,對于難以進(jìn)入的組織(如心臟、大腦和肺),可以在干預(yù)時(shí)使用常規(guī)技術(shù)進(jìn)行血管內(nèi)輸注。由于ECM水凝膠的物理特性,這種給藥方式不適合目前的ECM水凝膠,不允許通過損傷或疾病部位泄漏的內(nèi)皮細(xì)胞間隙。在本研究中,加州大學(xué)圣地亞哥分校Karen L. Christman教授團(tuán)隊(duì)提出一種用于血管內(nèi)輸注的ECM配方,以及在急性心肌梗死(MI)、創(chuàng)傷性腦損傷(TBI)和肺動脈高壓(PAH)模型中靶向損傷組織的概念證明證據(jù)。還使用小動物和大型動物急性心肌梗死模型研究了該方法的安全性、有效性和轉(zhuǎn)譯相關(guān)性。該生物材料由脫細(xì)胞、酶解和分離的心室心肌組成,通過與損傷的微血管結(jié)合定位到損傷組織,并在約3 d內(nèi)大量降解。在大鼠和豬的急性心肌梗死誘導(dǎo)后,冠狀動脈內(nèi)輸注生物材料,我們觀察到顯著減少左心室容量和改善壁面運(yùn)動評分,以及與組織修復(fù)和炎癥相關(guān)的基因表達(dá)差異。損傷后血管內(nèi)輸注促愈合細(xì)胞外基質(zhì)可能為炎癥組織的愈合提供由內(nèi)而外的轉(zhuǎn)化優(yōu)勢。脫細(xì)胞心肌ECM水凝膠被選為起始材料,因?yàn)樗谂R床前模型中顯示了療效,以及I期臨床試驗(yàn)中的轉(zhuǎn)化概念證明。雖然這種材料保留了心肌ECM的復(fù)雜性,并且是可注射的,但它是一種半透明的懸浮液,其中含有較大的亞微米顆粒,這些顆粒太大了,無法通過急性損傷和/或炎癥部位的滲漏血管間隙。為了生成血管內(nèi)不溶ECM,開發(fā)了一種優(yōu)化的離心、透析和無菌過濾方案,以從液體ECM水凝膠中去除高分子量肽/蛋白質(zhì)。從高分子顆粒中分離出上清液并進(jìn)行透析,得到低分子部分,不溶性ECM (iECM),然后無菌過濾,凍干長期保存,重懸用于注射/輸注。雖然iECM能夠在皮下注射后在組織中凝膠化,類似于它的ECM水凝膠對應(yīng)物,但在體外恒溫培養(yǎng)時(shí)它沒有凝膠化。2、iECM輸注在多個(gè)臨床前模型中靶向損傷區(qū)域選擇了三種臨床前模型來覆蓋觀察到血管滲漏的不同情況,特別是急性MI、TBI和PAH,它們既代表急性和慢性損傷,也包括缺血性、創(chuàng)傷性和壓力過載損傷。iECM在所有模型中均通過模擬冠脈內(nèi)輸注(大鼠MI模型)和靜脈輸注(小鼠TBI和大鼠PAH模型)進(jìn)行血管內(nèi)給藥。在急性心肌梗死模型中,iECM局限于梗死區(qū)域。在鄰近心肌中觀察到極少的物質(zhì),在遠(yuǎn)端心肌中沒有發(fā)現(xiàn)物質(zhì),包括中隔和右心室。在TBI模型中,材料也局限于創(chuàng)傷區(qū)域,在遠(yuǎn)端腦組織中沒有觀察到材料。在多環(huán)芳烴模型中,由于多環(huán)芳烴模型影響整個(gè)器官,物質(zhì)分布在整個(gè)肺部。近紅外熒光掃描也證實(shí)了組織學(xué)觀察到的所有結(jié)果。生物分布分析表明,過量的iECM積聚在肝臟和腎臟。作為對照,注入鹽水或小標(biāo)記肽(三賴氨酸)對照組,在目標(biāo)器官中沒有滯留,大部分流向腎臟。在所有模型中,iECM都專門分布在損傷組織中,這表明血管滲漏是物質(zhì)滯留所必需的。為了證實(shí)這一點(diǎn),iECM輸注在沒有心肌梗死的健康動物、TBI或PAH以及沒有血管滲漏的慢性心肌梗死大鼠中進(jìn)行。所有這些動物在各自的組織中都表現(xiàn)出最小的基質(zhì)滯留;然而在腎臟和尿液中觀察到物質(zhì),表明幾乎立即消除。3、iECM與發(fā)炎的內(nèi)皮結(jié)合,減少血管滲漏,促進(jìn)血小板粘附,加速血管愈合為了安全性評估,確認(rèn)iECM沒有阻塞血管腔。我們確認(rèn)iECM沒有堵塞小動脈,還觀察到iECM聚集物與微血管網(wǎng)絡(luò),特別是內(nèi)皮細(xì)胞共定位。經(jīng)進(jìn)一步觀察,共聚焦成像顯示,內(nèi)皮細(xì)胞之間的間隙內(nèi)存在類似纖維基質(zhì)的物質(zhì),在某些區(qū)域包裹著內(nèi)膜,但沒有堵塞微血管的管腔,因此假設(shè)iECM輸注通過填充漏血血管的間隙來降低病理組織的通透性。與這一假設(shè)一致,iECM輸注顯著減少了標(biāo)記牛血清白蛋白(BSA)向梗死區(qū)的滲漏,表明iECM降低了組織滲透性。然后,我們進(jìn)一步評估了隨著材料降解,血管滲漏是如何受到影響的,發(fā)現(xiàn)iECM輸注后1和3 d BSA信號仍然下降,這表明iECM加速了血管愈合和閉合。到7 d時(shí),鹽水動物的血管屏障恢復(fù)到與鹽水動物相似的水平。雖然iECM的存在不影響心肌梗死后第1天中性粒細(xì)胞的遷移,但它確實(shí)降低了心肌梗死后第3天梗死內(nèi)的巨噬細(xì)胞密度。在體外,發(fā)現(xiàn)iECM在較低的剪切速率下增加血小板粘附,這可能在體內(nèi)血管愈合中發(fā)揮有益作用,因?yàn)檫@些剪切速率在生理上模擬靜脈流動。重要的是,我們在體內(nèi)沒有觀察到血管系統(tǒng)中的任何凝血或栓塞。血小板聚集和粘附在血管壁和暴露的ECM是導(dǎo)致修復(fù)受損內(nèi)皮屏障的級聯(lián)事件的第一步。這暗示了一種iECM可以調(diào)節(jié)的機(jī)制。體內(nèi)炎癥反應(yīng),如觀察到的巨噬細(xì)胞密度降低,可能與血小板活性協(xié)同工作,以增加結(jié)合和加速血管修復(fù)。4、iECM有利于存活并促進(jìn)組織修復(fù)由于ECM水凝膠先前已被證明可以促進(jìn)組織修復(fù),包括增加血管化、促進(jìn)生存和調(diào)節(jié)炎癥,因此我們假設(shè)iECM也具有類似的促進(jìn)修復(fù)作用。輸注后5周,iECM較對照組顯著增加了梗死血管化。梗死纖維化和間質(zhì)纖維化沒有明顯差異的豐富途徑,包括血管生成,細(xì)胞底物,活性氧(ROS)和一氧化氮(NO)代謝,白細(xì)胞介素6 (IL6)和其他細(xì)胞因子信號。為了進(jìn)一步評價(jià)iECM對內(nèi)皮細(xì)胞代謝和存活的調(diào)節(jié)能力,將大鼠心臟內(nèi)皮細(xì)胞在加入或不加入iECM的情況下進(jìn)行過氧化氫體外孵育,并測量氧化還原代謝和細(xì)胞存活的變化。考慮到這些變化以及我們之前的發(fā)現(xiàn),即原始ECM水凝膠通過游離硫醇作為ROS清除劑,評估了iECM隨著時(shí)間的推移降低培養(yǎng)過氧化氫濃度的能力,并定量了iECM中的游離硫醇,顯示與磷酸鹽緩沖鹽水(PBS)相比,過氧化氫顯著降低,并且存在游離硫醇,側(cè)面證明促進(jìn)組織修復(fù)作用。5、動物急性心肌梗死模型研究了該方法的安全性、有效性和轉(zhuǎn)譯相關(guān)性在體內(nèi),觀察到一些區(qū)域的內(nèi)皮細(xì)胞被iECM包裹。這可能是與暴露在外的ECM結(jié)合,然后組裝iECM,或與細(xì)胞受體結(jié)合的結(jié)果。在體內(nèi),發(fā)現(xiàn)在大鼠模型中,這種對炎癥內(nèi)皮的定位導(dǎo)致血管通透性幾乎立即降低。心肌梗死后,血管通透性增加導(dǎo)致組織水腫,已知這有助于心臟細(xì)胞功能障礙和死亡。正如在豬心肌梗死模型中觀察到的那樣,心肌梗死后不久壁厚顯著降低,這表明對液體和/或小蛋白質(zhì)存在屏障。由于心肌水腫始于缺血,并在再灌注后迅速擴(kuò)大,急性iECM輸注可以防止組織水腫和再灌注損傷引起的進(jìn)一步組織損傷。在許多有血管滲漏的病理中也觀察到組織水腫,包括TBI和PAH,這表明iECM可能是治療此類疾病的一種方法。iECM不僅可以在輸注后立即物理堵塞滲漏血管的間隙,而且還可以幫助加速血管的愈合和關(guān)閉,因?yàn)樗到饬恕?/span>綜上所述,這表明急性心肌梗死后給藥最有效(數(shù)小時(shí)內(nèi)),一旦暴露的ECM部位飽和,治療效果可能會趨于平穩(wěn)。在豬模型中,隨著劑量體積的增加,iECM保留率的回報(bào)遞減。Martin T. Spang, Ryan Middleton, Miranda Diaz, et al.,Intravascularly infused extracellular matrix as a biomaterial for targeting and treating inflamed tissues, Nature Biomedical Engineering 2022DOI: 10.1038/ s41551-022-00964-5https://www.nature.com/articles/s41551-022-00964-5