膠原蛋白是在體內(nèi)起著重要作用的結(jié)構(gòu)蛋白之一,決定著皮膚的強(qiáng)度、緊致度和彈性。膠原蛋白的生成從40歲開始減少,尤其是在女性絕經(jīng)后每年膠原蛋白的生成會減少1-2%。60歲以后,膠原蛋白生成的減少將進(jìn)一步凸顯。皮膚中膠原蛋白的減少導(dǎo)致皮膚失去彈性,隨之而來的就是皺紋增加,光滑度和柔軟度下降,皮膚松弛等,皮膚也會變得非常脆弱。在外界光照紫外線、刺激性揮發(fā)物與皮膚炎癥疾病等刺激下,皮膚會出現(xiàn)色素沉著、皮膚粗糙等表征。因此,人們一直在尋找有效和安全的解決方案來對抗這些疾病并實(shí)現(xiàn)皮膚年輕化。
由于膠原蛋白不可逆轉(zhuǎn)的流失而導(dǎo)致的皮膚萎縮是皮膚老化的標(biāo)志,許多方法旨在恢復(fù)皮膚中膠原蛋白的損失以阻止皮膚的老化。然而,現(xiàn)有包括激光治療、抗氧化劑與類維生素A等藥物技術(shù)都無法實(shí)現(xiàn)長期的內(nèi)源性膠原蛋白替代,實(shí)現(xiàn)隨著時(shí)間的推移始終保持皮膚緊致度和彈性。
近日,北京大學(xué)深圳健康科學(xué)研究院轉(zhuǎn)化醫(yī)學(xué)與創(chuàng)新中心主任的Andrew S. Lee教授與美國德克薩斯大學(xué)MD安德森癌癥中心Betty Y. S. Kim教授率領(lǐng)各自的團(tuán)隊(duì)合力開發(fā)展示了一種基于外泌體的COL1A1 mRNA療法用于光老化皮膚的抗衰老治療,以取代皮膚膠原蛋白的損失。
此工作建立在2020年該團(tuán)隊(duì)同樣發(fā)表于Nature Biomedical Engineering上題為Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation.的工作基礎(chǔ)上。利用先前開發(fā)的納米穿孔技術(shù)(CNP),大幅度提高了細(xì)胞外囊泡(EV)的mRNA遞送和保留效率。進(jìn)一步通過透明質(zhì)酸微針貼片在真皮中有效遞送負(fù)載mRNA的EV,從而誘導(dǎo)動(dòng)物真皮中膠原蛋白的合成并改善光老化皮膚皺紋。

含COL1A1 mRNA的EV的制備和體外遞送:
采用CNP技術(shù)以產(chǎn)生高負(fù)載人膠原蛋白IαI(COL1A1)mRNA的EV,該技術(shù)涉及在納米孔表面上接種單層新生兒真皮成纖維細(xì)胞(nHDF),并用COL1A1-GFP質(zhì)粒納米轉(zhuǎn)染細(xì)胞,在轉(zhuǎn)染后的第二天從培養(yǎng)基中分離出EV。CNP處理的細(xì)胞與使用標(biāo)準(zhǔn)批量電穿孔(BEP)處理的細(xì)胞相比,每個(gè)細(xì)胞的EV數(shù)高10倍。通過納米顆粒跟蹤分析(NTA)確定的EV的直徑約150 nm。蛋白質(zhì)印跡實(shí)驗(yàn)表明,CNP處理組外泌體(CD9,CD63,TSG101)和微泡(ARF6)生物標(biāo)志物的表達(dá)明顯高于未處理組,證實(shí)了分泌EV的增加。RT-qPCR顯示,CNP處理分泌的EV的COL1A1 mRNA水平比BEP高200倍和比非轉(zhuǎn)染細(xì)胞高3000倍。
進(jìn)一步評估含COL1A1 mRNA的EVs(COL1A1-EVs)在體外的治療潛力。觀察到成纖維細(xì)胞的增殖隨著COL1A1-EV處理以劑量依賴性方式增加。COL1A1-EVs處理的成纖維細(xì)胞中觀察到COL1A1蛋白表達(dá)升高,通過定量PCR和蛋白質(zhì)印跡分析分別測量的膠原蛋白mRNA表達(dá)和膠原蛋白水平升高。此外,COL1A1-EV處理后COL1蛋白的前體前膠原I顯著增加。EV細(xì)胞攝取的共聚焦顯微鏡成像表明,EV遞送mRNA到受體細(xì)胞中是由網(wǎng)格蛋白介導(dǎo)的內(nèi)吞作用介導(dǎo)的,并且能夠溶酶體逃逸。綜上所述,這些發(fā)現(xiàn)表明功能性COL1A1 mRNA可以通過CNP穩(wěn)定地包封在EV中,并且該COL1A1-EV遞送系統(tǒng)可以在體外顯著增加COL1A1蛋白表達(dá)。
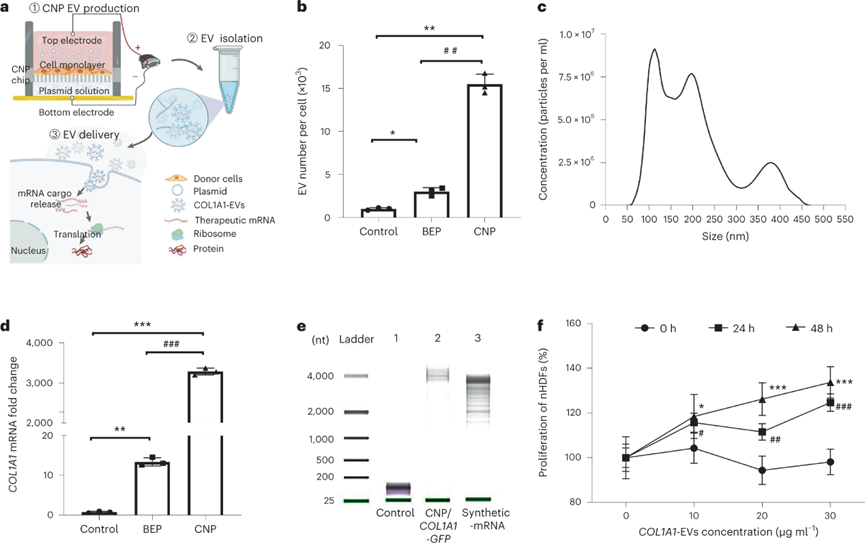
圖|CNP制備裝有大量COL1A1 mRNA的EV
COL1A1-EV遞送后COL1A1 mRNA表達(dá)和蛋白質(zhì)翻譯:
為了解EV介導(dǎo)的COL1A1 mRNA遞送代謝動(dòng)力學(xué),將一定拷貝量的COL1A1 mRNA COL1A1-EV注射到小鼠的真皮中。發(fā)現(xiàn)COL1A1 mRNA在注入后12小時(shí)在局部皮膚組織中顯著升高,隨后24與48小時(shí)顯著降低,并在96小時(shí)恢復(fù)到基線水平。進(jìn)一步評估COL1A1 mRNA誘導(dǎo)膠原蛋白體內(nèi)翻譯。通過免疫熒光顯微鏡觀察到,注射后12 h就觀察到GFP與COL1A1熒光,在給藥后4天出現(xiàn)熒光峰值。這些發(fā)現(xiàn)表明,較低劑量的COL1A1-EV遞送導(dǎo)致受體組織中COL1A1蛋白表達(dá)在3-4天達(dá)到峰值,在注射后第30天降至基線水平。
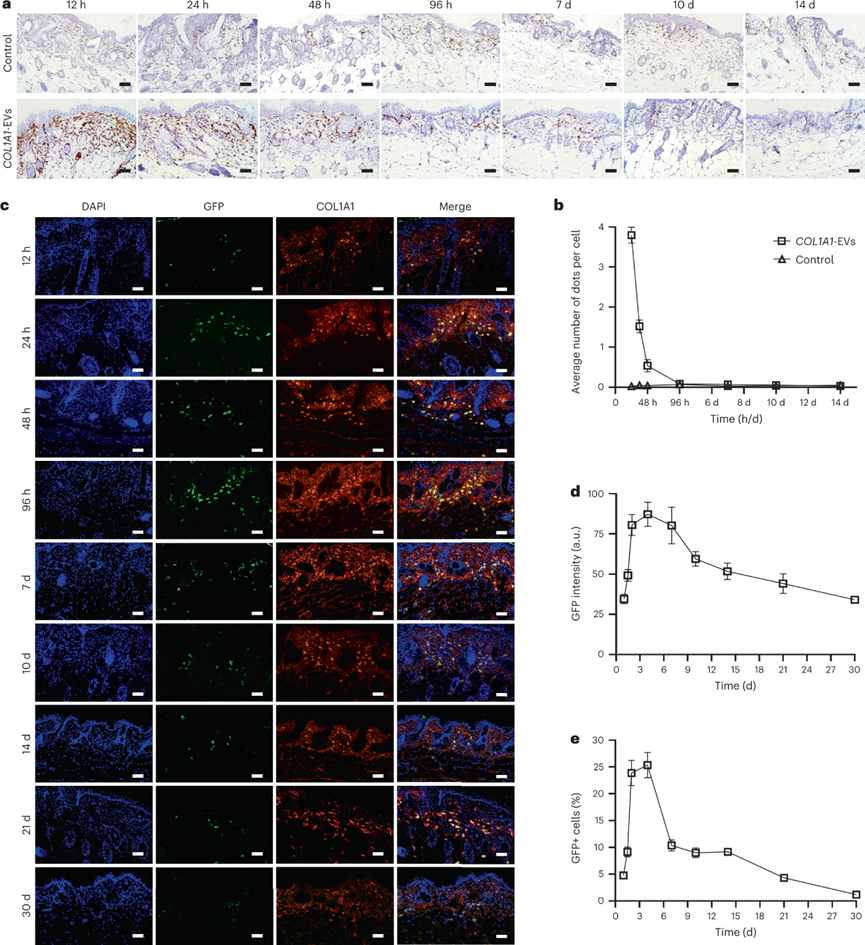
圖 COL1A1-EV mRNA遞送和小鼠皮膚蛋白質(zhì)形成的體內(nèi)動(dòng)力學(xué)
COL1A1-EVs在膠原蛋白消耗皮膚光老化模型中的治療:
真皮光老化的特征是陽光、和紫外線照射破壞皮膚中的膠原蛋白和細(xì)胞外基質(zhì)蛋白,從而導(dǎo)致皺紋的形成。使用該模型驗(yàn)證COL1A1 mRNA EVs在體內(nèi)對抗降解膠原蛋白的能力。治療期間真皮皮膚皺紋的顯微鏡攝影顯示,與生理鹽水對照組相比,到第28天,COL1A1-LNPs,空載EV和視黃酸組的皺紋數(shù)量和面積略有減少。相比之下,用COL1A1-EVs處理的光老化小鼠在治療開始后第7天開始表現(xiàn)出皺紋數(shù)量和面積的減少,從第14天開始顯著減少到與假照射對照組中觀察到的水平相似。值得注意的是,COL1A1-LNPs組的皺紋數(shù)量和面積也減少了,盡管這種效果不如COL1A1-EV那么明顯。用COL1A1-EV和COL1A1-LNPs治療的皮膚也表現(xiàn)出更高的彈性和緊致度。
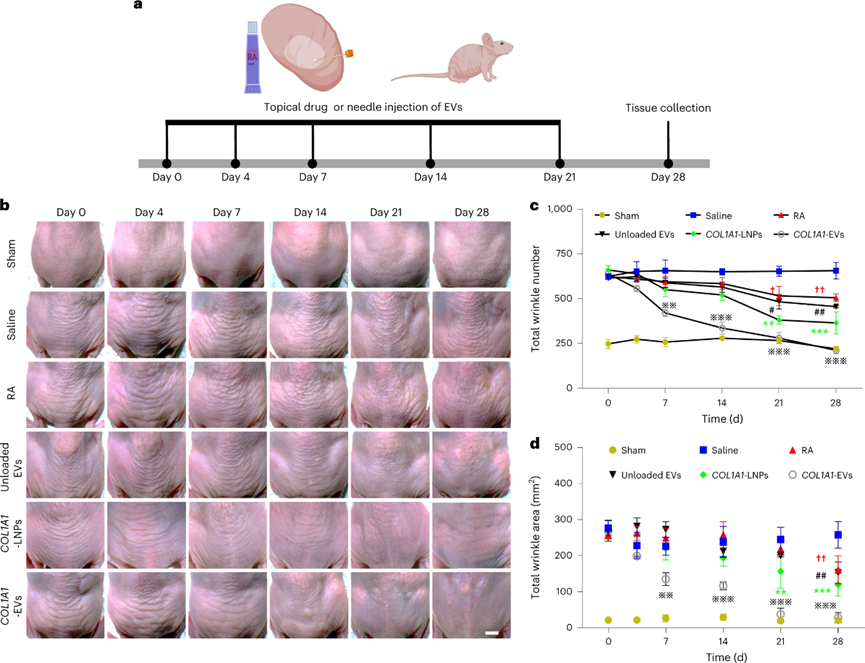
圖 COL1A1-EV mRNA遞送可減少紫外線照射光老化模型中的真皮皺紋
評估COL1A1-LNPs和COL1A1-EVs的免疫原性副作用。與陰性對照和COL1A1-EV處理的皮膚相比,用COL1A1-LNPs處理的皮膚表現(xiàn)出發(fā)紅和腫脹。組織的流式細(xì)胞術(shù)和酶聯(lián)免疫測定進(jìn)一步揭示了接受COL1A1-LNP的組織中以中性粒細(xì)胞為主的大量白細(xì)胞浸潤和高水平的炎性細(xì)胞因子。相比之下,接受COL1A1-EV治療的組織沒有表現(xiàn)出強(qiáng)烈的炎癥反應(yīng)。
進(jìn)一步評估COL1A1-EV遞送治療后真皮膠原蛋白的表達(dá),在治療開始后第28天從切除皮膚進(jìn)行組織學(xué)分析和熒光強(qiáng)度定量。COL1A1-EV處理后COL1A1蛋白表達(dá)相對于其他組顯著恢復(fù)。Masson 三色染色證實(shí),給予 COL1A1-EV 的小鼠的膠原蛋白和真皮厚度水平更高。
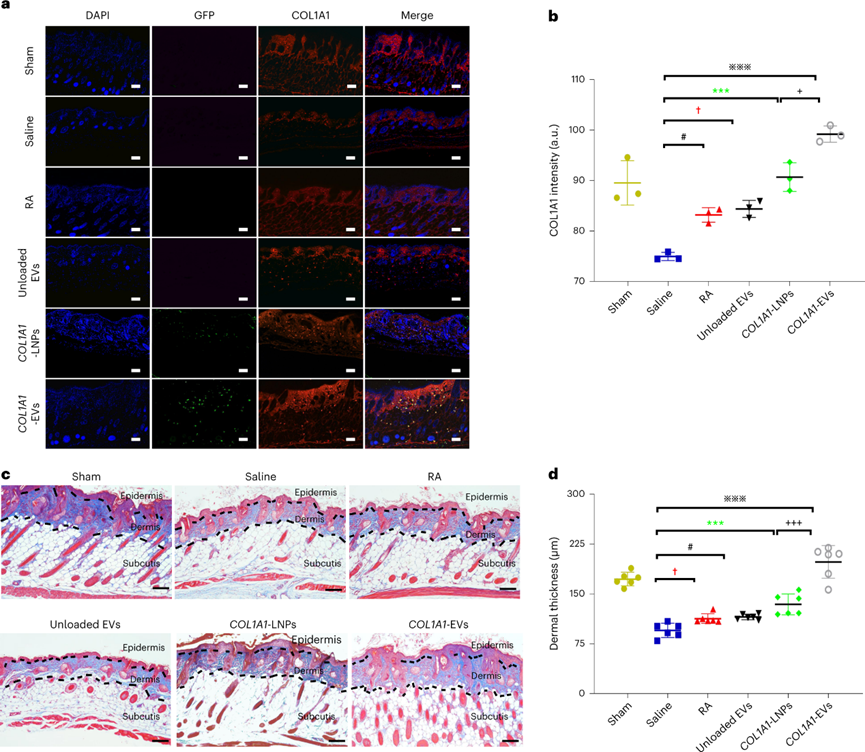
圖 組織學(xué)分析COL1A1-EV mRNA治療光老化小鼠真皮中的膠原蛋白
基于微針的EV mRNA遞送系統(tǒng)設(shè)計(jì):
由于COLA1-EV治療效果僅維持1個(gè)月,希望可以通過設(shè)計(jì)透明質(zhì)酸微針(COL1A1-EV MN)來改善治療持續(xù)時(shí)間與有效性,以改善EV介導(dǎo)的mRNA組織遞送。COL1A1-EV微針貼片的每根針都模制成圓錐形,其底部的圓形直徑為400μm,高度為1000μm。15%透明質(zhì)酸濃度的COL1A1-EV MN載荷斷裂力被證實(shí)高于皮膚穿透所需的最小平均力,H&E染色也證實(shí)微針確實(shí)穿過角質(zhì)層進(jìn)入真皮。為了遞送到組織中,將COL1A1-EV MN貼片壓入小鼠的背側(cè)皮膚中,并在15分鐘后取出微針基底。在此期間,微針完全溶解,在給藥部位沒有可見的皮膚刺激或痕跡。
為了比較微針輸送EV的組織分布與胰島素注射器注射EV的組織分布的區(qū)別,用DiI在小鼠背側(cè)皮膚給藥。組織分布分析顯示,注射器針頭注射導(dǎo)致EV輸送不均勻,在真皮和皮下的特定區(qū)域聚集,而微針遞送的EV在真皮和皮下分散更好。冷凍電鏡對EV膜完整性的評估顯示,與注射器針頭相比,微針貼片輸送的EV更加完整。熒光成像證實(shí)注射法前4天遞送的EV和微針遞送的EV之間的DiI信號相似。然而,COL1A1-EV 微針組在第 4 天和第 7 天具有顯著更高的熒光信號,持續(xù)到給藥后第 10 天。這些發(fā)現(xiàn)表明,使用微針貼片可以改善EV在組織中的長期保留。
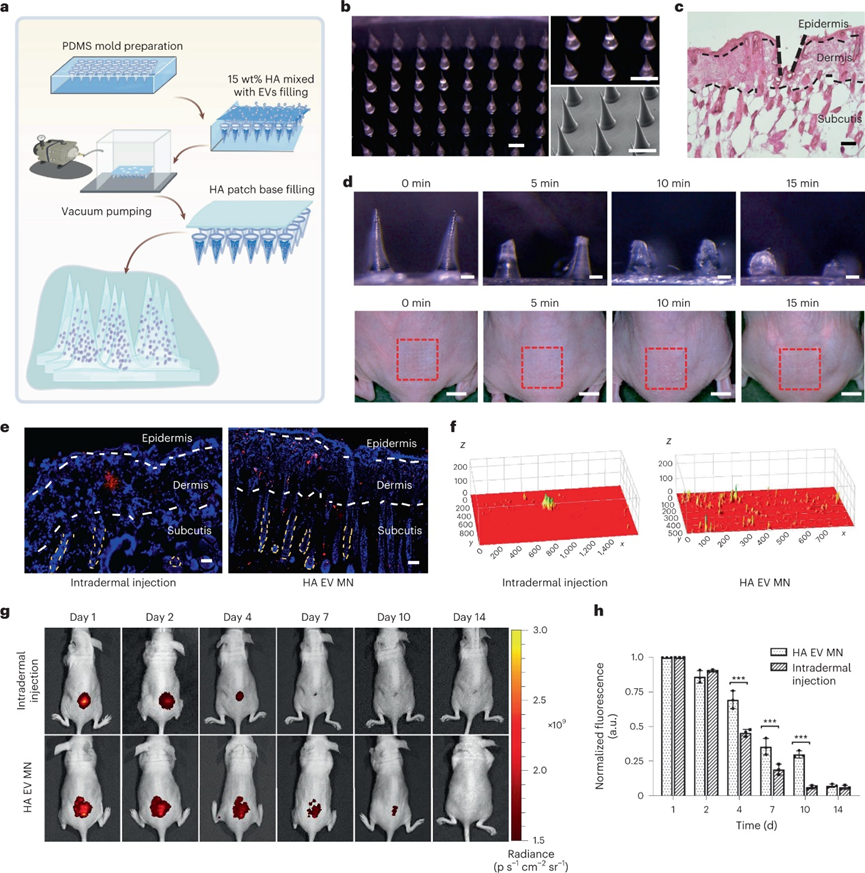
圖 用于改善組織中EV分布的微針輸送系統(tǒng)
COL1A1-EV微針遞送的治療效果:
使用COL1A1-EV微針貼片遞送COL1A1-EVs,以驗(yàn)證該治療策略是否改善光老化小鼠皮膚中的體內(nèi)膠原蛋白再生。相對于注射器注射實(shí)現(xiàn)35天的治療效果,COL1A1-EV MN微針貼片可在70天內(nèi)顯著減少皺紋面積和數(shù)量。注射和微針治療均可在治療后長達(dá)1個(gè)月內(nèi)減少皺紋長度和深度,但只有用微針處理的小鼠在長達(dá)2個(gè)月的時(shí)間內(nèi)表現(xiàn)出皺紋長度和深度的顯著持久減少。

圖 通過COL1A1-EV微針輸送COL1A1-EV改善光老化皮膚的長期治療
對治療后采集的皮膚樣本的組織學(xué)分析證實(shí),注射組與微針組小鼠的真皮和皮下均在1個(gè)月內(nèi)可以觀察到GFP與COL1A1蛋白熒光信號。然而,到2個(gè)月的時(shí)間點(diǎn),只有COL1A1-EV微針隊(duì)列中的小鼠在真皮和皮下表現(xiàn)出GFP與COL1A1信號。在給藥后3個(gè)月,所有組的皮膚樣本均未顯示任何GFP與COL1A1信號。量化COL1A1與GFP免疫熒光強(qiáng)度,顯示微針組在第30-60天呈有效治療,第70-90天恢復(fù)到治療前基線。并且在所有隊(duì)列中,COL1A1-EV MN組具有最豐富的膠原纖維和最高的真皮厚度。綜上所述,通過COL1A1-EV MN系統(tǒng)封裝和遞送COL1A1 mRNA可以延長光老化皮膚中的膠原蛋白再生時(shí)間,其持續(xù)時(shí)間是注射器針頭遞送時(shí)間的兩倍以上。
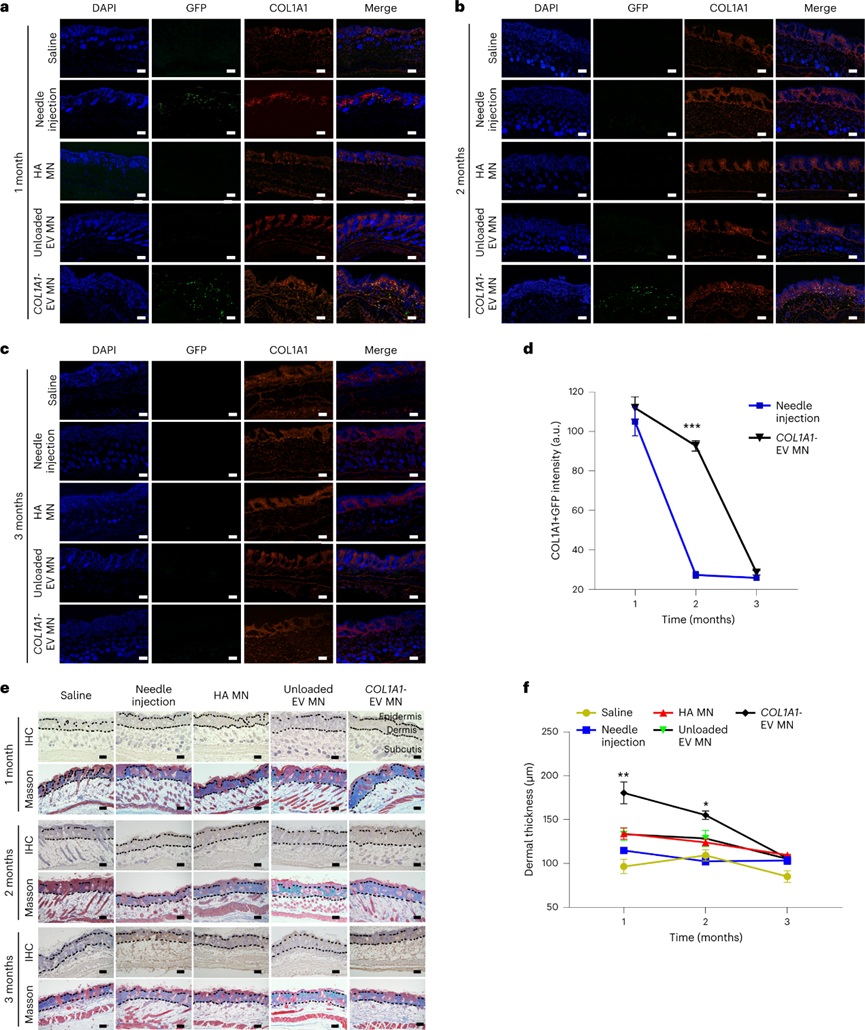
圖 通過COL1A1-EV MN遞送COL1A1-EV mRNA導(dǎo)致皮膚長期蛋白質(zhì)再生
小結(jié):
細(xì)胞外囊泡因其生物相容性、低免疫原性和來自健康人體細(xì)胞等固有特性而成為下一代藥物遞送系統(tǒng)。盡管如此,大多數(shù)專注于核酸遞送領(lǐng)域的研究都將如microRNA和小干擾RNA的小分子進(jìn)行負(fù)載,而較大的核酸很少被評估,因?yàn)殡y以將它們加載到EV中。基于作者團(tuán)隊(duì)前期開發(fā)的一種mRNA加載技術(shù)——CNP,可以大規(guī)模生產(chǎn)含有完整內(nèi)源性mRNA的EV,用于核酸治療。CNP能夠?qū)⒏呖截悢?shù)的COL1A1 mRNA(~4,000+ nt)加載到EV中,這是其他常用方法無法實(shí)現(xiàn)的。
與基于DNA的基因療法相對持久的表達(dá)相比,mRNA療法可能有助于推進(jìn)基因治療并降低不良事件的風(fēng)險(xiǎn),因?yàn)閙RNA保留在細(xì)胞質(zhì)中,而不會滲透到細(xì)胞核中。因此,基于mRNA比基于DNA和基于病毒的基因療法具有優(yōu)勢。然而,mRNA療法的臨床轉(zhuǎn)化仍然有限。為了使mRNA治療適應(yīng)長程治療,作者團(tuán)隊(duì)進(jìn)一步開發(fā)了一種用于遞送COL1A1-EV的微針陣列,以使EV均勻分布到局部組織中,同時(shí)減少膜破裂。通過將 EV 集成到透明質(zhì)酸微針生物材料中,能將 COL1A1 的膠原蛋白治療效果延長至 60 天以上。
COL1A1-EV MN臨床應(yīng)用的未來挑戰(zhàn)包括優(yōu)化微針幾何形狀以及優(yōu)化儲存條件,因?yàn)?strong style=";padding: 0px;outline: 0px;max-width: 100%;box-sizing: border-box !important;overflow-wrap: break-word !important">mRNA在高于-80°C的保存條件下會快速降解。COL1A1-EV MN未來可以向即用型醫(yī)療器件方向發(fā)展,并配合其他試劑或方法提高mRNA的運(yùn)輸保存溫度,這將大幅度提高COL1A1-EV MN系統(tǒng)的臨床實(shí)用性。同時(shí)可以通過改變內(nèi)部攜帶的mRNA來擴(kuò)展該系統(tǒng)的治療應(yīng)用。該系統(tǒng)也適用于負(fù)載其他類型的核酸分子,如miRNA和siRNA,甚至多肽和蛋白質(zhì)也可行。與LNP和腺相關(guān)病毒(AAV)相比,EV遞送系統(tǒng)的相容性更加良好、副作用有所改善,該系統(tǒng)存在發(fā)展成為治療通用核酸載體的強(qiáng)大潛力。
參考文獻(xiàn):
Yi You, Yu Tian, Zhaogang Yang, et al. Intradermally delivered mRNA-encapsulating extracellular vesicles for collagen-replacement therapy. Nat Biomed Eng. 2023 Jan 12.
https://www.nature.com/articles/s41551-022-00989-w
Zhaogang Yang, Junfeng Shi, Jing Xie, et al. Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation. Nat Biomed Eng. 2020 Jan;4(1):69-83.
https://www.nature.com/articles/s41551-019-0485-1











