創傷性腦損傷(TBI)是一種由外力引起、影響最為嚴重的神經系統疾病, 目前它已被世界衛生組織列為造成年輕人死亡和致殘的主要原因。腦微血管,作為血腦屏障的重要組成部分,非常容易受到外力而發生損傷,因此,血腦屏障的破壞是TBI中常見且突出的病理特征之一。然而,作為血腦屏障破壞的兩大關鍵證據——腦微血管破裂以及血流灌注不足,由于當前成像技術時空分辨率的不足,仍然難以實現精準的可視化。另外,由于血腦屏障的破壞會引發例如炎癥反應以及自由基介導的氧化損傷等等一系列分子生化事件,這些繼發性損傷過程將進一步破壞血腦屏障從而導致例如癲癇、帕金森、阿爾茲海默癥等長期的腦部并發癥,嚴重影響TBI患者的生活質量。目前,利用自由基清除劑來抑制氧化損傷和神經炎癥的神經保護療法在TBI治療中顯示出良好的前景,但傳統的神經保護策略依舊難以為治療效果的評價提供及時地反饋。
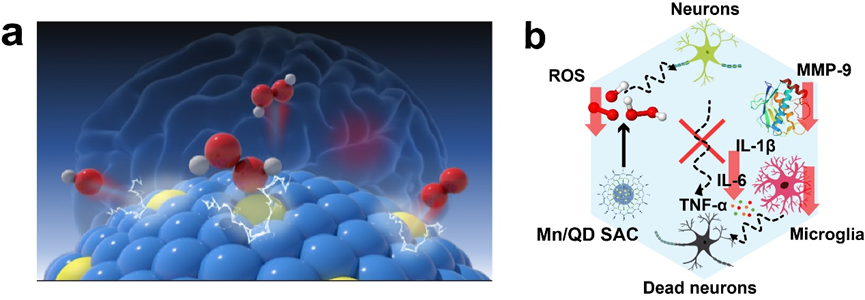
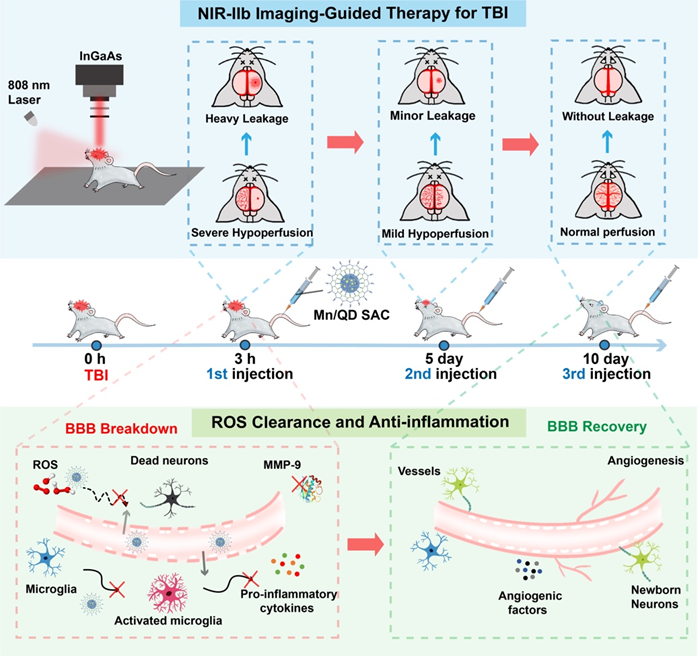
為了實現動態影像引導的精準TBI神經保護治療,武漢大學化學與分子科學學院崔然副教授、張志凌教授、武漢大學口腔醫院孫志軍教授和武漢理工大學張明曦副教授受到天然Mn超氧化物歧化酶的啟發,創新性地將具有抗氧化活性的Mn2+摻入到近紅外IIb (NIR-IIb)區Ag2Te量子點中,構建出一種熒光發射波長位于NIR-IIb窗口的Mn單原子催化劑(Mn/QDSAC),能夠成功打開TBI治療過程中的“黑匣子”——以高時空分辨率實時動態地監測血腦屏障狀態,為更加精準的治療提供及時的療效反饋和有力指導。另一方面,高度單原子分散于Ag2Te量子點表面的Mn使得Mn/QD SAC呈現高效清除活性氧的催化活性,能夠有效緩解TBI后活性氧介導的神經炎癥和神經凋亡,借助此治療策略,成功地實現了血腦屏障的快速重建和神經功能恢復。該工作為實時動態影像引導的精準神經保護治療以及一些活性氧相關疾病提供了新的思路與研究基礎。
本文要點:
1. 基于納米粒子的“自凈化”特性,采用“高溫成核、高溫生長”的摻雜策略將Mn成功地引入并以單原子形態分散于Ag2Te量子點晶體的表面,構建出一種具有類超氧化物歧化酶(SOD)和類過氧化氫酶(CAT)催化活性NIR-IIb發射Mn單原子催化劑,表現出高效的活性氧(ROS)綜合清除能力和NIR-IIb熒光性能。
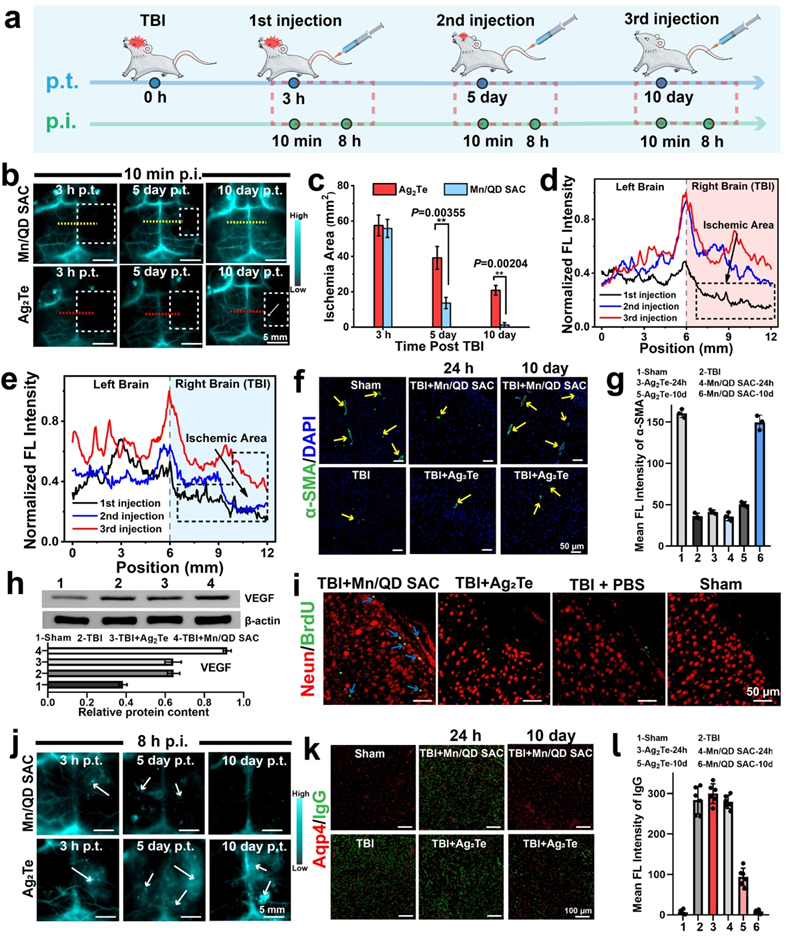
2. 針對在TBI治療過程中血腦屏障狀態難以反饋的“黑匣”問題,該方法借助NIR-IIb熒光成像對TBI后血腦屏障的動態變化進行了無創、實時、高時空分辨率的成像,通過對血腦屏障的損傷程度、范圍進行精準時空評估能夠及時地獲取療效反饋,對后續采取合適的治療策略提供有力指導。
3. 單原子催化劑Mn/QD SAC可有效抑制基質金屬蛋白酶9(MMP-9)的表達、小膠質細胞的活化以及炎癥因子的釋放,緩解ROS介導的腦部炎癥,減少水腫的發生以及神經元的凋亡,促進血腦屏障的快速重建和提升神經功能的恢復效果。
該研究成果近日以論文形式在線發表在綜合性權威期刊Nature Communications上,題目為“Near-Infrared-IIbEmitting Single-Atom Catalyst for Imaging-Guided Therapy of Blood-Brain BarrierBreakdown after Traumatic Brain Injury”。武漢大學化學與分子科學學院2020級博士研究生黃彪為第一作者,武漢大學崔然副教授、張志凌教授和孫志軍教授、武漢理工大學張明曦副教授為該論文共同通訊作者,崔然副教授為最后通訊作者。
上述研究工作得到了國家重點研發計劃(2020YFA0908800)、國家自然科學基金(22174105,21974104, 22074107, 22274118,82072996)的支持。
文章鏈接:
https://www.nature.com/articles/s41467-023-35868-8











