表達特定抗原的癌癥是疫苗治療的理想模型,因此已在該領域得到廣泛探索。然而,癌癥疫苗表現出不同程度的成功,因為許多侵襲性癌癥具有異質性和快速變異,這可能導致免疫系統逃避并降低疫苗有效性。一種改進癌癥疫苗的方法涉及整合多個腫瘤靶標,激活全系統的多 T 細胞免疫反應。多種抗原靶標已作為肽或脂質包封的 RNA 的簡單混合物摻入疫苗制劑中。然而,這些方法幾乎無法控制這些成分的結構呈現,而這會顯著改變疫苗的效力。因此,了解如何利用多抗原成分的結構呈現來最大化抗腫瘤反應對于開發有效的癌癥疫苗至關重要。球形核酸(SNA)由納米顆粒核心和免疫刺激性寡核苷酸的致密放射狀殼組成,是在Chad A. Mirkin實驗室發明和開發的。SNA為設計癌癥疫苗提供了一個有前途的平臺,因為它們可以進入 60 多種不同的細胞類型而不需要轉染試劑,并且它們對核酸酶降解表現出很高的抵抗力。近日,美國六院院士、中國科學院外籍院士、西北大學Chad A. Mirkin教授等人利用SNA平臺將兩種抗原精確地整合到單一疫苗架構中,每種抗原針對不同類別的 T 細胞,以研究兩種抗原類別的空間分布和位置如何影響抗原加工、細胞因子產生和記憶的誘導。

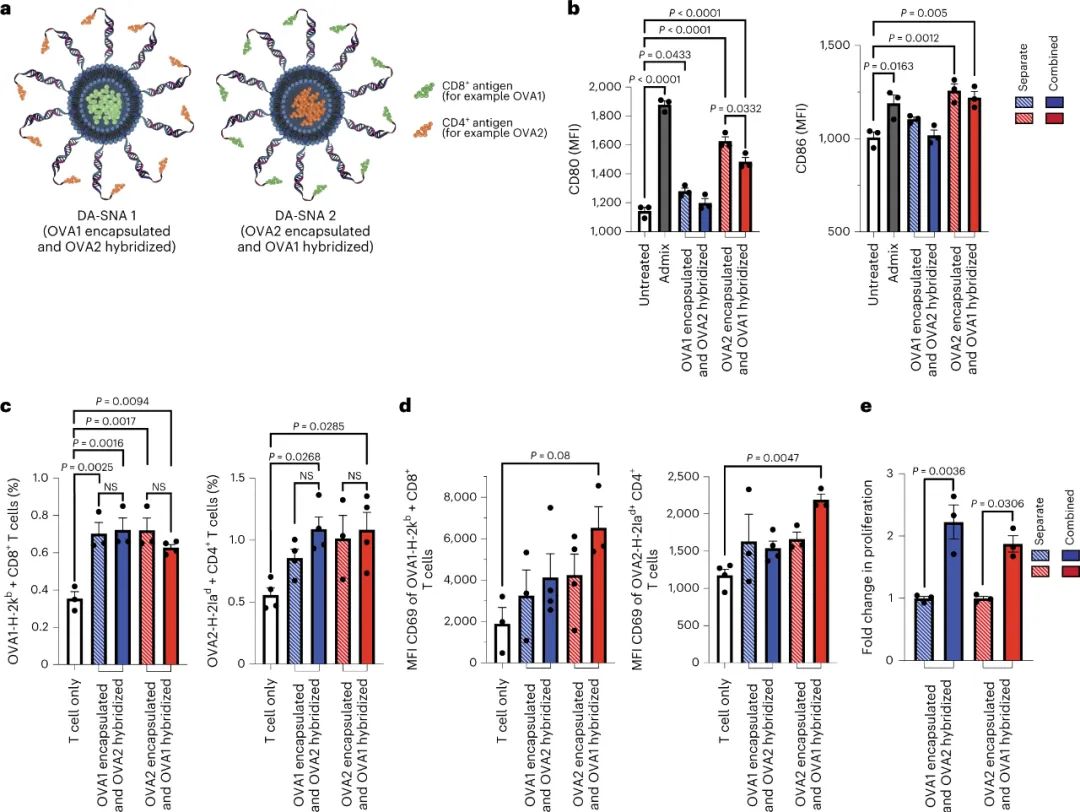
與單抗原 SNA 相比,單一雙抗原 SNA 引起抗原特異性 T 細胞活化增加 30%,T 細胞增殖增加兩倍。重要的是,研究人員評估了成分相同的 SNA 疫苗,這些疫苗僅在疫苗結構內的納米級抗原放置方面有所不同,以了解抗原位置如何影響樹突狀細胞對它的處理。研究人員發現抗原放置改變了轉錄組水平的免疫通路調節,以及細胞水平的細胞因子產生、細胞因子分泌和免疫表面標志物表達,以及生物體水平的腫瘤生長。通過系統地研究抗原類別的放置與隨后的免疫反應之間的關系,該工作提供了一套可轉化的疫苗設計規則。
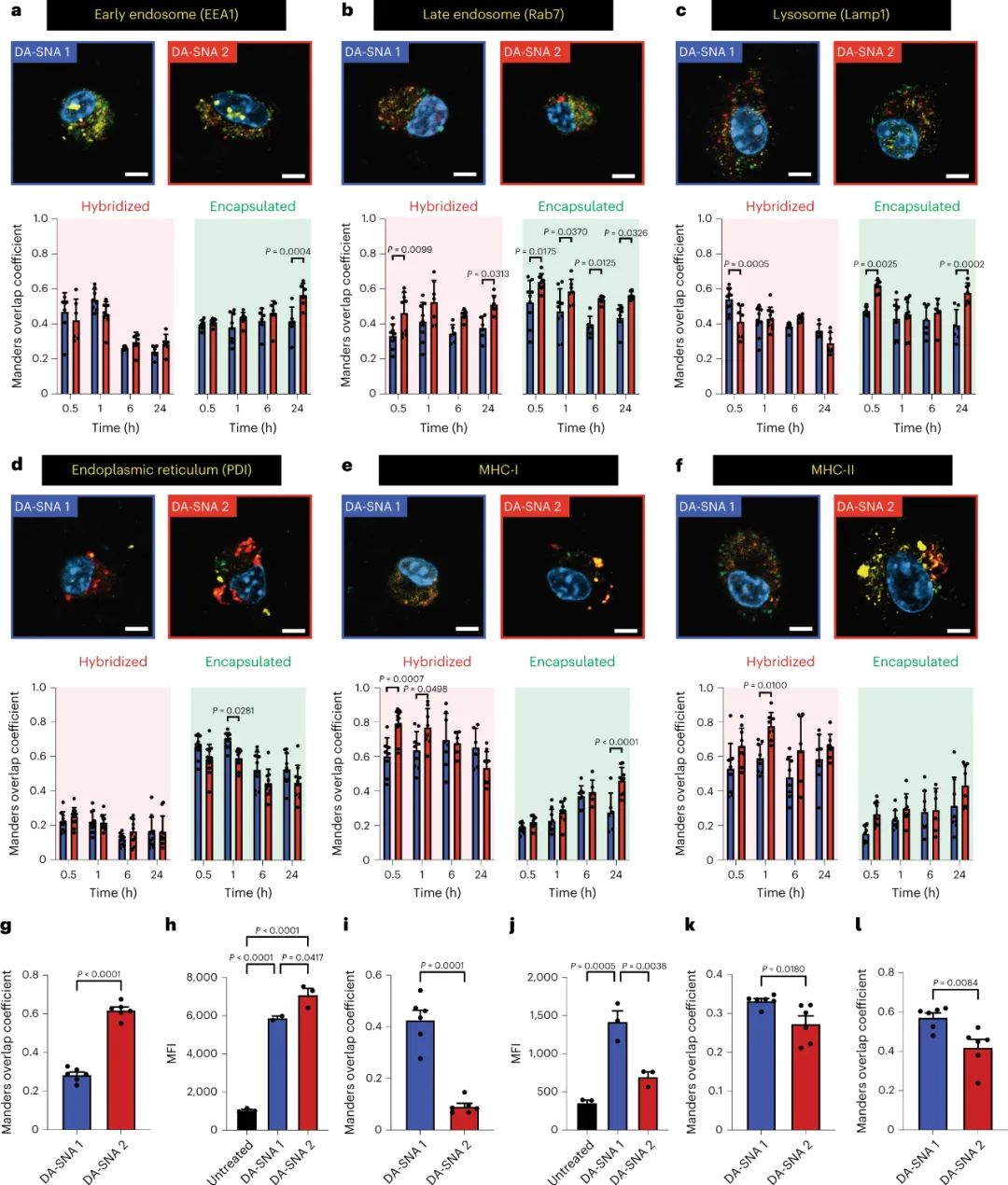
圖|球形核酸(SNA)疫苗中兩類抗原的遞送改變了抗原在體外的處理方式研究人員明確地證明了疫苗結構中的抗原放置是一種會強烈影響疫苗效力的設計標準。研究人員觀察到由抗原放置引起的免疫基因表達的變化,其中一種排列導致與炎癥反應、趨化性和關鍵免疫細胞遷移有關的基因上調,這些基因共同影響免疫細胞活性。研究人員得出結論,納米級抗原放置會改變細胞內抗原加工的時間尺度和抗原在不同細胞區室中的停留時間。抗原加工動力學的變化導致樹突狀細胞和 T 細胞活化的差異,例如細胞因子分泌和 T 細胞記憶標記表達的不同程度。總的來說,這些細胞效應改變了腫瘤的生長情況。研究人員利用一種帶有封裝的輔助性 T 細胞抗原和外部偶聯的細胞毒性 T 細胞抗原的 SNA 排列,在小鼠體內阻止了三種不同的腫瘤類型,并增強了檢查點抑制劑的功效。
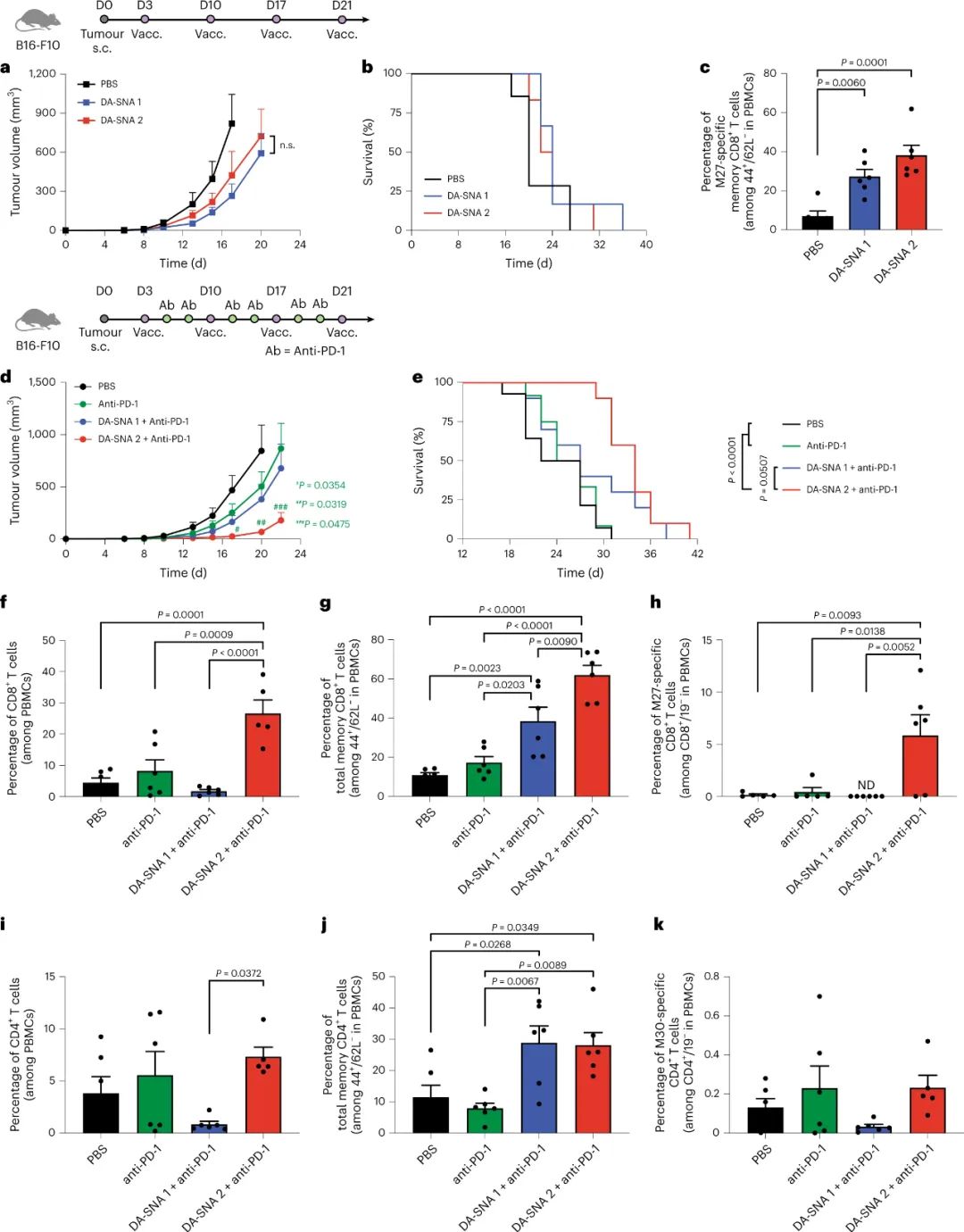
圖|雙抗原免疫療法聯合免疫檢查點抑制劑的抑制作用
綜上所述,該工作強調了在設計針對侵襲性癌癥的模塊化多面疫苗時放置抗原的重要性。研究數據表明,如果不考慮免疫細胞對其進行處理,即使是正確的靶點也可能產生無效的疫苗。此外,這項工作通過提供一個能夠控制輔助性 T 細胞和細胞毒性 T 細胞激活時間的平臺,將免疫學和納米化學之間的基礎知識聯系起來。通過模塊化架構(例如 SNA)實現合理的設計參數,可以大大提高疫苗效力。這些結構可用于快速配制針對新抗原靶點的癌癥候選疫苗,并提高臨床試驗中現有抗原的效力。除了本文研究的抗原之外,還有許多其他類別的抗原可用于對抗腫瘤。事實上,擴展這種方法并分析各種其他抗原的結構意義是必要的,因為在這項工作中探索的加工途徑對于對抗其他疾病也很重要。通過擴展這種方法并繼續系統地評估影響疫苗成分運輸的各種結構參數,本文旨在生成設計規則,使研究人員能夠將所需的抗原呈遞和信號分布與特定的納米級結構相匹配。Teplensky, M.H., Evangelopoulos, M., Dittmar, J.W. et al. Multi-antigen spherical nucleic acid cancer vaccines. Nat. Biomed. Eng (2023).https://doi.org/10.1038/s41551-022-01000-2