1. Nano Research綜述:碳基納米酶的生物醫學應用深圳市第二人民醫院/深圳大學醫學部第一附屬醫院聶國輝教授、北京理工大學梁敏敏教授和中科院生物物理研究所閻錫蘊院士對碳基納米酶的生物醫學應用相關研究進行了綜述。1)納米酶是指具有類酶性質的納米材料,由于其能夠解決傳統酶的局限性,如不穩定性、高成本和難以大規模生產等問題而引起了研究者的極大興趣。在過去的十年內,研究者通過改造天然酶的活性中心或在納米結構中引入多價元素而構建了多種具有模擬酶活性的納米材料。其中,碳納米材料具有明確的電子和幾何結構,其能夠模擬天然酶的催化中心,并逐漸發展成為傳統酶的良好替代品。此外,由于碳納米材料有效結合了獨特的電子、光學、熱學和機械性能,因此基于碳納米材料的納米酶也可以作為多功能平臺以用于生物醫學領域。2)作者在文中介紹了碳納米酶的酶學特性以及最新的研究進展,并綜述了其在生物醫學中的重要應用;最后,作者也對該領域面臨的嚴峻挑戰和未來的發展前景進行了討論和展望。
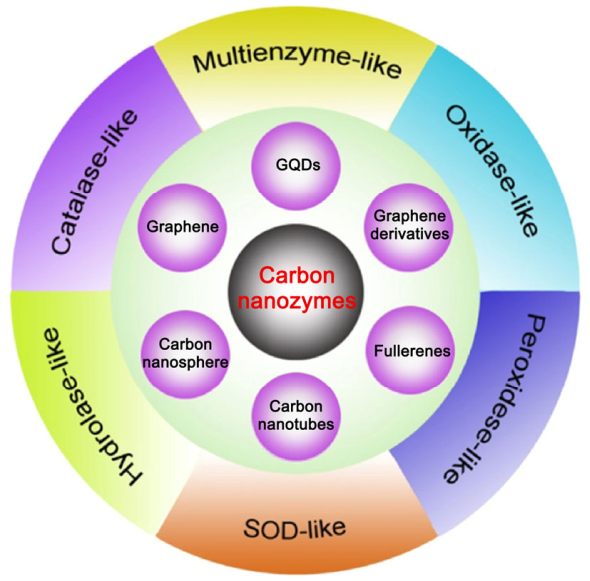
Hui Ding. et al. Carbon-based nanozymes for biomedical applications. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3053-92. Nano Research:功能化氧化石墨烯納米片高效抗菌應用由于抗生素治療面臨耐藥性的巨大挑戰,因此開發不依賴于抗生素的抗菌藥物具有重要的意義。氧化石墨烯(GO)具有天然的抗菌機制(如鋒利的邊緣切割效果),是一種極具發展前景的抗菌制劑。然而,氧化石墨烯的負電荷和較低的光熱效應會嚴重限制其抑菌活性。有鑒于此,四川大學華西口腔醫院彭強研究員合成了具有獨特的三合一性能、氨基功能化的氧化石墨烯納米片(AGO),其能夠實現三個重要的基本特性(正電荷、強光熱效應和自然切割效應)有效集成。1)帶正電荷的AGO(30 mV)與模型病原菌變形鏈球菌(Streptococcus mutan)具有較強的相互作用(330 nN)。此外,100 μg·mL-1 AGO的自然切割作用能夠使細菌在孵育30 min后喪失27%的活力。2)實驗結果表明,近紅外照射僅5 min后,具有三合一特性的AGO能夠使細菌喪失98%的活力。綜上所述,集三重性能于一體的AGO能夠在較短的照射時間下有效殺滅細菌,并具有可調節的抗菌活性,有望實現臨床轉化應用。

Bo-Yao Lu. et al. Functionalized graphene oxide nanosheets with unique three-in-one properties for efficient and tunable antibacterial applications. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3064-63. Nano Research:利用基于免疫可調的二維配位納米片的聲動力治療增強抗腫瘤免疫治療能夠深度穿透、具有高安全性的超聲可通過激活聲敏劑產生細胞毒性活性氧(ROS)以用于聲動力治療(SDT)。基于此,蘇州大學劉莊教授和陳倩教授制備了由Zn2+和四(4-羧苯基)卟啉(TCPP)組成的二維配位納米片。1)研究發現,這種Zn-TCPP 2D納米片不僅能夠實現增強的超聲觸發ROS生成以用于無創SDT,也能夠有效負載低聚脫氧核苷酸(如胞嘧啶-硫代-鳥嘌呤(CpG),一種有效的toll樣受體9 (TLR9)激動劑),進而激活免疫反應。對原發腫瘤進行高效的SDT后可釋放腫瘤相關抗原,該抗原能夠與Zn-TCPP/CpG佐劑納米片相協同以發揮全腫瘤細胞疫苗的作用,并引發腫瘤特異性免疫應答。2)與此同時,超聲本身也可以通過改善T細胞的腫瘤浸潤和限制腫瘤微環境中的調節性T細胞來加強抗腫瘤免疫反應。因此,在原發腫瘤被破壞后使用Zn-TCPP/CpG納米片進行SDT可以誘導產生有效的抗腫瘤免疫反應,抑制遠端外腔腫瘤的生長,而無需直接進行SDT治療。實驗結果表明,SDT聯合Zn-TCPP/CpG也可引發強烈的免疫記憶效應,抑制原發腫瘤消除后的腫瘤復發。綜上所述,該研究構建的2D配位納米片能夠通過有效的SDT觸發的免疫效應實現高效的癌癥治療。
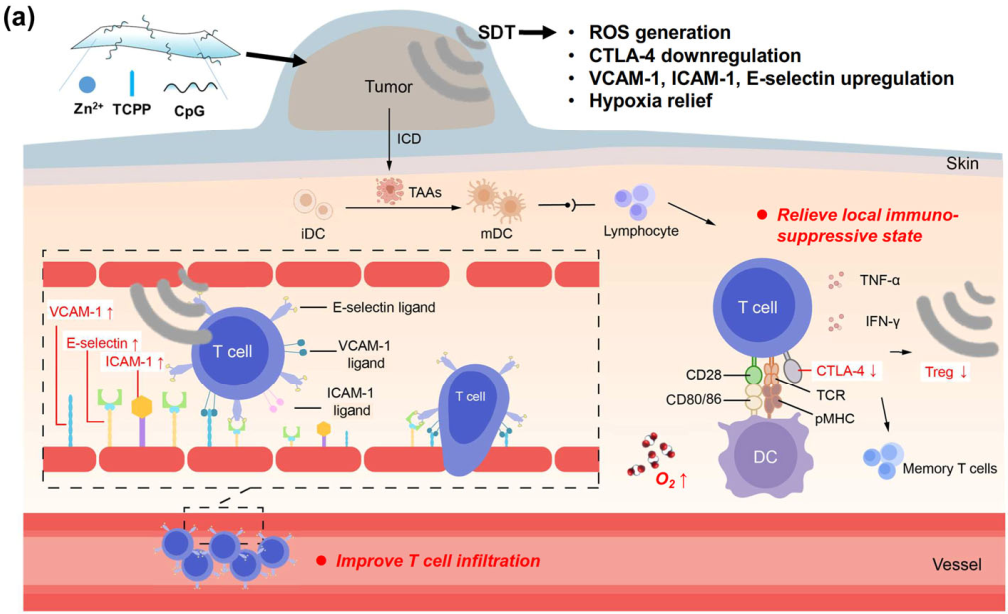
Wenjun Zhu. et al. Sonodynamic therapy with immune modulatable two-dimensional coordination nanosheets for enhanced anti-tumor immunotherapy. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3070-84. Nano Research:自靶向可視化HA納米凝膠用于同步細胞內釋放阿霉素和順鉑以對抗耐多藥乳腺癌耐多藥(MDR)的機制較為復雜且尚不明確,是臨床癌癥化療成功所面臨的主要障礙之一。由多種具有不同作用機制的細胞抑制劑組成的復合納米顆粒有望能夠解決臨床MDR。然而,不同藥物的藥代動力學和釋放行為往往是不同的,這也是導致藥物內化不一致以及腫瘤部位的藥物協同作用不佳的主要問題。有鑒于此,南方醫科大學喻志強教授、中科院長春應化所丁建勛研究員和哈佛醫學院Yu Shrike Zhang開發了一種自靶向型透明質酸(HA)納米凝膠(CDDPHANG/DOX),其能夠通過實現拓撲異構酶II抑制劑阿霉素(DOX)和脫氧核糖核酸連接劑順鉑(CDDP)的同步藥代動力學、瘤內分布和細胞內釋放來逆轉耐藥性。1)研究表明,CDDPHANG/DOX在體內具有延長的循環時間和增強的瘤內積累,可有效地向耐藥MCF-7/ADR乳腺癌細胞遞送藥物,以增強抗腫瘤活性。2)此外,DOX熒光成像結合CDDP顯微CT成像能夠實現對腫瘤聯合化療的可視化。綜上所述,該研究開發的能夠對同步給藥進行可視化的自靶向型原位交聯納米平臺在晚期癌癥的臨床治療應用方面具有良好的潛力。
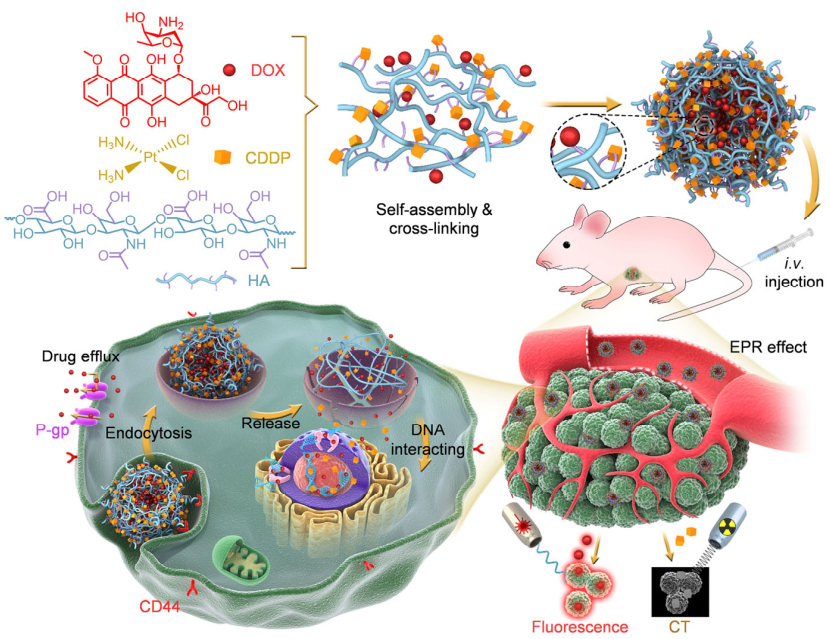
Wen Ma. et al. Self-targeting visualizable hyaluronate nanogel for synchronized intracellular release of doxorubicin and cisplatin in combating multidrug-resistant breast cancer. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3124-y5. Nano Research:用于治療肺部疾病的納米技術的最新應用和策略中山大學吳鈞教授和林東軍教授對用于治療肺部疾病的納米技術的最新應用和策略進行了綜述。1)包括新冠肺炎和肺癌在內的肺部疾病是人類健康的一大威脅。然而,對多種肺部疾病(如肺炎、哮喘、癌癥和肺結核)的治療和診斷也變得越來越具有挑戰性。目前,已有不同類型的治療或診斷方法能夠用于治療肺部疾病。然而,化療的不良反應、耐藥細菌、具有顯著毒性的副作用以及藥物遞送不良等問題也使得開發新型的治療方法非常必要。作為一種新興技術,在醫學領域得到了廣泛的研究。已有的研究表明,納米遞送系統可以顯著增強藥物遞送的靶向性。與傳統的給藥方式相比,采用多種納米顆粒的給藥策略可以改善檢測方法和藥物治療的療效果。將納米顆粒運送到肺部,并負載適當的治療藥物和結合智能功能可以克服多種肺部障礙,有助于靶向目標組織和提高治療效果,同時最大限度地減少全身副作用。此外,COVID-19作為一種新型高傳染性呼吸道感染疾病正在全球范圍內蔓延。然而,目前還沒有針對COVID-19的特效藥。一些國家正在進行臨床實驗以開發抗病毒藥物或疫苗。近年來,納米技術為改善疾病的診斷和治療提供了一個可行的策略,基于納米技術的策略也在COVID-19的診斷和治療領域中表現出了廣闊的前景。2)作者在文中綜述了近年來基于納米技術的肺部給藥策略的最新研究進展,并介紹了納米藥物在肺部給藥策略中的臨床應用價值。
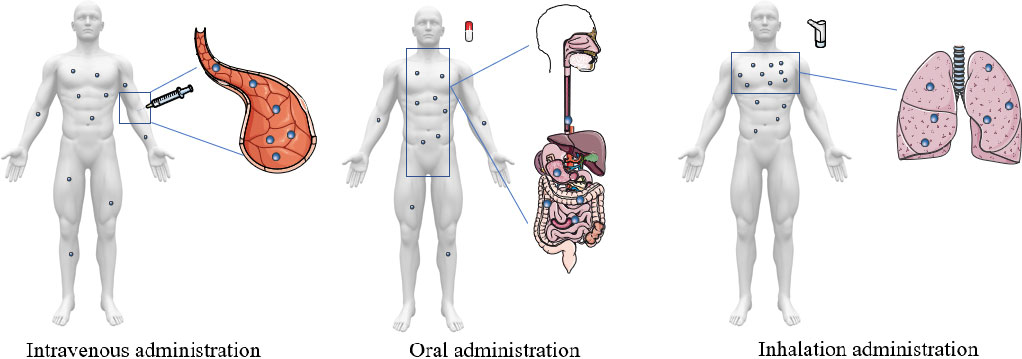
Wenhao Zhong. et al. Recent applications and strategies in nanotechnology for lung diseases. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3180-36. Nano Research綜述:可作為新型高效抗菌制劑的過渡金屬硫化物山東大學王鳳龍教授、蔣妍彥教授和濟南口腔醫院尹貽鑫博士對可作為新型高效抗菌制劑的過渡金屬硫化物相關研究進行了綜述。1)全球每年有數百萬人死于與微生物感染相關的疾病。更可怕的是,由于抗生素的過度使用,人們也必須要與細菌變異進行斗爭。超級細菌的出現將是一個棘手的環境和健康危害。因此,開發新型可行的抗菌方法對于維持人類社會的繁榮發展而言至關重要。近年來的研究表明,過渡金屬硫化物(TMSs)具有良好的抗菌性能和生物相容性、較高的太陽能利用效率和良好的光熱轉換特性,其在殺菌應用方面也表現出了重要的應用潛力,全面綜述該領域的最新進展將有利于未來的發展。2)作者在文中首先介紹了TMSs的抑菌機制,并系統地總結了通過TMSs材料工程策略以提高其抗菌性能的最新研究進展,討論了基于TMSs的抗菌平臺的實際應用場景;最后,作者在全面綜述和分析的基礎上重點討論該領域所面臨的挑戰和未來的發展趨勢。
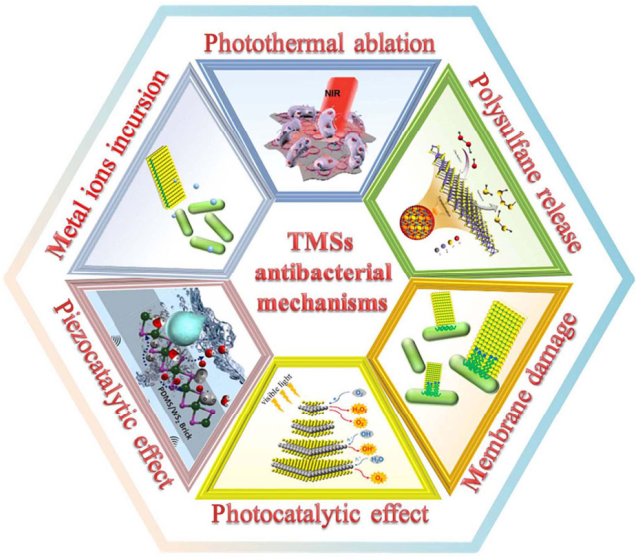
Hecheng Han. et al. Shining light on transition metal sulfides: New choices as highly efficient antibacterial agents. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-021-3293-37. Nano Research綜述:基于納米材料的抗菌應用策略中國海洋大學何治宇教授和于良民教授對基于納米材料的抗菌應用策略研究進行了綜述。1)微生物對傳統抗生素的耐藥性是實現傳染病的有效治療所面臨的一個巨大挑戰,也是一項重大的全球性威脅。因此,有必要開發創新的治療方法以克服耐藥性。近年來,基于納米材料的抗菌策略已發展成為對抗致命細菌和頑固性生物膜的新型工具,并具有逃避現有耐藥相關機制的能力。2)作者在文中全面總結了目前最先進的抗菌納米系統的研究進展,這些納米系統既可以作為固有的抗菌療法,也可以作為精確遞送抗生素的納米載體。這些納米系統能夠有效地聚集在感染部位,以實現多功能協同抗菌,并在內源性或外源性刺激(如低pH值、酶或光照)下實現抗生素的可控釋放。此外,與光熱/光動力治療(PTT/PDT)相結合的納米平臺也可以增強對細菌的破壞作用和實現生物膜的穿透或消融。最后,作者也對基于納米顆粒的酶促殺菌和抗毒方法及其他相關機制進行了介紹,旨在進一步推動該領域的發展以造福公共衛生事業。
Yi Zhao. et al. Nanomaterial-based strategies in antimicrobial applications: Progress and perspectives. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3417-48. Nano Research:基于二維金屬卟啉單層的單原子催化劑用于常溫合成氨華中科技大學楊利明介紹和華南師范大學李國良研究員采用密度泛函理論(DFT)計算和四步高通量篩選,系統研究了錨定在二維擴展卟啉(PP)基底上的3d、4d和5d過渡金屬作為氮還原反應(NRR)電催化劑的催化性能。1)研究表明,四種新型的金屬卟啉(MPP, M = Zr, Nb, Hf和Re)單原子催化劑具有優異的催化性能(低起始電位,高穩定性和選擇性)。研究者通過綜合反應路徑研究發現,NRR在ZrPP(酶催化-連續混合路徑)、NbPP(連續路徑)、HfPP(酶催化-連續混合路徑)和RePP(遠端路徑)催化劑上的最大吉布斯自由能變化分別為0.38、0.41、0.53和0.53 eV。2)能帶結構、投射態密度和電荷/自旋分布表明,由于N2和MPP催化劑之間存在顯著的軌道雜化和電荷轉移,因此該催化劑具有較高的催化活性。綜上所述,該研究工作能夠進一步促進NRR電催化劑的實驗合成,并為實現在環境條件下將N2電化學轉化為NH3提供新的策略。
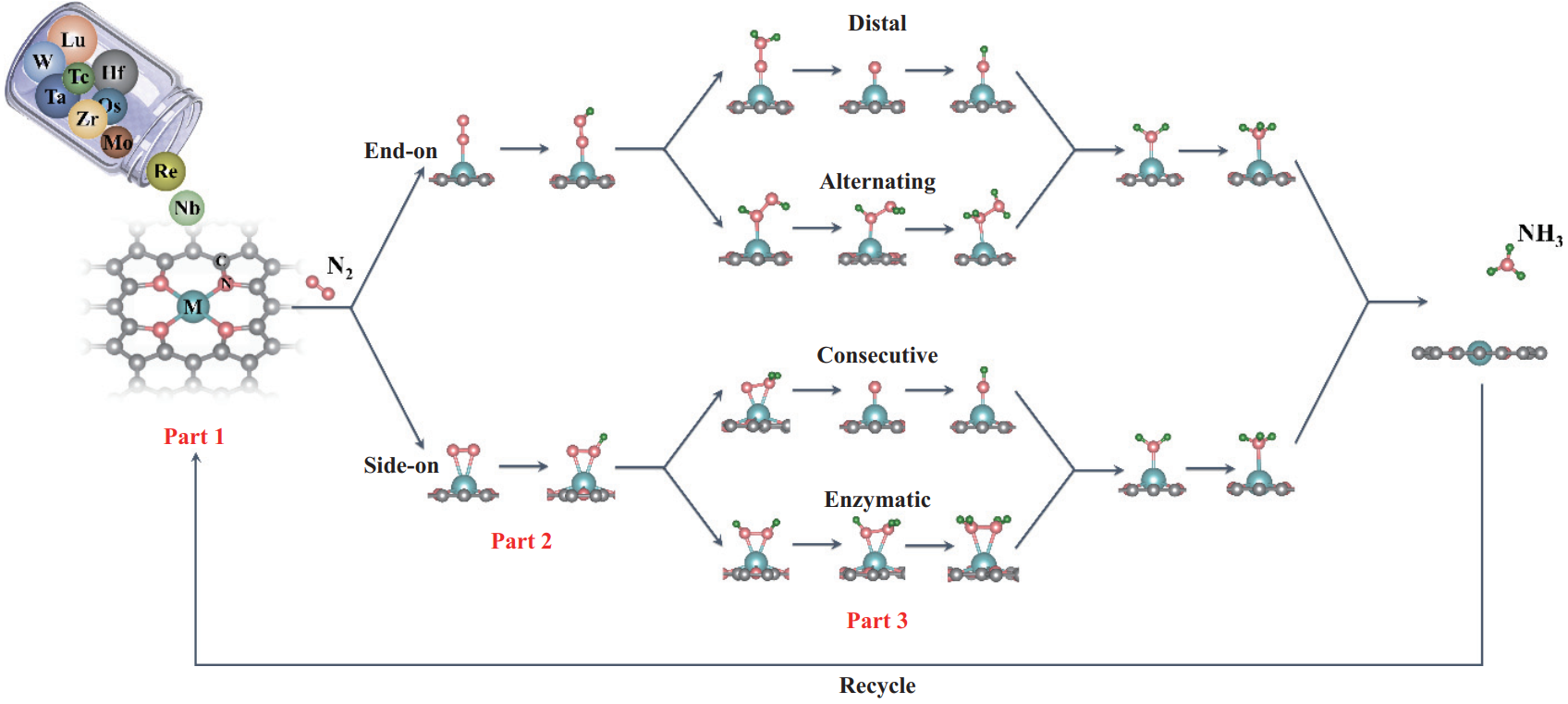
Chun-Xiang Huang. et al. Single-atom catalysts based on two-dimensional metalloporphyrin monolayers for ammonia synthesis under ambient conditions. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-4009-49. Nano Research綜述:靜電紡絲納米纖維制備的1D、2D和3D支架及其生物醫學應用中山大學杜健航研究員和吳鈞教授對靜電紡絲納米纖維制備的1D、2D和3D支架及其生物醫學應用研究進行了綜述。1)靜電紡絲是一種制備具有大的表面積、優越的物理和化學性能以及可控的孔徑的多孔納米纖維的有效方法。正是因為具有這些特性,靜電紡絲納米纖維可以模擬細胞外基質和一些人體組織結構。因此,靜電紡絲納米纖維能夠作為生物材料,例如二維(2D)傷口敷料和三維(3D)組織工程支架。納米纖維既可以是均勻的纖維鏈,也可以是同軸的藥物載體,其整體結構也包含隨機的網狀墊和對齊或傾斜的支架。此外,纖維的孔徑可以被調節,且纖維也能夠負載不同的藥物,進而實現不同的功能。2)作者在文中綜述了由不同一維纖維組成的二維纖維墊和三維納米纖維支架,并介紹了它們在組織工程中的多種應用,重點介紹了它們在傷口愈合、血管新生和組織再生等領域的應用進展。
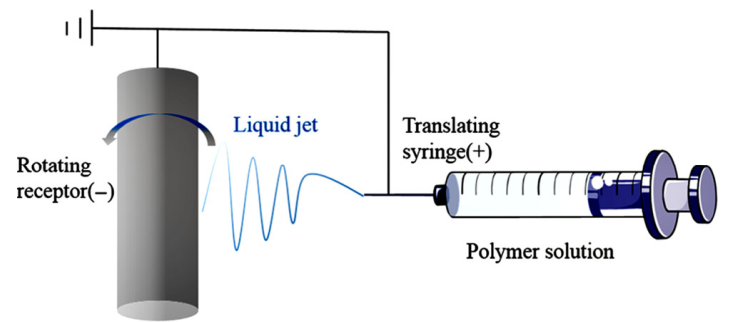
Huiling Zhong. et al. Electrospinning nanofibers to 1D, 2D, and 3D scaffolds and their biomedical applications. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3593-710. Nano Research:一種用于化療的分步多重刺激反應的金屬-酚網絡前藥納米顆粒化療是臨床治療腫瘤的主要手段之一。令人沮喪的是,大多數化療藥物(如阿霉素和紫杉醇(PTX))的水溶性差,導致其生物利用度較低,并會產生嚴重的副作用。迄今為止,雖然已有多種納米顆粒給藥系統能夠改善化療藥物的上述缺點,但由于制備復雜、穩定性差、載藥量低和藥物釋放過早等原因,其進一步的應用仍受到嚴重限制。有鑒于此,贛南醫學院黃啟同教授、鄺瑩博士和安徽醫科大學何曉燕副教授制備了一種穩定性好、載藥能力強、生物相容性高、能夠減少藥物過早釋放且具有強抗腫瘤性能的金屬-酚網絡給藥系統,以實現逐步的多重刺激響應給藥。1)實驗首先合成了具有氧化還原響應性的二聚紫杉醇(diPTX)前藥,并將Fe&TA網絡配合物快速沉積在diPTX納米核上,制備了具有良好PTX負載能力的diPTX@Fe&單寧酸(diPTX@Fe&TA)配合物納米粒子。diPTX@Fe&TA納米顆粒的水動力直徑為152.6±1.2 nm,具有長期的膠體穩定性,PTX負載量為24.7%。2)研究發現,diPTX@Fe&TA可以持續暴露于酸性溶酶體環境和還原細胞質環境中,導致其在被腫瘤細胞吞噬時連續釋放diPTX和PTX。與此同時,PTX在生理條件(pH 7.4)下則幾乎不會被釋放。實驗結果表明,diPTX@Fe&TA在體內能有效抑制腫瘤生長,并且其對正常器官產生的毒性極低。綜上所述,該工作能夠為構建具有良好穩定性和高載藥性能的逐步多重刺激響應給藥系統提供一種簡單而新穎的方法,以實現對腫瘤生長的有效抑制。
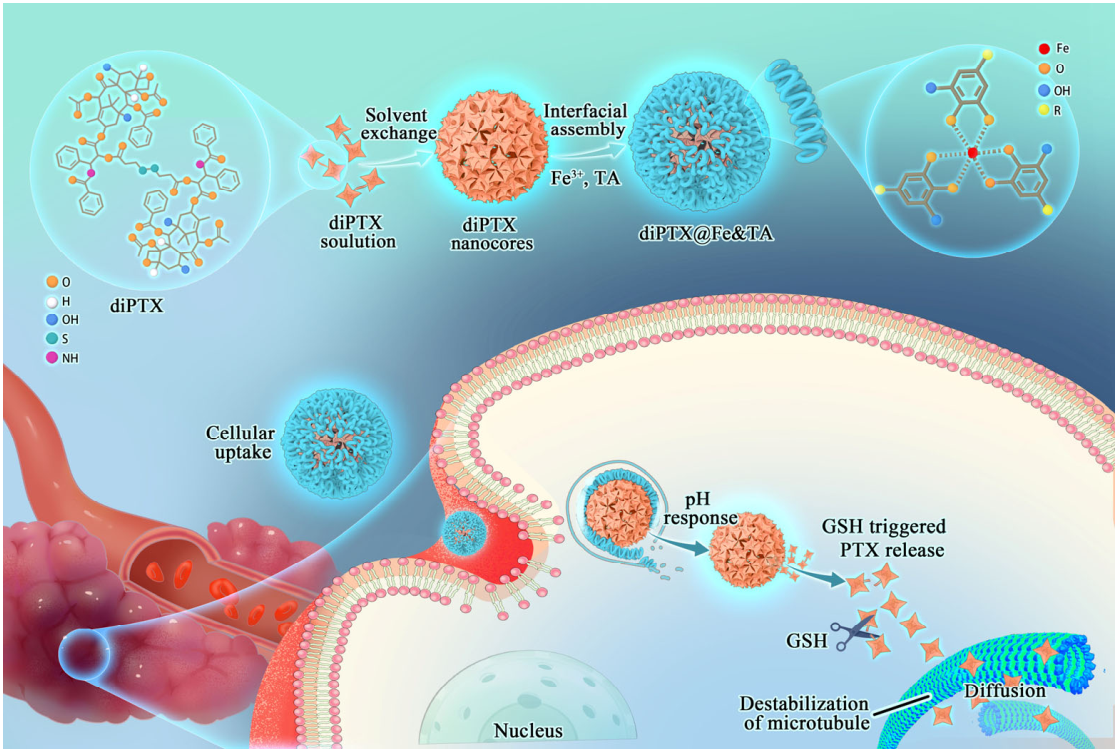
Xiaoqing Yi. et al. A step-by-step multiple stimuli-responsive metal-phenolic network prodrug nanoparticles for chemotherapy. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3626-211. Nano Research:提高摻Zn的Co3O4納米線陣列的鋅離子存儲能力以用于可穿戴水系可充電Co//Zn電池中性水系可充電的Co3O4//Zn電池具有高輸出電壓和出色的循環穩定性,能夠為開發可穿戴儲能設備提供新的思路。為了滿足對可穿戴和便攜式設備的供電需求,開發高性能纖維型Co//Zn電池是非常重要的。然而,Co3O4本身的導電性較差,嚴重制約了大容量、高倍率水系可充電的電池的應用。密度泛函理論(DFT)計算表明,利用Zn取代Co3+會導致Zn摻雜的Co3O4 (Zn-Co3O4)發生絕緣體-金屬轉變。有鑒于此,南京大學姚亞剛教授采用金屬Zn-Co3O4納米線陣列(NWAs)作為新型的無粘結劑陰極,成功制備了全固態纖維形水系可充電的(AFAR) Co//Zn電池。1)實驗構建的纖維型Co//Zn電池能夠充分利用Zn-Co3O4 NWAs的增強的導電性、提升的容量和倍率能力,其在0.5 mA·cm?2的電流密度下能夠產生1.25 mAh·cm?2的顯著容量,具有優異的倍率能力(在20 mA·cm?2的高電流密度下保持60.8%的容量)和高能量密度(772.6 mWh·cm?3)。2)綜上所述,該研究構建的Zn-Co3O4 NWAs能夠為開發高容量、高倍率的水系可充電高壓電池正極材料提供重要的見解和幫助。
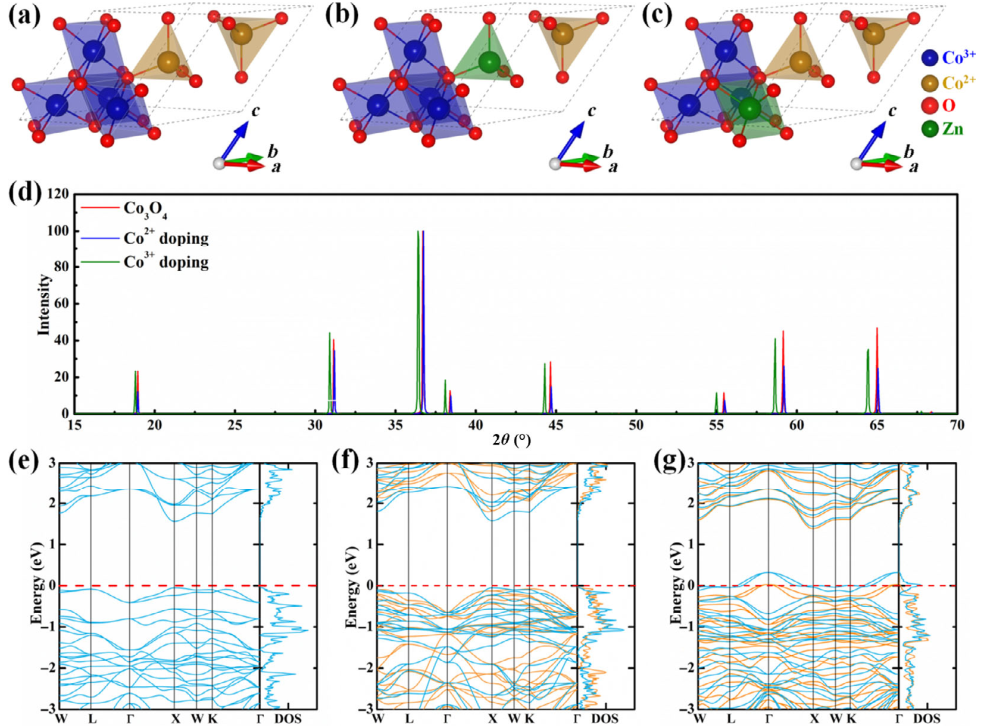
Qiulong Li. et al. Boosting Zn-ion storage capability of self-standing Zn-doped Co3O4 nanowire array as advanced cathodes for high-performance wearable aqueous rechargeable Co//Zn batteries. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3046-812. Nano Research:對腫瘤響應的銅激活雙硫侖用于協同納米催化腫瘤治療探索傳統藥物在不同疾病模型中的生物醫學應用非常重要,其能夠降低藥物開發成本,并克服傳統化學藥物的關鍵性問題,如化療效率低、副作用嚴重和耐藥性等。雙硫侖(DSF)是一種臨床批準的抗酒精藥物。最近的研究表明,將DSF與Cu2+共給藥能夠實現對腫瘤生長的抑制。然而,直接的給藥方式往往會引起嚴重的毒副作用,其主要原因在于腫瘤中的Cu2+濃度較低和非特異性的Cu2+分布所誘導的細胞毒性。基于納米尺度金屬有機骨架(MOFs)的藥物遞送性能,溫州醫科大學王佰亮研究員、上海大學陳雨教授和中科院上海硅酸鹽研究所霍敏鋒研究員構建了HKUST nMOFs,并將其作為自供Cu2+的納米載體,以用于有效遞送DSF藥物。1)腫瘤微環境的弱酸性條件會首先觸發HKUST nMOFs釋放Cu2+,以進一步與包封的DSF反應并形成毒性Cu(DDTC)2(活化物)以用于腫瘤化療。在Cu(DDTC)2絡合過程中,同時形成的Cu+會觸發瘤內的納米催化治療,進而產生活性氧以協同破壞腫瘤細胞/組織。2)實驗結果表明,DSF@HKUST納米藥物能夠實現協同的腫瘤響應性化療和納米催化治療,其在體內外具有良好的生物相容性和顯著的抗癌功效。綜上所述,該研究能夠為實現具高生物相容性、對腫瘤響應的“無毒-有毒”轉化癌癥治療提供新的參考。
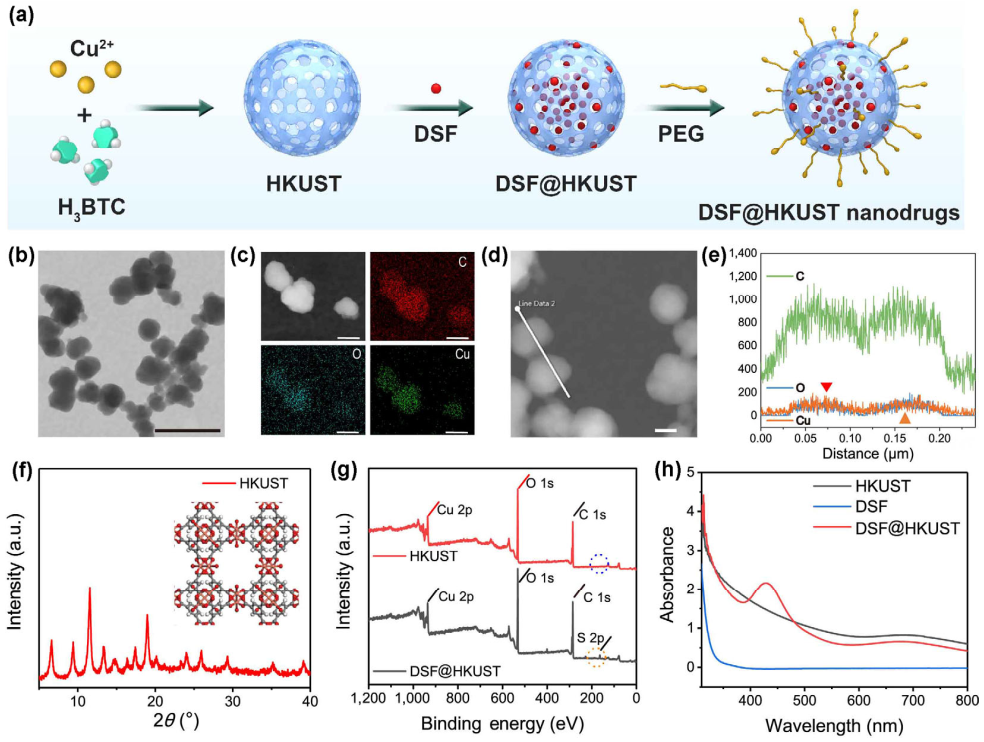
Hao Chen. et al. Tumor-responsive copper-activated disulfiram for synergetic nanocatalytic tumor therapy. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3069-113. Nano Research:多級雙孔羥基磷灰石摻雜的介孔二氧化硅納米顆粒支架用于促進體內外成骨具有良好的生物相容性和骨導電性的生物材料支架能夠用于治療大型骨缺損。昆士蘭大學Chun Xu和Saso Ivanovski構建了其具有多級的微孔(5 μm)和納米孔(6.4 nm)、羥基磷灰石-樹狀介孔二氧化硅納米顆粒(HA-DMSN)支架,并將其用于促進骨再生。1)體外研究表明,HA-DMSN支架具有良好的生物相容性,并能夠實現骨標記基因(骨鈣素基因(OCN)、骨橋蛋白基因(OPN)、I型膠原α 1基因(CoL1A1)、runt相關轉錄因子2基因(RUNX2)和整合素結合唾液蛋白基因(IBSP)的劑量依賴性上調,堿性磷酸化(ALP)活性和茜素紅染色結果也證明其具有增強的成骨應用潛力。2)體內研究表明,HA-DMSN支架能夠在大鼠顱骨缺損模型中顯著促進骨形成。綜上所述,該研究為骨組織工程提供了一種簡單易行的多孔無機支架材料。
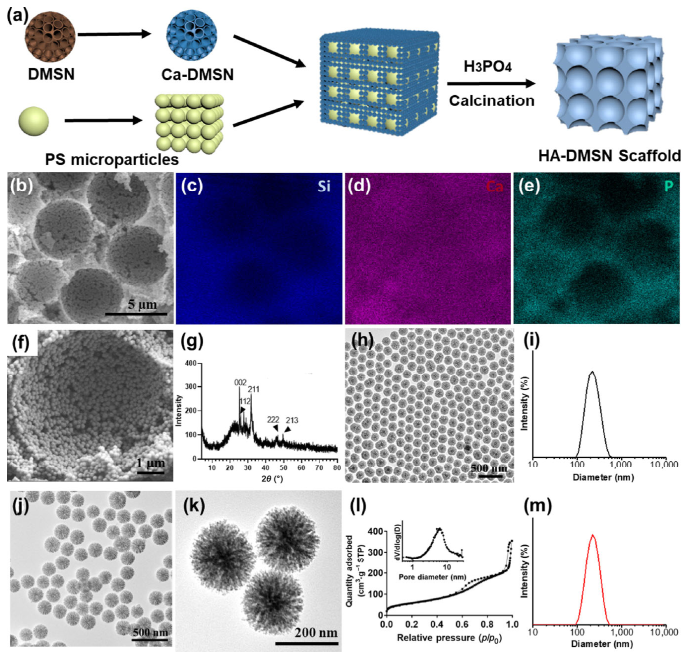
Chang Lei. et al. Hierarchical dual-porous hydroxyapatite doped dendriticmesoporous silica nanoparticles based scaffolds promote osteogenesis in vitro and in vivo. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3112-214. Nano Research:可電離的超分子樹狀分子納米系統用于安全有效的siRNA遞送利用小干擾RNA (siRNA)進行基因治療是治療多種疾病的一種新興方法。然而,如何實現安全高效的siRNA遞送仍然是siRNA治療臨床應用所面臨的主要障礙。法國馬賽跨學科納米研究中心彭玲教授通過將小的兩親性樹突分子進行自組裝構建了一種可電離的超分子樹狀分子載體,并將其作為一種安全有效的siRNA遞送系統。1)由于叔胺末端能夠電離,因此該超分子樹狀分子的表面正電位較低,其在生理pH條件下不會產生明顯的細胞毒性。與此同時,這種可電離的特性也使得該超分子樹狀分子能夠通過靜電相互作用與siRNA形成穩定的復合物。由此產生的siRNA/樹突分子遞送系統的表面電荷既非中性(可避免聚集),也不過高(避免產生細胞毒性),因此能夠實現siRNA的良好細胞攝取和內體釋放。2)在不同的癌細胞系和患者源性的癌癥類器官中進行的實驗結果表明,這種樹狀分子介導的siRNA遞送系統能夠有效地沉默致癌基因Myc和Akt2,具有強大的抗增殖作用,其效果也優于金標準載體Lipofectamine 2000。綜上所述,該研究構建的可電離的超分子樹狀分子是一種很有發展前景的siRNA遞送載體,能夠為拓展超分子化學在生物醫學中的應用提供新的借鑒。
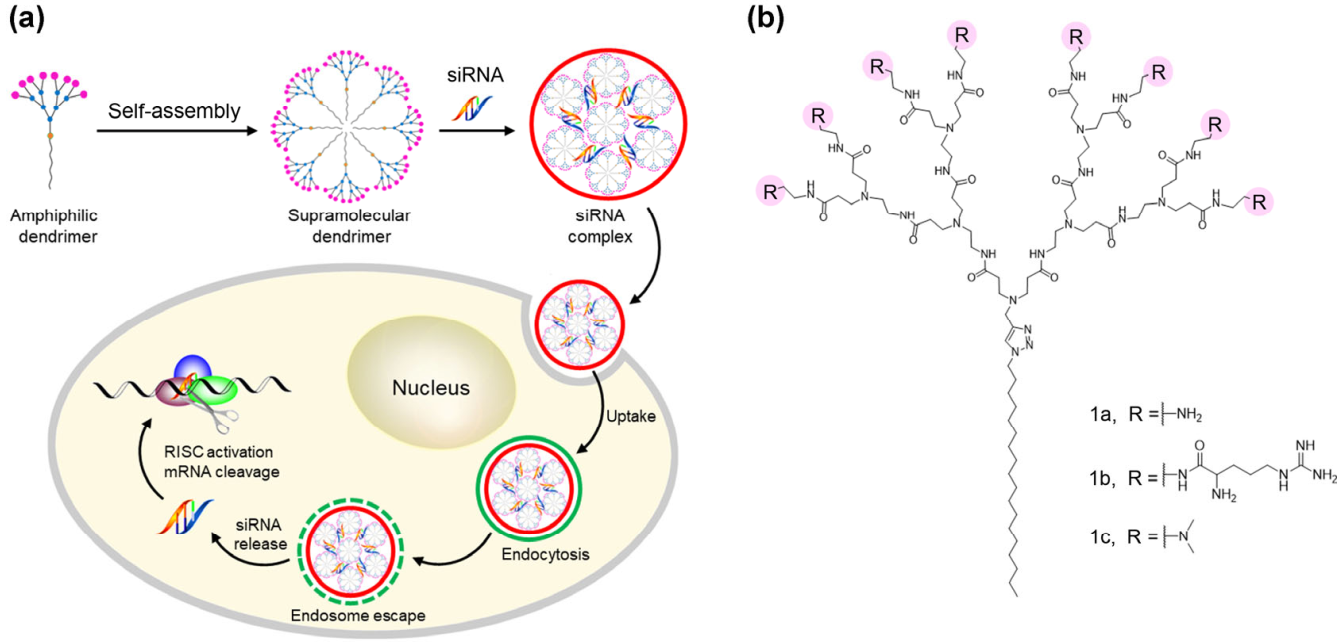
Dinesh Dhumal. et al. An ionizable supramolecular dendrimer nanosystem for effective siRNA delivery with a favorable safety profile. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3216-815. Nano Research:光觸發的核靶向癌癥藥物遞送香港大學汪衛平教授設計了一種能夠在時空控制下實現藥物納米顆粒的核靶向遞送的新策略。1)實驗通過將光響應前藥和游離藥物進行自組裝以制備了該納米粒子。通過在系統中加入核靶向序列,該藥物納米顆粒可以在可見光的照射下被遞送到細胞核中。2)實驗結果表明,該藥物納米顆粒具有較高的載藥能力和特異性核靶向性能,可有效殺傷癌細胞。綜上所述,該研究設計的自組裝策略有望應用于對其他疏水藥物和靶向配體以實現光控的細胞器靶向藥物遞送。
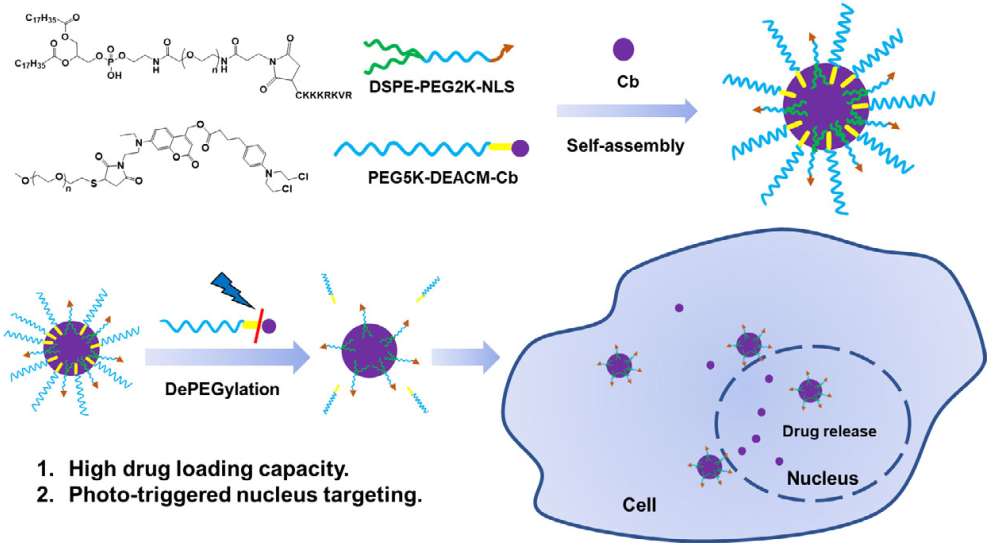
Yafei Li. et al. Photo-triggered nucleus targeting for cancer drug delivery. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3264-016. Nano Research:含對pH敏感的制劑的微針陣列貼片用于葡萄糖響應性胰島素遞送葡萄糖響應性胰島素遞送系統在改善糖尿病患者的治療結果和生活質量方面具有廣闊的前景。有鑒于此,華南理工大學杜金志研究員、浙江大學顧臻教授和中山大學林潤教授構建了一種新型的微針陣列貼片,其中含有對pH敏感、負載胰島素的納米顆粒(NPs) (SNP(I))以及負載葡萄糖氧化酶(GOx)和過氧化氫酶(CAT)、對 pH不敏感的NPs (iSNP(G+C)),可用于實現對葡萄糖響應的胰島素經皮遞送。1)SNP(I)是由對pH敏感的兩親性嵌段共聚物通過雙乳液制備的。在高血糖條件下,iSNP(G+C)中的GOx 會誘導弱酸性環境,使得SNP(I)快速解離以促進胰島素的釋放。2)此外,iSNP(G+C)中的CAT也可以進一步消耗GOx氧化過程中所產生的過量H2O2,從而降低對正常皮膚的炎癥風險。在I型糖尿病小鼠體內研究結果表明,該微針遞送平臺可有效地將血糖水平長期調節在正常范圍內。
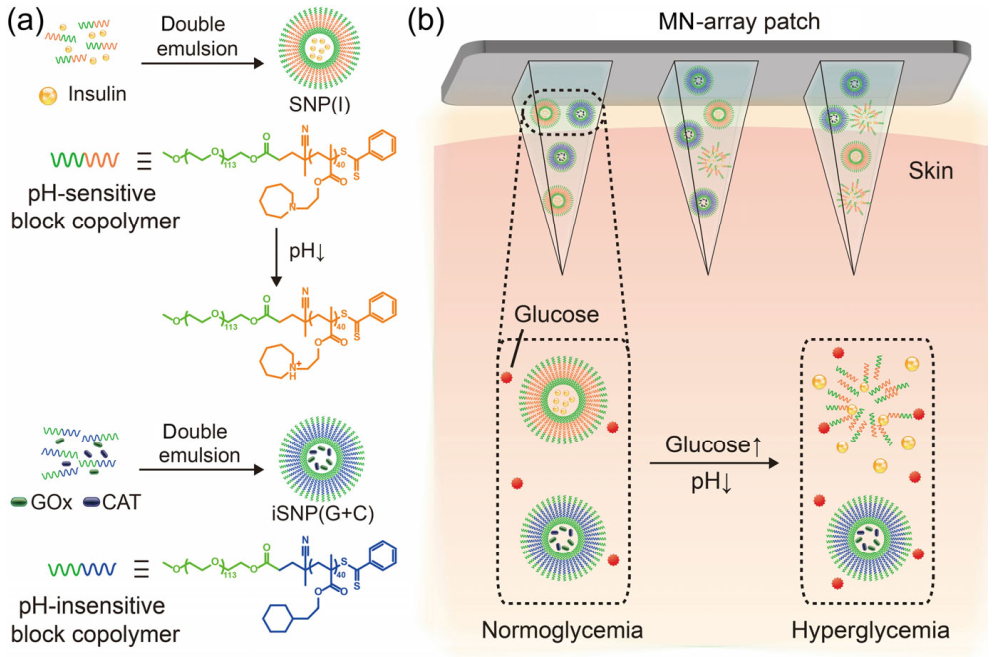
Feng-Qin Luo. et al. Microneedle-array patch with pH-sensitive formulation for glucose-responsive insulin delivery. Nano Research. 2020https://www.sciopen.com/article/10.1007/s12274-020-3273-z17. Nano Research綜述:對X射線敏感的high-Z金屬納米晶體用于癌癥成像和治療福州大學楊黃浩教授、宋繼彬教授和陳嵐嵐研究員對X射線敏感性high-Z金屬納米晶體用于癌癥成像和治療的相關研究進行了綜述。1)基于X射線照射的放射治療(RT)是臨床上廣泛應用的癌癥治療策略。然而,僅基于RT癌癥治療方法往往會導致輻射能量沉積不足,進而不可避免地對身體健康部位產生嚴重的副作用。研究表明,高原子序數(high-Z)金屬納米晶體能夠作為X射線增敏劑,其具有較高的x射線吸收能力,可有效降低輻射劑量,近年來也受到了越來越多的關注。high-Z金屬納米晶體可在X射線照射下產生俄歇電子和光電子,進而產生大量活性氧,誘導細胞損傷。已有研究發現,high-Z金屬納米晶體的敏化效果與其組成、形貌和尺寸密切相關,進而極大地影響其在癌癥成像和治療中的應用性能。2)作者在文中總結了不同類型的X射線增敏劑,主要包括鉍、鉿、金和釓在癌癥RT和成像中的應用;此外,作者也討論了基于high-Z金屬納米晶的RT技術目前所面臨的挑戰和未來的發展前景。
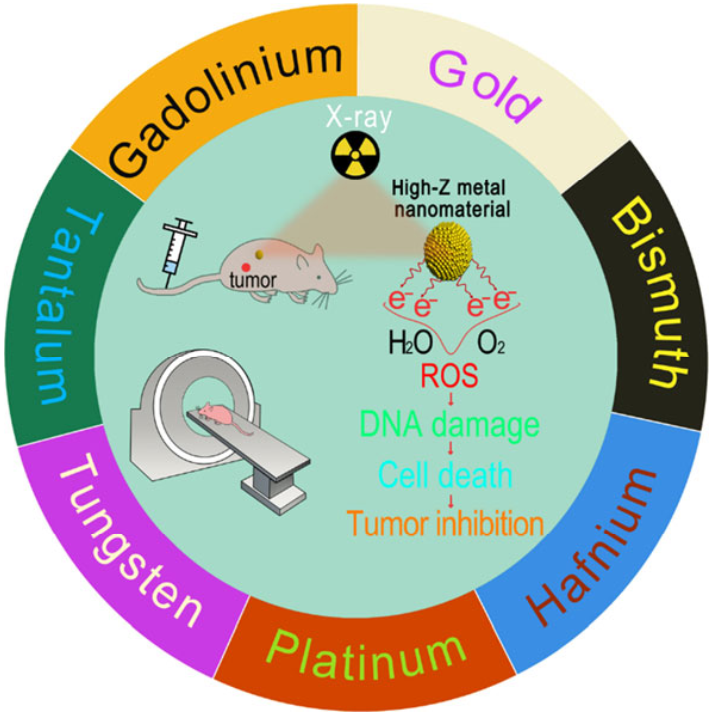
Liting Zheng. et al. X-ray sensitive high-Z metal nanocrystals for cancer imaging and therapy. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3337-818. Nano Research綜述:FluidFM在單細胞生物物理學中的應用蘇黎世聯邦理工學院Mi Li對FluidFM在單細胞生物物理學中的應用進行了綜述。1)流體力顯微鏡(FluidFM)是將原子力顯微鏡(AFM)與連接到壓力控制器的微通道懸臂相結合,能夠在水溶液條件下實現力敏感納米滴管的技術。研究表明,FluidFM在實現生物樣品的微/納米尺度三維操作和機械測量等方面具有獨特的優勢。在過去的十年內,FluidFM在生物物理分析特別是單細胞水平的研究中表現出了重要的潛力,有望為指導發現生命活動的潛在機制提供新的幫助。2)作者在文中回顧了利用FluidFM解決生命科學中的生物力學和生物物理問題的相關研究。首先,作者介紹了FluidFM的基本原理,并從單細胞操作、單細胞力譜學和單細胞電生理學等幾個方面綜述了FluidFM在單細胞水平生物物理學中的應用;最后,作者也對該領域的未來發展前景和面臨的挑戰進行了討論展望。
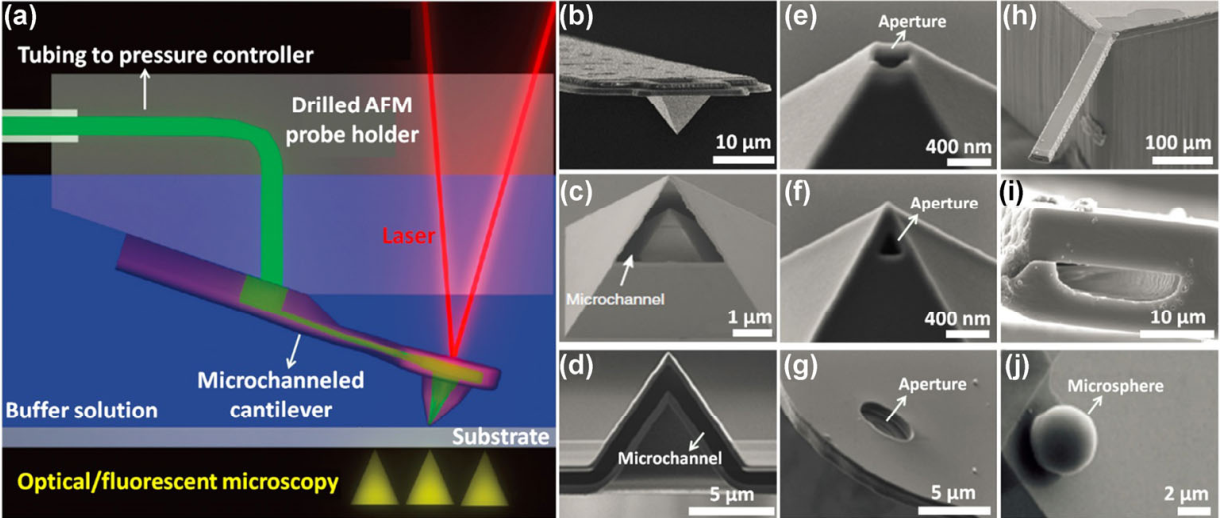
Mi Li. et al. FluidFM for single-cell biophysics. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3573-y19. Nano Research:具有增強的類過氧化物酶活性的Au@WSe2雜化納米結構用于葡萄糖比色檢測湖南大學蔡仁教授開發了一種基于金納米顆粒修飾的WSe2 (Au@WSe2)雜化納米結構的葡萄糖比色檢測方法。1)實驗通過在水溶液中將HAuCl4前驅體與WSe2納米片進行簡單地攪拌以合成了該雜化結構。由于Au納米顆粒和WSe2納米片之間具有很強的協同催化作用,因此Au@WSe2雜化納米結構能夠在H2O2氧化3,3 ',5,5 ' -四甲基聯苯胺時表現出增強的類過氧化物酶活性(比單獨的WSe2納米片高2倍左右)。2)基于其具有的高催化性能,研究者進一步將其與葡萄糖氧化酶(GOx)相結合,設計了能夠實現對葡萄糖進行靈敏的比色檢測的方法,該方法對葡萄糖的檢測限為3.66 μM。實驗結果表明,該研究設計的檢測方法能夠用于對血清中的葡萄糖進行檢測,其在生物醫學領域中具有廣闊的應用前景。
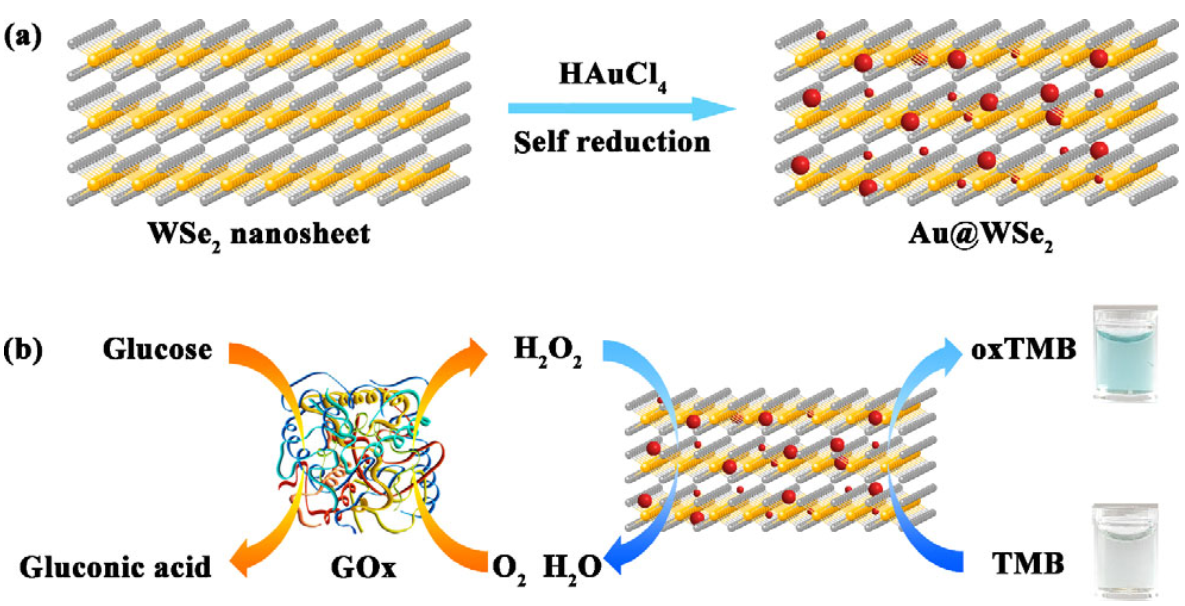
Chengyi Hong. et al. Green synthesis of Au@WSe2 hybrid nanostructures with the enhanced peroxidase-like activity for sensitive colorimetric detection of glucose. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3706-320. Nano Research:細胞在微-納米圖案上的臨界粘附區域細胞對細胞外基質(ECM)的粘附在生理和病理過程中以及在生物醫學和生物技術的應用等方面至關重要。已有研究表明,細胞只能粘附在一個臨界大小的粘性微島上。但目前還沒有關于細胞在納米陣列修飾的微島上的臨界粘附區域的研究。有鑒于此,復旦大學丁建東教授制備了一系列具有不同的微島尺寸和精氨酸-甘氨酸-天冬氨酸(RGD)納米間距的微-納米圖案。1)除了證明RGD的納米間距會顯著影響細胞在生物活性納米陣列上的特異性粘附外,研究者也證實了最初在細胞微圖案研究中所提出的臨界粘附面積的概念也適用于微-納米圖案,并且后者會表現出更多的細胞粘附特征行為。2)研究發現,隨著RGD納米間距的增加,人間充質干細胞(hMSCs)在納米陣列微島上的臨界粘附區域也會增加。然而,納米點的數量相對于臨界粘附區域而言并不是一個常數。在結合了非特異性背景黏附和特異性細胞黏附后,研究者提出了統一的解釋。隨后,實驗進一步對一系列微-納米圖案的表面進行了漸近分析,進而得到了在密集接枝RGD的無圖案表面上的有效RGD納米間距。該間距估計為非零,其在缺少微-納米圖案技術和相應分析手段的幫助下還尚未被揭示過。
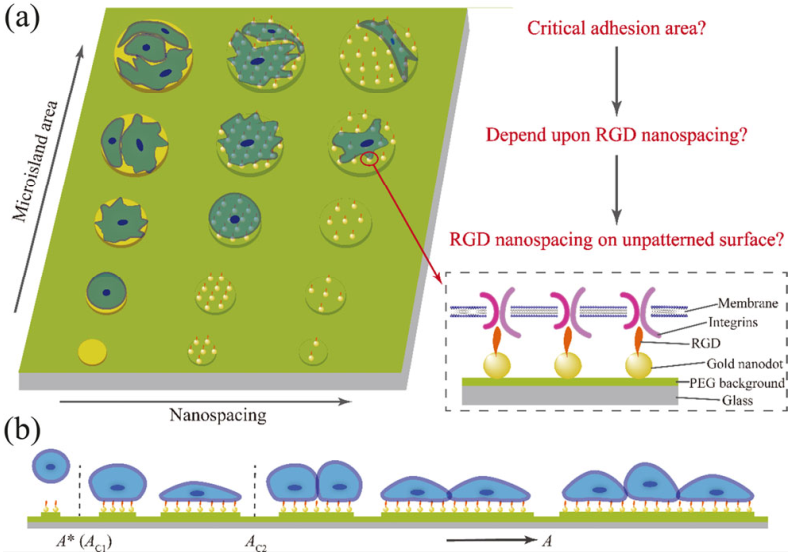
Shuang Zheng. et al. Critical adhesion areas of cells on micro-nanopatterns. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3711-621. Nano Research:正交模塊化生物合成納米結合疫苗以作為抗感染疫苗結合疫苗是控制細菌性疾病發生的最有效手段之一。雖然納米技術已在疫苗領域得到了廣泛的應用,但由于實現多糖與納米載體之間的連接非常困難,因此納米技術還很少被用于結合疫苗的研究。軍事醫學科學院生物工程研究所朱力研究員、王恒樑研究員和潘超博士采用正交和模塊化生物合成方法,利用SpyTag/SpyCatcher系統構建了納米結合疫苗。1)當SpyTag/SpyCatcher系統與蛋白質糖基化技術相結合后,從費氏志賀氏菌2a中獲得的細菌O-多糖能夠以高生物相容性和可控的方式被偶聯到不同的病毒樣顆粒(VLPs)表面。研究表明,該納米結合疫苗具有優異的淋巴結靶向和體液免疫激活能力,并且能夠在小鼠模型中誘導產生有效的預防感染作用。2)實驗結果表明,天然多糖抗原可以很容易地與VLPs相連接,以制備得到高效的納米結合疫苗。綜上所述,該研究首次實現了基于VLPs的納米結合疫苗的高效制備,并且該策略也可以應用于開發多種致病性納米結合疫苗。
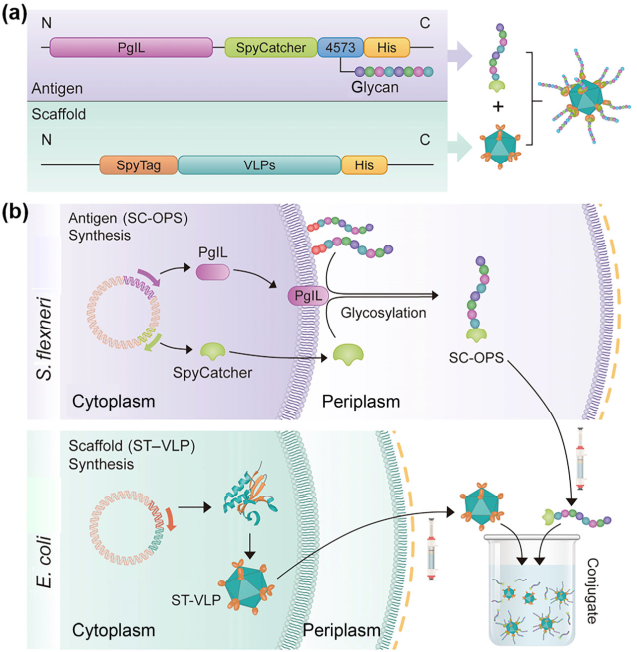
Xin Li. et al. Orthogonal modular biosynthesis of nanoscale conjugate vaccines for vaccination against infection. Nano Research. 2021https://www.sciopen.com/article/10.1007/s12274-021-3713-422. Nano Research:仿生銅單原子納米酶系統用于自增強型納米催化腫瘤治療具有類過氧化物酶(POD)活性的單原子納米酶(SAZs)具有良好的納米催化腫瘤治療(NCT)能力。然而,細胞中的過氧化氫(H2O2)和氫離子不足等問題也會嚴重限制其治療效果。為此解決這些挑戰,南方醫科大學李國新教授、安徽醫科大學王咸文教授和安徽工業大學吳孔林教授開發了一種仿生單原子納米酶系統以用于實現自增強型NCT。1)研究者首先使用先前已報道的方法制備了血小板膜囊泡,隨后采用高溫炭化方法成功合成了具有優良類POD活性的銅SAZs,最后通過物理擠壓將質子泵抑制劑(PPI;泮托拉唑鈉)和SAZs與血小板膜囊泡相結合以制備得到了PPS。在體內外實驗中,PPS能夠表現出良好的腫瘤靶向和積累能力。2)實驗結果表明,PPIs能夠同時調節腫瘤細胞中的氫離子、谷胱甘肽(GSH)和H2O2含量,顯著提高SAZs的催化能力,以實現自增強型NCT。體內研究結果表明,PPS對腫瘤的抑制率為>90%,并能夠從源頭上限制細胞中谷胱甘肽的合成。綜上所述,該研究能夠為將谷氨酰胺代謝療法和NCT相結合以實現腫瘤的多模式治療提供一種新的策略。
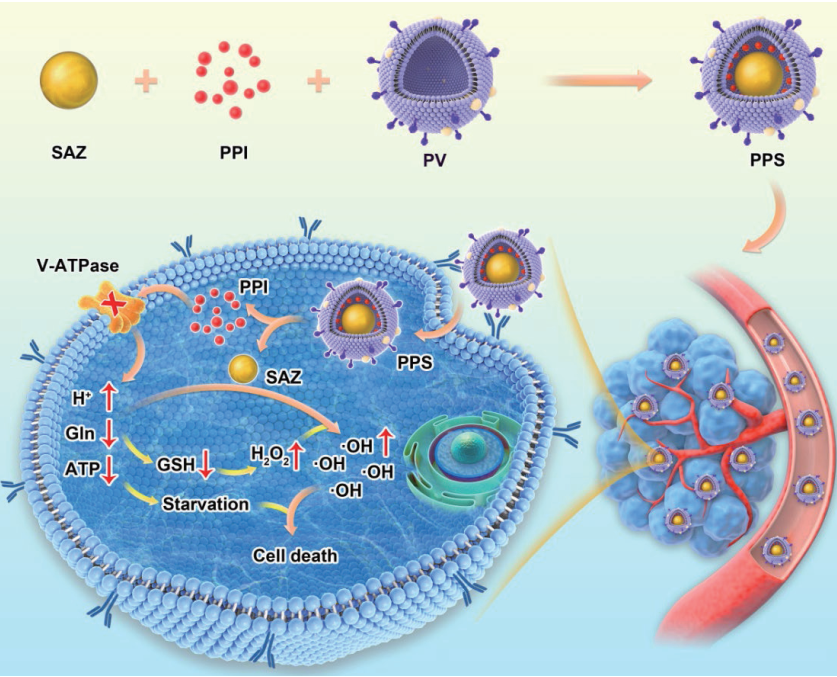
Daoming Zhu. et al. Biomimetic copper single-atom nanozyme system for self-enhanced nanocatalytic tumor therapy. Nano Research. 2022https://www.sciopen.com/article/10.1007/s12274-022-4359-6












































