我國中醫(yī)歷來有著以毒攻毒的治療理念,即通過辨證對于因毒邪引起的疾病, 應(yīng)用有毒藥物進行治療以消除毒邪。那從事醫(yī)學(xué)研究的各位,可曾有過一念利用病原體來“以毒攻毒”呢?其實細菌治療的概念早在就被提出,但選取合適的細菌攻擊感染細菌一直是個難題。細菌治療的應(yīng)用部位是影響菌種選擇的主要因素。理想情況下,所選細菌應(yīng)自然存在于要治療的器官中,以確保其存活并限制擴散到其他器官。例如,大腸桿菌Nissle 1917菌株被設(shè)計用于治療腸道中的銅綠假單胞菌感染,但它不能用于治療呼吸道感染。
而肺部感染,優(yōu)先想到的就是肺炎支原體為代表的肺部相關(guān)菌屬。與其他肺部致病菌相比,肺炎支原體在治療肺部感染方面具有以下優(yōu)點:(1)基因組小易于改造;(2)可以用現(xiàn)有的抗生素消除;(3)缺乏細胞壁,它不會引發(fā)強烈的炎癥反應(yīng);(4)其主要抗原和毒力因子特征明確;(5)肺炎支原體菌株的重組率可以忽略不計,從而降低了突變風(fēng)險;(6)它可以在合成的無血清培養(yǎng)基中生長,適合工業(yè)化生產(chǎn)。
近日,西班牙巴塞羅那科學(xué)技術(shù)研究所Luis Serrano與Maria Lluch-Senar教授領(lǐng)其團隊在Nature Biotechnology上發(fā)表了一項關(guān)于工程化的減毒型肺炎支原體M129菌株用于治療/預(yù)防由銅綠假單胞菌引起的感染性肺部疾病的工作。這是一種治療肺部感染的新方式,通過轉(zhuǎn)位將四個轉(zhuǎn)基因引入工程菌染色體中,以實現(xiàn)殺菌和生物膜降解活性。該工程菌株在小鼠模型中對急性銅綠假單胞菌肺部感染具有優(yōu)異的療效。具體機制即工程菌溶解呼吸機相關(guān)性肺炎患者氣管插管中形成的細菌生物膜,伴隨使用靶向肽聚糖層的抗生素以提高對革蘭氏陽性/陰性細菌的療效。

肺炎支原體菌株的選擇:
肺炎支原體野生型(WT)菌株在肺部14d左右被清除。通過去除致病基因來改進的肺炎支原體菌株。以下基因被認為是肺炎支原體發(fā)病機制的原因:編碼社區(qū)獲得性呼吸窘迫綜合征毒素的mpn372; 編碼具有細胞毒性核酸酶活性的脂蛋白的MPN133; 編碼P30粘附蛋白的mpn453和編碼甘油-3-磷酸脫氫酶/氧化酶的 mpn051。此外,在乳腺感染模型中,缺失mpn372和mpn133基因的肺炎支原體菌株(CV2菌株)在感染減弱。與WT菌株相比,mpn453缺失菌株在小鼠肺中形成集落顯著減少,這表明附著在上皮上對于維持肺中的肺炎支原體至關(guān)重要。因此,作為工程菌在肺清除和駐留之間的折衷,選擇了敲除mpn453和mpn051的CV2菌株作為肺部治療的載體,即該菌株缺失mpn372、mpn133、mpn453和mpn051基因。在2、4和14 d下CV2菌株的細菌計數(shù)與WT相似,表明mpn372和mpn133基因的缺失不會影響CV2在肺定植的能力。
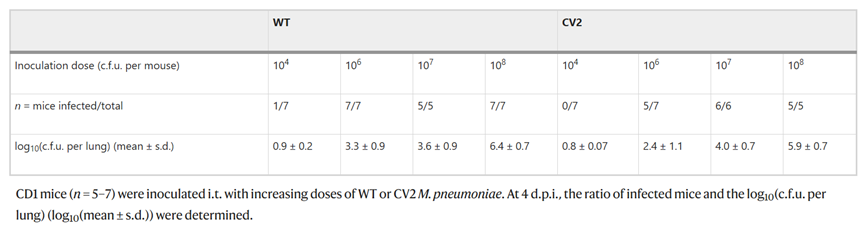
表 WT或CV2肺炎支原體肺部感染的菌落計數(shù)
CV2菌株誘導(dǎo)的肺部病變和炎癥反應(yīng):
進一步比較CV2和WT菌株誘導(dǎo)的感染反應(yīng),使用五個參數(shù)通過對三個主要肺葉的組織病理學(xué)分析來評估肺部病變:(1)支氣管周圍/支氣管周圍炎癥浸潤;(2)支氣管周圍/支氣管周圍炎性浸潤強度;(3)支氣管/細支氣管管腔滲出物強度;(4)血管周圍炎癥浸潤;(5)間質(zhì)性肺炎強度。基于這些參數(shù),構(gòu)成總分26分的肺部病變評價指標。在2d時,總分表明CV2小鼠的病變與WT感染組相比明顯較輕,支氣管和血管周圍炎癥較少,間質(zhì)炎癥也明顯減少。在14d時,CV2組與PBS對照組相比沒有顯著差異,而WT組有殘余的支氣管、血管周圍和間質(zhì)炎癥相關(guān)的組織損傷。在45d,分析表明CV2和WT給藥組的肺部病變均消退。綜上所述,與WT 肺炎支原體菌株相比,CV2在肺部的毒性減弱,這強調(diào)它是作為治療呼吸系統(tǒng)疾病載體的有力候選者。
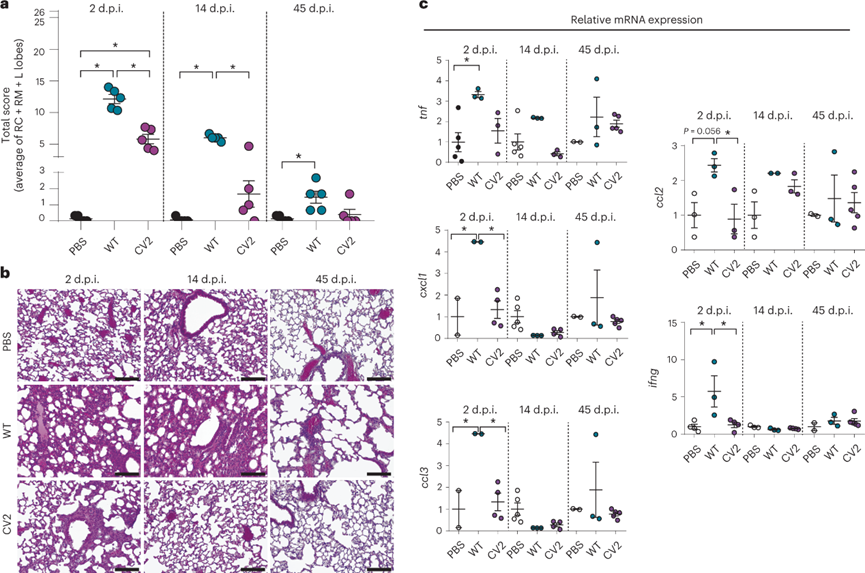
圖 感染肺炎支原體WT和CV2菌株的肺部組織病變和炎癥反應(yīng)
使CV2溶解銅綠假單胞菌生物膜:
銅綠假單胞菌生物膜是引起VAP的主要致病菌之一。由于銅綠假單胞菌生物膜主要由多糖Pel,PsI和藻酸鹽組成,使用表達靶向這三種多糖的三種不同酶的基因盒設(shè)計了WT菌株,期以可以降級生物膜。通過將糖苷水解酶PelAh64和 PslGh55和A1-II′ 海藻酸裂解酶融合到分泌肽(MPN142_OPT)上,構(gòu)建CV2_HA工程菌株。這種三種酶組合設(shè)計的肺炎支原體菌株對銅綠假單胞菌菌株SAT290和PAO1形成的生物膜表現(xiàn)出優(yōu)秀溶解效應(yīng)。在一組臨床獲取銅綠假單胞菌菌株中也證實了CV2_HA的抗生物膜活性。
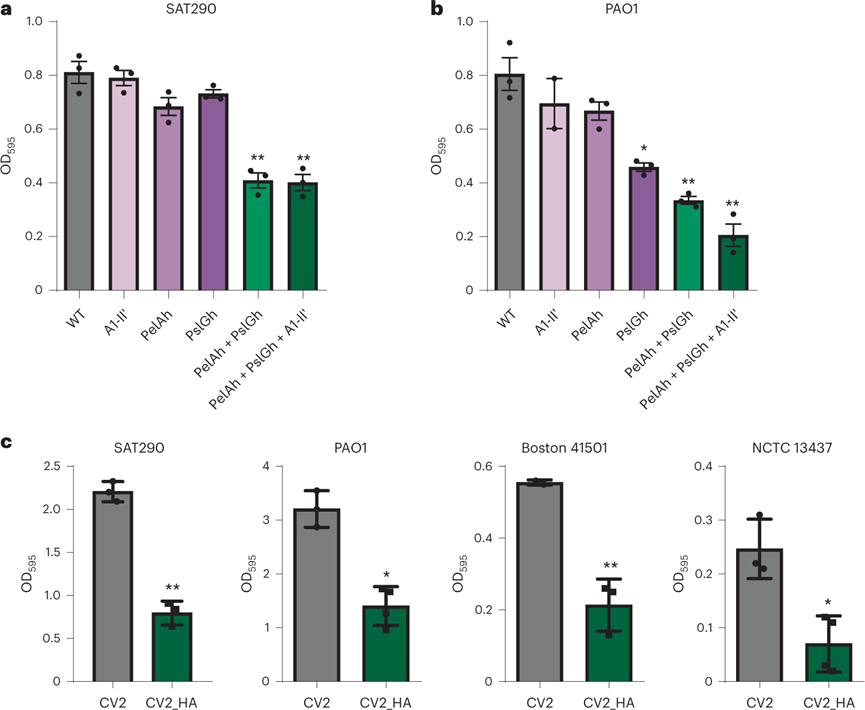
圖 肺炎支原體菌株的生物膜溶解活性
CV2_HA中引入抗菌活性:
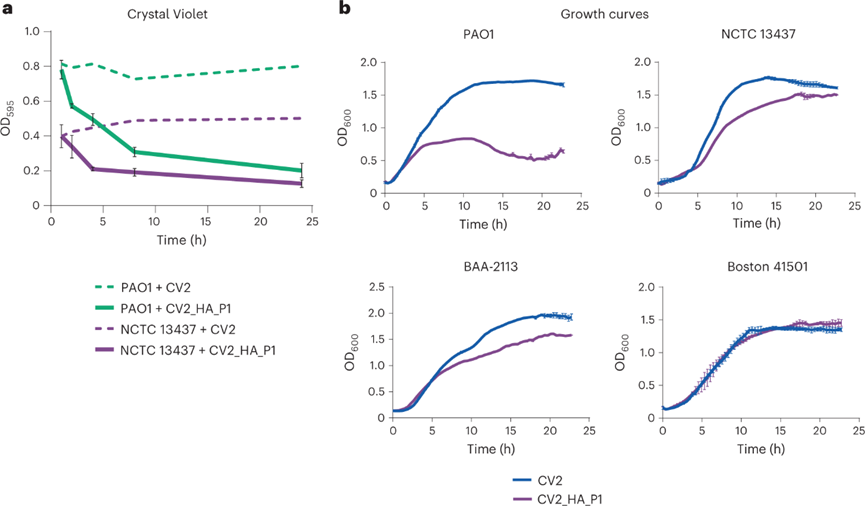
治療VAP的理想工程菌在結(jié)合生物膜溶解活性的基礎(chǔ)上還要實現(xiàn)抗菌。為了引入抗菌活性,設(shè)計了表達細菌素pyocin L1的CV2_HA(CV2_HA_P1),pyocin L1先前已被證明能殺死銅綠假單胞菌菌株。在確保改造后的工程菌依舊保留生物膜溶解活性后,驗證其抗菌能力。CV2_HA_P1抑制了PAO1菌株的生長,對NCTC13437和BAA-2113菌株表現(xiàn)出中等抗菌活性,但對波士頓41501菌株沒有作用。為了使抗菌譜多樣化,進一步促使表達pyocin S5,以補全對銅綠假單胞菌波士頓菌株的生長抑制。
CV2_HA_P1對VAP患者氣管插管的影響:
由于肺炎支原體缺乏細胞壁,推測它可以與針對細菌細胞壁肽聚糖的抗生素結(jié)合使用。評估臨床常用抗生素對肺炎支原體和不同銅綠假單胞菌菌株生長的影響。正如預(yù)期的那樣,針對細胞壁的抗生素難以殺死CV2_HA菌株,而所有抗生素對大多數(shù)銅綠假單胞菌菌株都有活性。值得注意的是,盡管抗生素沒有顯著溶解銅綠假單胞菌生物膜,但與CV2_HA_P1菌株一起孵育可有效溶解生物膜。
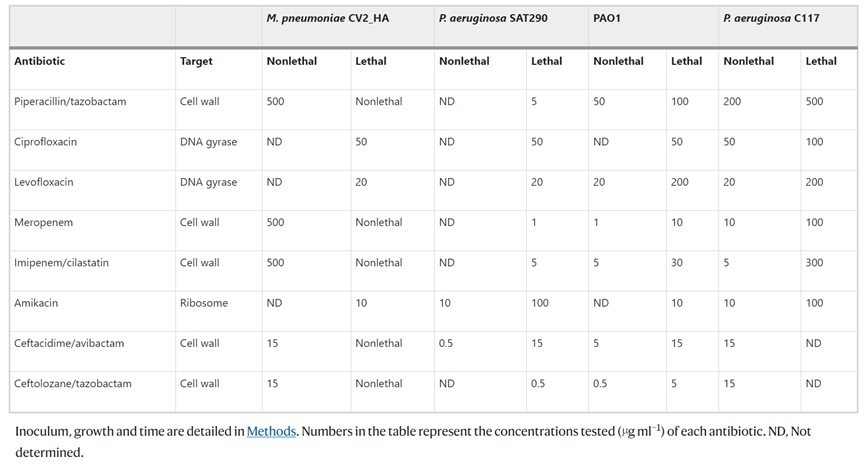
表 肺炎支原體和不同銅綠假單胞菌菌株對不同抗生素的敏感性
對ICU接受機械通氣的VAP患者的ETT切片進行處理,以評價工程菌對臨床銅綠假單胞菌作用效果。ETTs中的銅綠假單胞菌菌株(代表性)對美羅培南(100%)、亞胺培南(100%)、氨曲南(100%)、阿米卡星(66%)和環(huán)丙沙星(33%)具有耐藥性,但對粘菌素、哌拉西林/他唑巴坦、妥布霉素和頭孢他啶敏感。孵育24小時后,銅綠假單胞菌負荷在對照組和處理組之間顯示出顯著差異:用抗生素與CV2_HA_P1處理的ETT均降低了負荷,而聯(lián)合使用時這種減少更顯著甚至完全殺滅了細菌。這些結(jié)果表明,CV2_HA_P1對不同多重耐藥銅綠假單胞菌臨床菌株形成的生物膜具有廣譜活性。
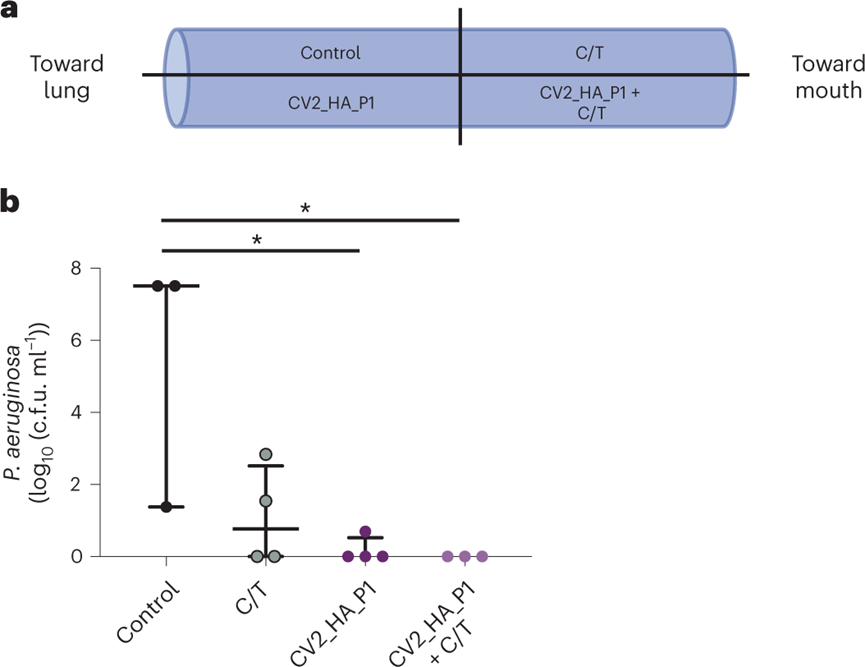
圖 VAP患者ETT生物膜的溶解
CV2_HA_P1在鼠肺感染模型中的療效:
使用PAO1建立小鼠急性肺部感染模型。每只小鼠接種1×103 c.f.u.的PAO1,并在接種后2 h給予CV2_HA_P1、CV2 或 PBS。在肺部檢測到CV2和CV2_HA_P1菌落形成,表明工程菌可以在致病細菌菌落優(yōu)勢下定植于肺部。PBS對照中PAO1的平均負荷為1×106 c.f.u./每克肺組織,用CV2_HA_P1 1×108處理的小鼠,肺部PAO1負荷顯著降低,而CV2在任何時候都沒有顯著降低肺部的PAO1負擔(dān)。肺部的組織病理學(xué)變化與PAO1負荷的減少一致,接受CV2_HA_P1治療的小鼠肺部肺部病變的總分顯著降低,血管周圍炎癥較少,實質(zhì)肺炎明顯減少。與CV2組相比,CV2_HA_P1小鼠肺部的炎癥標志物也減少。CV2_HA_P1治療減少了急性肺炎體內(nèi)模型中的PAO1肺部感染。大約50%感染PAO1并接受CV2_HA_P1治療的小鼠存活至8d,而用CV2或PBS對照治療的小鼠的中位存活率為2d。此外,存活到8d時間點的PAO1感染小鼠的組織學(xué)顯示,CV2_HA_P1組的肺改變明顯少于CV2或PBS對照組。CV2_HA_P1治療減少了PAO1肺部感染并提高了小鼠存活率。
使用工程菌和PAO1混合物接種小鼠以研究CV2_HA_P1對銅綠假單胞菌感染的預(yù)防能力。1×107CV2_HA_P1治療小鼠肺部的PAO1集落形成單位相比WT_HA_P1組和未處理組顯著減少。工程化的肺炎支原體菌株CV2_HA_P1在小鼠模型中有效預(yù)防急性PAO1感染。
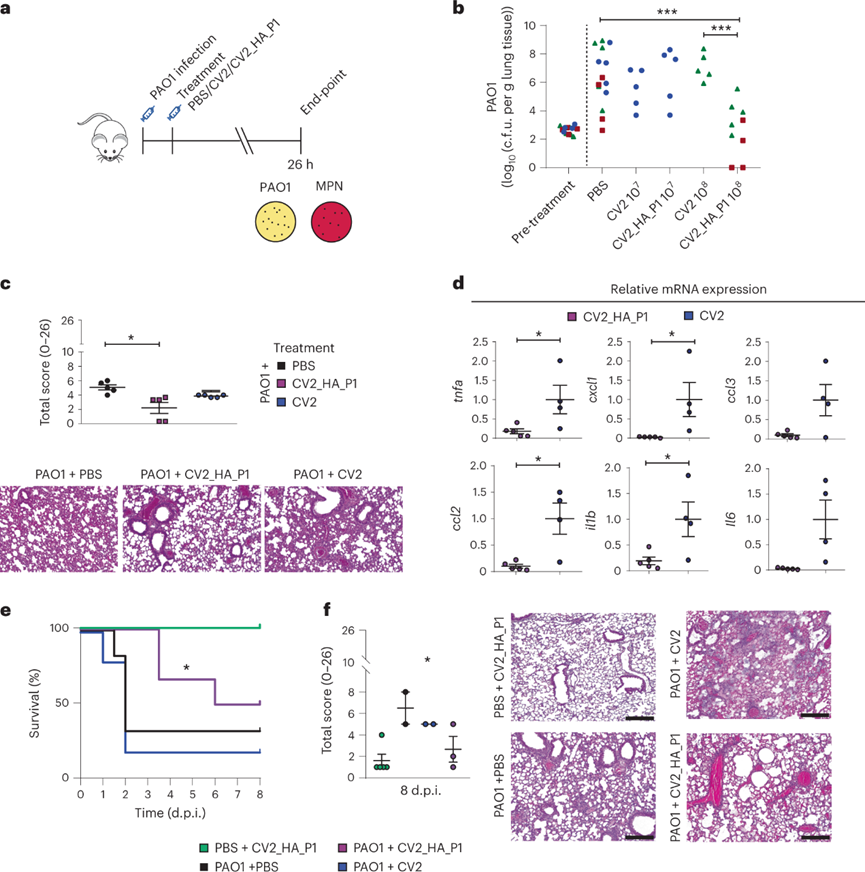
圖 TLR7-NP佐劑SARS-CoV-2刺突免疫誘導(dǎo)針對多種病毒變異株的交叉反應(yīng)抗體
小結(jié):
肺部感染現(xiàn)在仍然是人類死亡的主要原因之一。本研究采用肺炎支原體治療肺部細菌感染,實現(xiàn)了“以菌治菌”的概念。同歸屬于病原菌的工程菌載體,天然可以靶向肺部易于細菌感染的脆弱部位,同時實現(xiàn)感染部位的定植,實現(xiàn)長時間的分泌抗菌物質(zhì)實現(xiàn)治療效果。但這一理念的困境在于工程載體自身的毒性,難以保證安全性。作者團隊通過前置研究篩選出野生型肺炎支原體中的關(guān)鍵致病蛋白表達基因,在天然的低致病性肺炎支原體亞型(CV2)的基礎(chǔ)上改造。在成功降低了其致病毒性的同時,保留了其駐留肺部組織的能力。
在這種改造后的低毒性肺炎支原體工程菌株的基礎(chǔ)上進一步改造,可以有效拓展其應(yīng)用場景。針對銅綠假單胞菌細胞壁的多糖與海藻酸鹽成分,作者團隊引入并促使工程菌表達糖苷水解酶PelAh64和 PslGh55和A1-II′ 海藻酸裂解酶,實現(xiàn)了銅綠假單胞菌生物膜的溶解。結(jié)合生物膜溶解和抗菌活性來協(xié)同治療肺部耐藥菌治療,作者團隊進一步設(shè)計了肺炎支原體來表達活性pyocin L1和pyocin S5。兩種pyocins均對目標菌株具有抗菌活性和特異性。最終構(gòu)建的CV2_HA_P1工程菌株肺部顯示出對體內(nèi)銅綠假單胞菌生物膜的治療與預(yù)防作用,也可用于治療與其他細菌生物膜形成相關(guān)的呼吸系統(tǒng)疾病。該工程菌還可以補強標準護理抗生素的療效,CV2_HA_P1成功降解生物膜后有效促進了這些抗生素直接作用于耐藥菌菌體,這為協(xié)同組合開辟了道路。
參考文獻:
Rocco Mazzolini, Irene Rodríguez-Arce, Laia Fernández-Barat, et al. Engineered live bacteria suppress Pseudomonas aeruginosa infection in mouse lung and dissolve endotracheal-tube biofilms. Nat Biotechnol. 2023 Jan 19.
https://www.nature.com/articles/s41587-022-01584-9











