特別說明:本文由學研匯技術 中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。
研究背景
同時控制相鄰立體中心的通用立體選擇方法的開發對高效發現和生產新藥至關重要。對映體富集醇是一類重要的化合物,存在于無數的藥物制劑和生物活性天然產物中。將有機金屬親核試劑或氫化物試劑不對稱加成羰基的各種方法使具有單一立體中心的醇的高效和立體選擇性合成成為可能。
關鍵問題
1、具有兩個相鄰立體中心的醇的有效制備方法仍不發達具有兩個相鄰立體中心的醇的有效制備方法仍然相對不發達。特別是從簡單且容易獲得的前體合成具有α和β位立體中心的手性叔醇的方法很少,盡管這種結構基序經常存在于生物活性分子和藥物中。合成α, β手性叔醇的典型方法是對映純α-立體酮的非對映選擇性親核加成。然而,這些前驅體很難制備,且在羰基加成反應或儲存中可能會發生外消旋化。羰基的立體控制加成很難實現,并且結果難以預測。為了獲得合理水平的非對映選擇性,反應需要在低溫條件下與高堿性和親核有機金屬試劑(例如Mg或Li)進行,這限制了相容底物和官能團類型。4、未活化酮的動態動力學不對稱加成用于手性叔醇的一般合成仍未見報道羰基的動態動力學不對稱加氫已經得到了很好的研究,甚至每年在100噸以上的規模上進行,相比之下,動態動力學不對稱酮加成具有相鄰立體中心的手性叔醇的研究較少。目前,酮的DyKAT化學僅限于添加活化酮以形成復雜的乙醇酸鹽。
新思路
有鑒于此,中科院上海有機化學研究所施世良等人報告了一個平臺,通過對映聚合,鎳催化有機硼酸酯加成外消旋,非活化酮的制備。通過芳基和烯基親核試劑的動態動力學不對稱加成,一步制備了幾類重要的α,β手性叔醇,具有高水平的非對映選擇性和對映選擇性。作者應用這一方案來修飾幾種洛芬藥物,并快速合成生物學相關分子。期望這種鎳催化的無堿酮外消旋化過程能成為一種廣泛應用于動態動力學過程發展的策略。

作者開發了一系列C2對稱手性N-雜環卡賓(NHC),成功地將配體應用于幾種具有挑戰性的不對稱轉化,并推測Ni-ANIPE將是一種通用的、高選擇性的對映聚合sp2碳親核試劑加入外消旋的、非活化的酮類化合物的分析試劑。為了發展酮的對映收斂芳基化反應,作者經過對反應參數的廣泛考察,確定了最優的反應條件,并說明了Ni-NHC催化劑的重要作用。在優化后的反應條件下,探索了DyKAT反應中芳基硼組分的范圍以及調查了酮基底物的范圍。以外消旋芐基氨基酮和PhBneo為模型底物,重點研究了叔氨基醇的對映收斂合成。作者專注于將芳基化反應擴展到外旋體酮的對映收斂乙烯基化,發現這種動態動力學不對稱乙烯基化策略也適用于α-芳基酮,作者還探索了該方法在多種洛芬藥物合成中的應用。作者通過幾個對照實驗,明確DyKAT過程是一個完整的催化劑控制過程,芳基化是DyKAT發生的必要步驟。1、開發一種獨特的外消旋化反應范式,解決了“卡脖子”問題作者開發一種獨特的外消旋化反應范式,并使用一種非傳統的羰基激活模式,并明智地選擇手性配體,解決了非活化酮的對映收斂加成中長期存在的關鍵挑戰。通過芳基和烯基親核試劑的動態動力學不對稱加成,一步制備了幾類重要的α,β手性叔醇,具有高水平的非對映選擇性和對映選擇性。
技術細節
作者開發了一系列體積龐大但靈活的C2對稱手性N-雜環卡賓(NHC),成功地將配體應用于幾種具有挑戰性的不對稱轉化,包括高度對映選擇性的鎳催化酮與有機硼酸鹽的芳基化。酮羰基罕見的對映選擇性?2配位活化和隨后的類交叉偶聯機制是實現手性叔醇一般合成的關鍵。在無堿條件下,Ni-ANIPE配合物可以快速催化手性非活化酮[(R)-1b]的外消旋化過程。推測Ni-ANIPE將是一種通用的、高選擇性的對映聚合sp2碳親核試劑加入外消旋的、非活化的酮類化合物的分析試劑。
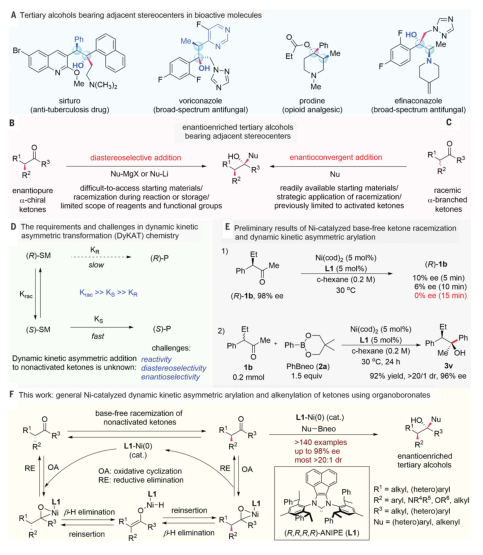
圖 生物活性叔醇的傳統非對映選擇加成合成及本工作的DyKAT策略為了發展酮的對映收斂芳基化反應,以氯咪唑和堿為配體,代替游離NHC,以2a和1a為模型底物進行了鎳催化劑的研究。經過對反應參數的廣泛考察,確定了最優的反應條件為1a(1.0 equiv),2a (1.5 equiv),5 mol %的Ni(cod)2和NHC (L1/HCl),10 mol %的NaOtBu,室溫(30℃),24小時。叔醇3a的定量收率為92% ee和>20:1 dr。沒有配體和鎳催化劑的對照實驗沒有反應,說明Ni-NHC催化劑的作用至關重要。
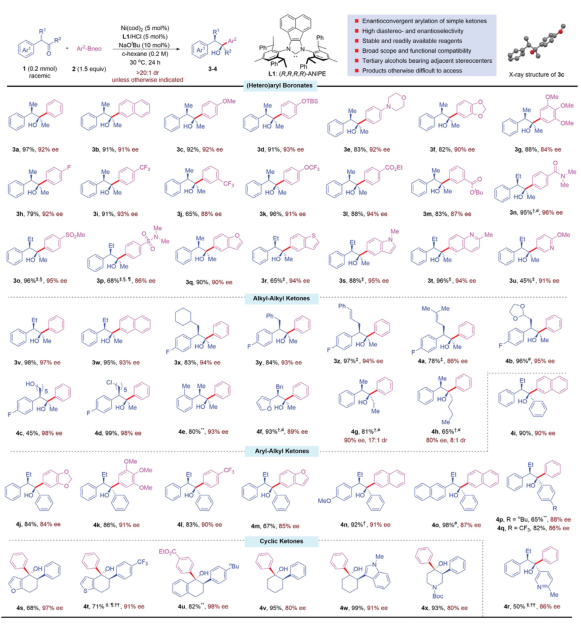
在優化后的反應條件下,首先探索了DyKAT反應中芳基硼組分的范圍。富電子和低電子的芳基硼酸鹽都容易發生芳基化反應,產生高產率和非對映和對映選擇性的叔醇。醚、硅醚、叔胺、氟、三氟甲基、三氟甲氧基、酯、酰胺、砜和磺胺等在芳基化反應中可以參與。芳基硼酯具有重要的藥學雜環,如苯并呋喃、苯并噻吩、吲哚、喹諾酮、嗎啉和吡啶等,都可以作為有效的底物,產生具有高非對映體和對映體選擇性的良好到極好的產量產品。隨后,調查了酮基底物的范圍。含有不同α取代基的酮——包括甲基、乙基、大體積環己基甲基、芐基、肉桂基和戊烯基——都能以高收率和高ee轉化為所需的叔醇。
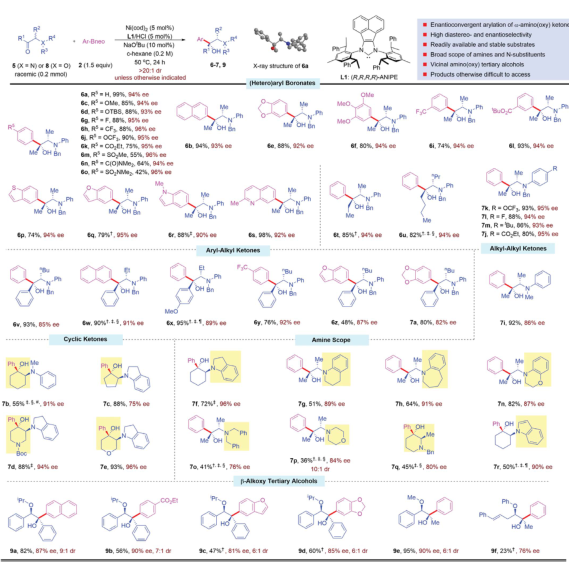
圖 鎳催化α-氨基酮或α-氧酮對映聚合芳基化的研究范圍以外消旋芐基(苯基)氨基酮和PhBneo為模型底物,重點研究了叔氨基醇的對映收斂合成。在快速篩選反應參數后,確定了最佳反應條件。首先研究了芳基硼偶聯物在對映聚合芳基化反應中的作用范圍。各種各樣的芳基硼酸酯具有給電子取代基和吸電子取代基,可以很容易地參與反應,提供了具有完全非對映控制的高產率和對映選擇性的鄰氨基叔醇。接下來檢查了外消旋α-氨基酮底物的范圍,具有較長烷基鏈的二烷基酮,如乙基和丁基,以同樣高的產率和選擇性生成叔氨基醇。作者發現在標準鎳催化條件下,市售外消旋苯甲酰異丙醚與幾種功能化芳基或異芳基硼酸鹽有效耦合,生成了具有良好的非對映和對映選擇性的復合β-烷氧基叔醇。
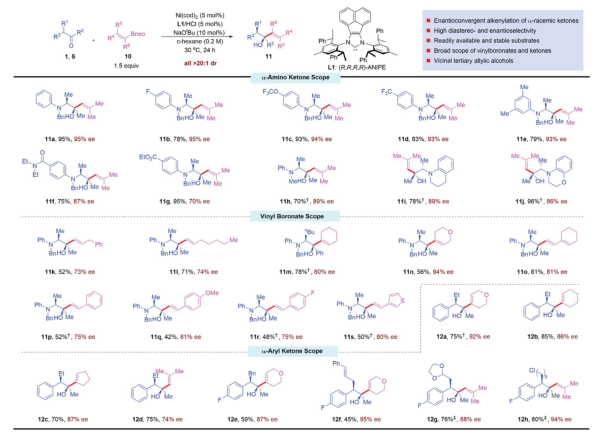
作者專注于將芳基化反應擴展到外旋體酮的對映收斂乙烯基化。發現,α-氨基酮與三取代烯烴硼酸酯之間的乙烯基化反應表現良好,以接近定量的產量生成近氨基叔烯丙基醇,ee為95%。這種動態動力學不對稱乙烯基化策略也適用于α-芳基酮,在74~95% ee和>20:1 dr的情況下產生許多手性叔烯丙基醇。作者還探索了該方法在多種洛芬藥物合成中的應用。
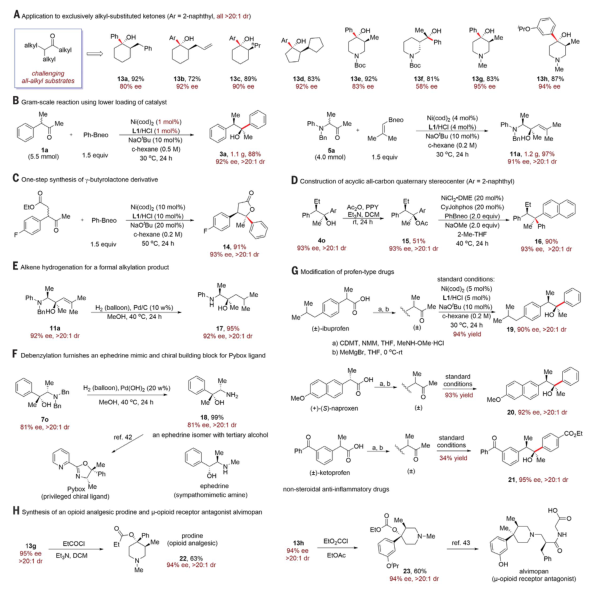
圖 DyKAT芳基化在烷基取代酮、合成精制和藥物修飾中的應用作者進行了幾個對照實驗,以深入了解DyKAT過程。結果表明該過程是一個完整的催化劑控制過程,外消旋作用比芳基化步驟快得多,而芳基化是DyKAT發生的必要步驟。基于作者的觀察,作者提出了一個催化循環過程。
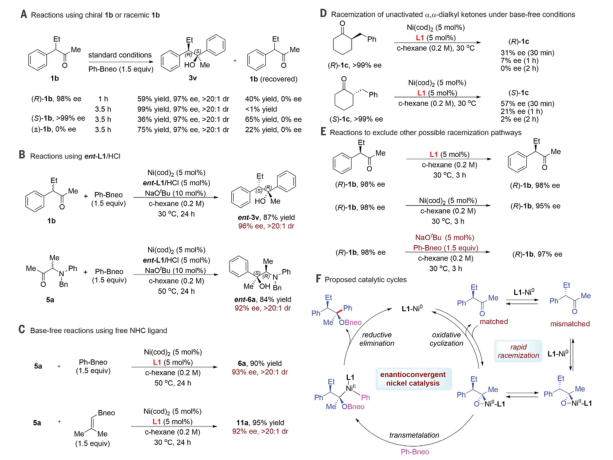
展望
總之,作者開發了一個通過對映聚合,鎳催化有機硼酸酯加成外消旋,非活化酮的制備的平臺。作者一步制備了幾類重要的α,β手性叔醇,并展示了其在藥物合成中的應用。除了該方法的直接應用外,我們預計Ni- NHC啟用的對映體收斂策略將刺激其他DyKAT過程的發展,以快速合成有價值的復雜靶標。LIN-XIN RUAN, et al. Dynamic kinetic asymmetric arylation and alkenylation of ketones. Science, 2023, 379(6633): 662-670.DOI: 10.1126/science.ade0760https://www.science.org/doi/10.1126/science.ade0760














