癌癥免疫治療徹底改變了腫瘤學的面貌。然而,患者對相同的免疫療法的反應往往不同。特別是,許多癌癥類型對檢查點阻斷治療的反應率仍然很低(黑色素瘤、腎細胞癌和結腸直腸癌的反應率為20-40%)。腫瘤濾過性白細胞(TIL)與癌癥進展和癌癥患者的臨床終點密切相關。特別是,臨床數據表明,M1巨噬細胞和細胞毒性T淋巴細胞(CTL)水平高與預后良好有關,而中性粒細胞-淋巴細胞比率升高則預示著癌癥患者的生存率較差。為了評估腫瘤免疫微環境(TIME)中的TIL,以便在癌癥免疫治療之前和期間對患者進行分層并預測結果,已使用流式細胞術、組織學染色和活檢腫瘤組織的質量細胞術。然而,活組織檢查是侵入性的和靜態的,可以導致轉移,并且只能揭示時間的區域信息;外周血分析不可避免地包含從腫瘤以外的組織分泌的生物標志物,限制了其對時間的特異性。
分子成像為整個時間的縱向監測提供了一種實時和非侵入性的技術。然而,包括計算機斷層掃描、正電子發射斷層掃描和磁共振成像在內的現有成像模式無法準確監測TIME中的TIL,因為它們依賴抗體或配體偶聯的造影劑來靶向感興趣的白細胞,并且它們的“常亮”信號不可避免地會因腫瘤以外組織中的非特異性滯留而加劇。相反,可激活分子光學探針僅在存在預期生物標志物的情況下提供信號,從而使背景噪聲最小化,并且可以提供隨生物標志物濃度和活性而定的定量信號。最近,可激活分子探針(AMPs)已被開發用于白細胞的實時成像;然而,由于它們的激活機制僅由淋巴細胞生物標志物決定,它們的信號可以由外周血或炎癥組織中的白細胞非特異性觸發。TIL的特定實時非侵入性成像仍然是一個挑戰。
鑒于此,南洋理工大學浦侃裔等人展示了串聯激活分子探針(TAMP)允許TIL的近紅外熒光(NIRF)實時成像,用于伴隨診斷和預測癌癥免疫治療的結果。

TAMP包括三個關鍵單元:腫瘤被動靶向部分、熒光信號部分和雙重鎖定的TIL響應部分,這些部分只有在腫瘤和白細胞生物標志物存在的情況下才能完全裂解。TAMP本質上是非熒光的,只有在腫瘤和淋巴細胞生物標志物存在的情況下才能激活其NIRF信號。這種“雙重鎖定”串聯設計確保信號激活僅由正常組織和其他炎癥組織中的TIL觸發,而不是由白細胞觸發。
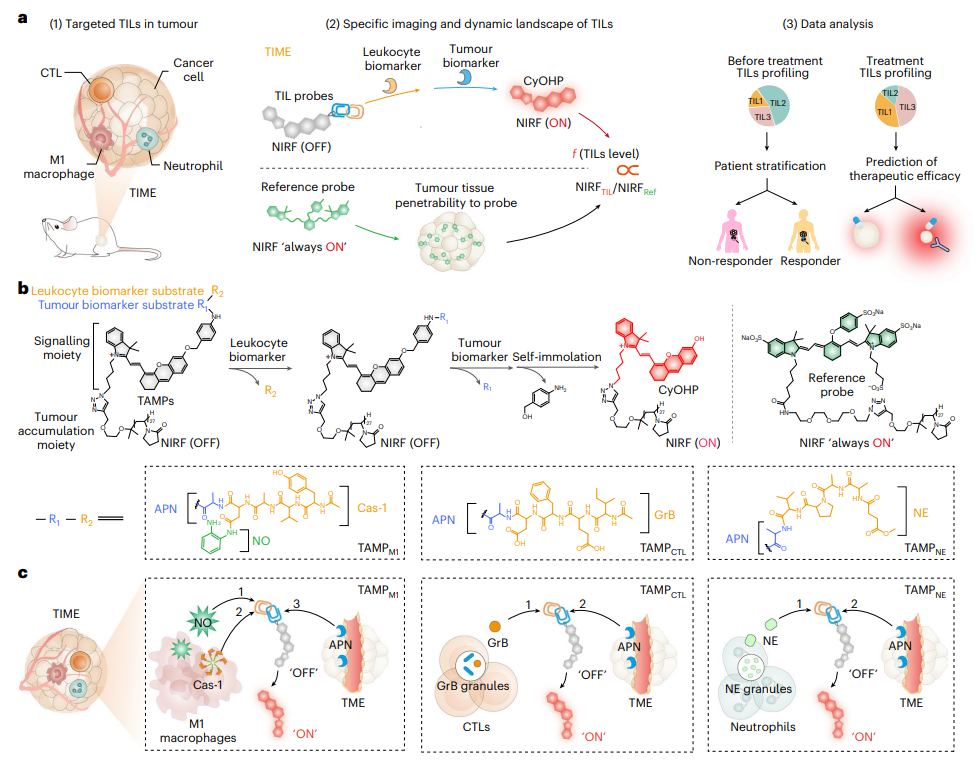
圖|用于TIL的特定分子光學成像的TAMP的設計和機制
研究人員合成了TAMPM1、TAMPCTL和TAMPNE,分別檢測M1巨噬細胞、CTL和中性粒細胞,用于時間的實時動態成像。為了排除腫瘤中TAMP的積累差異,研究人員使用聚乙烯吡咯烷酮IRDye 800(PVP-IR800)作為“常開”參考探針。此外,由于TAMP的高腎清除率,該探針可用于TIME的熒光尿液分析。
探針的熒光僅在存在腫瘤和白細胞生物標志物的情況下才被激活,這允許對癌癥小鼠模型中的特異性TIL群體進行成像,其敏感性和特異性類似于通過對活檢腫瘤組織的流式細胞術分析所實現的敏感性和特異性。
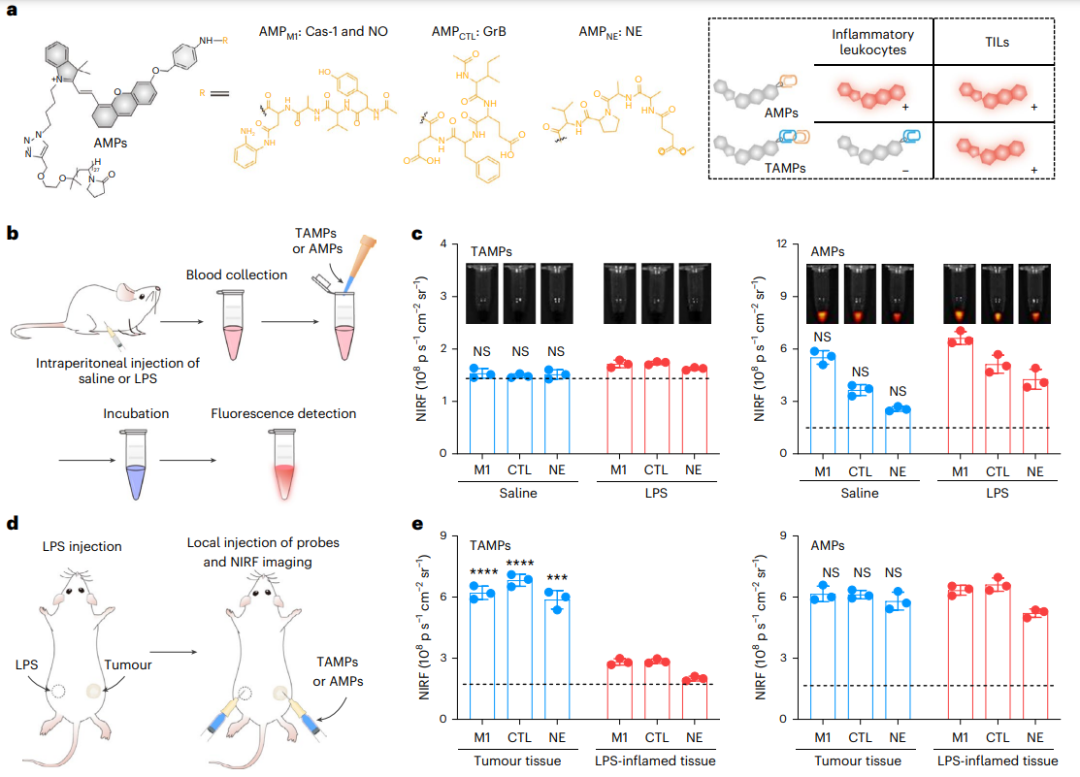
圖|TAMP與單鎖定AMP相比的優越性
這一系列的TAMP能夠實時分析TIL,為準確繪制腫瘤內免疫環境提供了一種非侵入性的方法。此外,TAMPs對TILs具有高度的特異性和敏感性,在腫瘤切片的免疫熒光染色中顯示與它們各自的TILs重疊超過70%,并且它們的R-NIRFs(R?≥0.73?0.74, ρ ≥?0.85)用流式細胞術測定TIL水平。TAMP的這種實時分析能力也在包括巨噬細胞和嗜中性粒細胞靶向治療在內的其他治療中得到驗證。因此,TAMP使能夠準確區分免疫原性差(4T1)和高免疫原性(CT26)腫瘤,并密切監測CTL的浸潤,巨噬細胞的極化和中性粒細胞的變化,以及不同療法的結果。
TAMP的高腎清除效率和熒光開啟反應為TIL的熒光尿液分析提供了一種方便的方法。與實時成像數據一致,排泄的TAMP的尿液R-NIRF準確地反映了其各自的TIL群體(R?≥?0.75, ρ?≥?0.87)。基于TAMP的尿液分析使能夠高精度地區分未治療的CT26腫瘤和未治療的4T1腫瘤,以及aPD-L1治療的CT26腫瘤和aPD-L1處理的4T1瘤。此外,在癌癥免疫治療早期,TAMPs的尿R-NIRFs預測了終點的相對腫瘤體積,其中TAMPM1和TAMPCTL呈負相關(R?≥?0.74, |ρ|?≥ 0.86),并且TAMPNE與相對腫瘤體積呈正相關(R?≥?0.89, ρ?≥?0.94)。
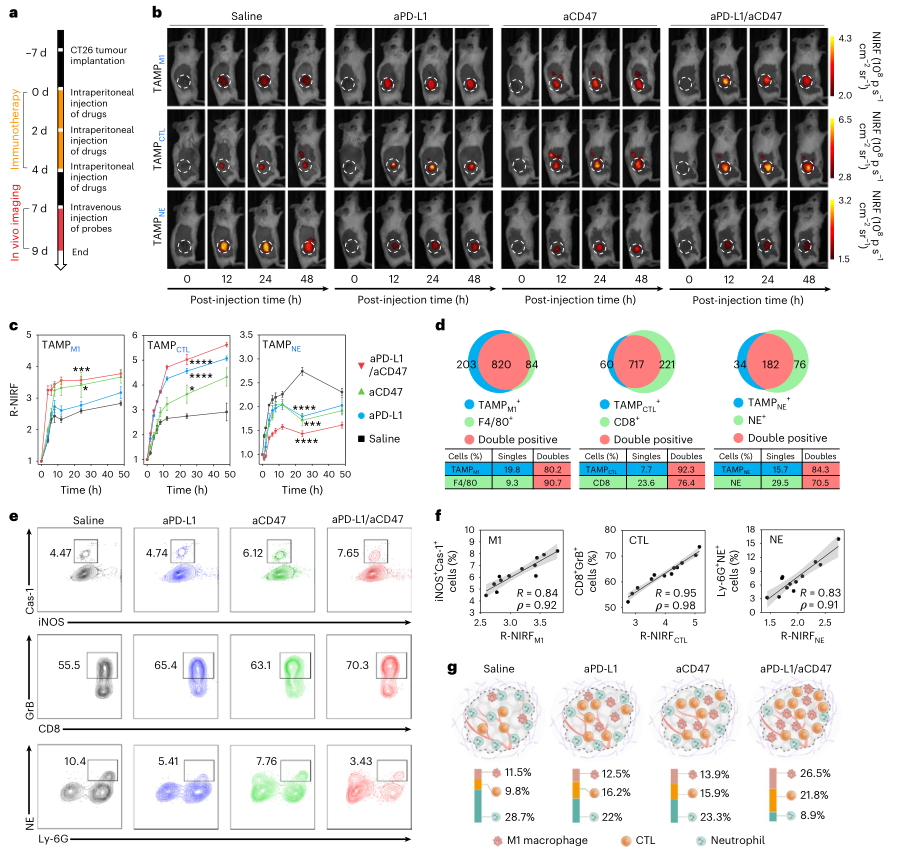
圖|CT26荷瘤小鼠TIL的體內實時NIRF成像
除了尿液分析外,TAMP還通過顯微鏡檢查描繪了TIL在整個腫瘤切片中的空間分布。TAMP染色顯示了治療后TIL的位置和密度的變化,顯示分布在腫瘤中心的陽性預后TIL(M1巨噬細胞和CTL)較多,陰性預后TIL較少(中性粒細胞),M1巨噬細胞水平高1.5至2.0倍,CTL水平比未經治療的腫瘤高1.6至1.9倍,中性粒細胞水平比未治療的腫瘤低3.1至4.5倍。
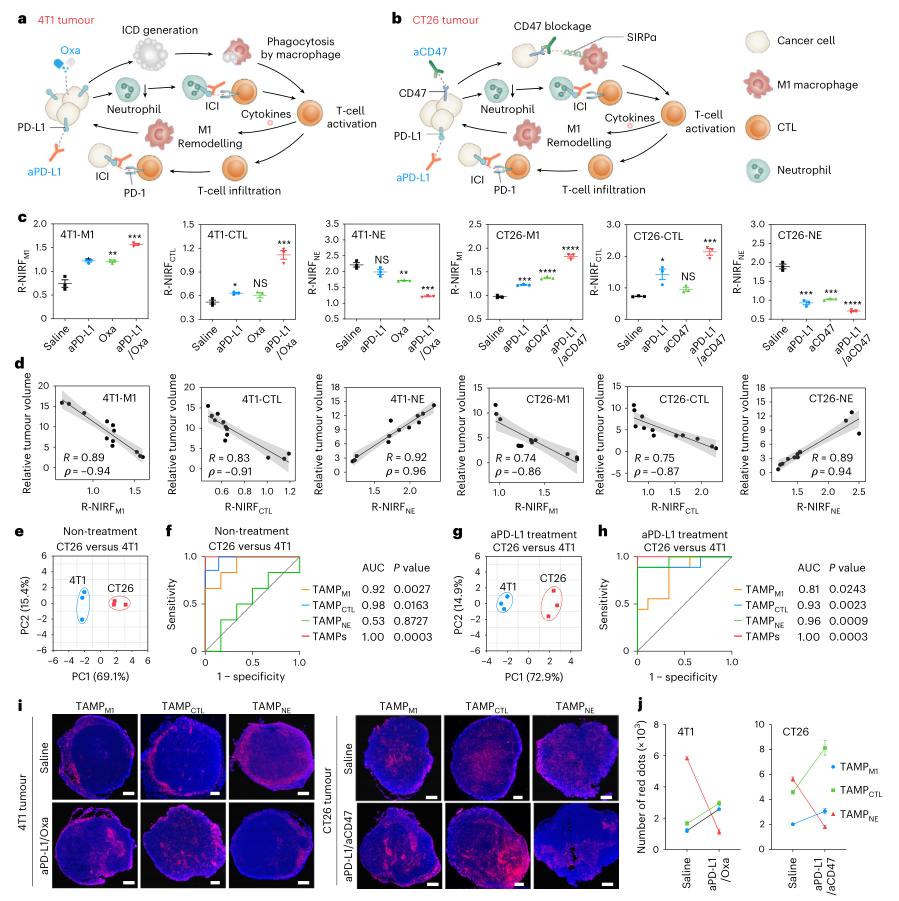
圖|TAMPs預測癌癥免疫治療
總而言之,該研究開發了一套TIL特異性分子熒光探針(TAMP),用于癌癥免疫治療的伴隨診斷和預后。TAMP具有獨特的雙重鎖定傳感機制,允許與TIL進行特異性熒光相關性。基于TAMP的實時成像和尿液分析是非侵入性和動態的,可用于在侵入性活組織檢查的靜態流式細胞術分析水平上分析具有敏感性和特異性的多種TIL。TAMP的信號相關性允許對腫瘤免疫原性進行準確分析,并允許對時間變化進行縱向監測。因此,TAMP代表了一種高通量、非侵入性和有效的方法,可以在臨床前環境中篩選聯合免疫治療劑,并在個性化聯合癌癥免疫治療的患者分層、免疫治療干預的優化和免疫治療結果的預測方面具有轉化潛力。TAMP的模塊化雙鎖定串聯設計可以推廣用于在靶向疾病位點特異性檢測來自靶向細胞的生物標志物。
參考文獻:
He, S., Cheng, P. & Pu, K. Activatable near-infrared probes for the detection of specific populations of tumour-infiltrating leukocytes in vivo and in urine. Nat. Biomed. Eng (2023).
https://doi.org/10.1038/s41551-023-01009-1











