
第一作者:Carlos Rodríguez-Nogales
通訊作者:Patrick Couvreur、María J. Blanco-Prieto
通訊單位:University of Navarra、Université Paris-Sud
核心內容:
1. 綜述了納米醫學在應對兒科癌癥中的現狀和進展。
2. 探討了在未來臨床應用中的挑戰和機遇。
針對兒科癌癥的化療仍然許多存在問題,一方面是由于化療藥物的自身的高毒性,另一方面就是根據成人所推斷出的用藥劑量方案。往往是不正確的。目前,飛速發展的納米技術已經被證明了可以用于降低抗癌化療藥毒性,由此可以改善和提高藥物的治療效果,這一思路目前也已經成為成人化療中常見的應用策略之一。
然而,專門針對兒科癌癥治療的納米藥物的缺乏,仍然是當前一個重大的醫學難題。
有鑒于此,西班牙納瓦拉大學María J. Blanco-Prieto課題組總結了兒科癌癥中納米醫學的應用現狀,并對其進一步的臨床推廣所面臨的機遇和困難進行了分析討論。
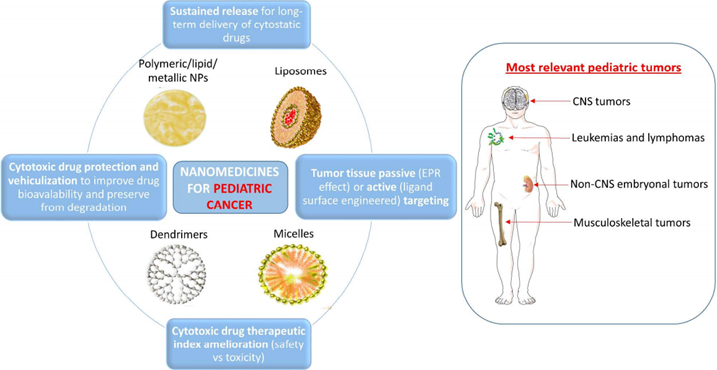
圖1 納米醫學用于兒科癌癥的治療策略
在過去的二十年里,由于一系列癌癥診斷和治療技術的進步,兒科癌癥的治療工作也取得許多突破。但是研究證明,癌癥仍然是目前造成兒童和青少年死亡的重要原因。并且與成人癌癥患者相比,兒科癌癥的發展前景并不那么樂觀,因此尋找治療兒童癌癥的新策略就顯得尤其重要。
在兒科癌癥中,最具代表性的癌癥類型主要是血液癌;中樞神經系統(CNS)腫瘤是兒科腫瘤發病率第二高的類型;非中樞神經系統胚胎腫瘤是第三種最常見的惡性腫瘤;再之后就是骨腫瘤和軟組織肉瘤。隨著納米技術研究在改善癌癥治療這一領域取得系列重大突破之后,Rodríguez-Nogales等人總結了目前納米技術在兒科癌癥中的現狀和研究進展,進而從臨床的觀點出發討論了未來這一領域所面臨的機遇和挑戰。
1. 化療在兒科癌癥治療中的毒性問題
在治療兒科癌癥的方案中,化療往往最后的選擇。盡管許多常見的化療藥物的抗腫瘤功效已得到充分證實,但將其臨床應用于兒童通常會帶來更大毒性風險。并且給這些兒童服用的高劑量化療藥物來進行長期的治療同樣也會造成不良后果,如心臟毒性、皮膚反應、淋巴壞死和骨髓抑制等副作用,甚至也可能導致心血管并發癥或認知功能障礙。
盡管目前對兒科癌癥患者使用的化療藥物的體內動力學有了一些研究,但是錯誤的劑量選擇卻還是會發生。受限于倫理和經濟原因,對兒科癌癥患者藥物的研究仍然十分缺乏。給兒童使用的藥物中約有70%沒有在實際患者中得到詳細研究。
目前根據成人劑量的外推法是兒科癌癥患者選擇劑量的常用方法。常常以年齡或者體重為推斷的依據。但這也忽略了不同兒童發育階段的差異性。這就使得有必要用其他方法來獲取給兒科癌癥患者的使用的藥物的體內動力學和藥效學數據,例如設計合理的藥代動生理學模型和納米藥劑進而實現對化療藥物的遞送和生物分布的有效調控。
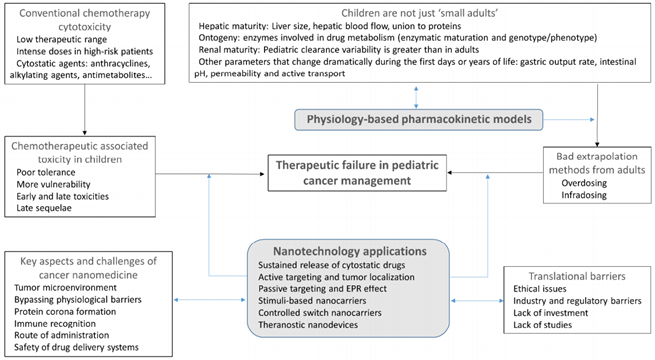
圖2 改善對兒科癌癥的治療的方法概述
通過設計藥物遞送系統,可以提高化療藥物的保護、吸收和藥效發揮。目前許多研究證明,諸如納米顆粒或者納米纖維等等納米材料可以作為藥物遞送系統的基礎。這些納米材料的一大功能就是可以有效地負載藥物并利用修飾主動靶向配體或者EPR效應將藥物遞送至靶向目標區域,進而大大改善這些藥物的體內藥代動行為。
兒童在醫學中的概念可不能簡單的理解為“小大人”,他有他自身獨特的生理學特點。如果僅僅是根據成年人來推斷兒童的用藥劑量,造成的毒性后果往往十分嚴重。而如上所述,納米技術的運用可以幫助改善化療藥物的療效,進而有效防止由于劑量選擇錯誤帶來的過大毒性。但是出于對納米載體和安全性和腫瘤微環境的考慮,這種新穎的治療距離臨床應用仍有距離。
2. 不同兒科癌癥類型的介紹
兒科癌癥中由40%是血液癌,其中包括白血病、霍奇金和非霍奇金淋巴瘤等等。白血病是一種可治愈率極低的病癥,而實現針對白血病細胞的靶向治療也是目前研究領域的一大挑戰,難就難在如何有效分別正常的健康細胞和白血病細胞。有研究報道可以設計高密度的脂蛋白納米顆粒來有效地靶向在白血病細胞中過度表達的HDL/SR-B1。或者通過抗體和脂質體相連,達到增強白血病細胞攝取的目的。
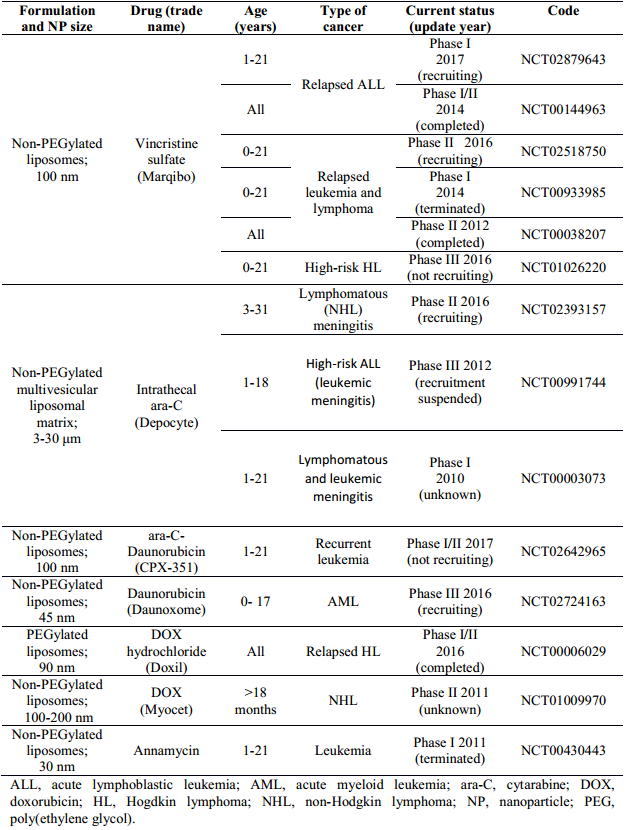
圖3 針對白血病和淋巴瘤的脂質體基材料的臨床研究
同樣在針對淋巴瘤的治療中,也可以運用納米技術來提高抗腫瘤效果。例如蒽環類藥物如阿霉素在治療淋巴瘤中使用廣泛,研究證明通過將其封裝入納米載體內后,可以有效提高其生物安全性,降低潛在的毒性風險,減少后續毒副反應和不良并發癥的產生。同樣地,利用納米載體的靶向功能也能有效地將藥物遞送至這類實體瘤中。
目前在臨床應用中使用較多的是脂質體和聚合膠束材料。得益于它們良好的生物相容性和負載藥物能力,可以預見的是這類材料將在后續的臨床實驗中獲得更加廣泛的認可。
排在白血病之后的腦腫瘤是第二常見的兒科癌癥。兒童的腦腫瘤細胞主要是神經細胞和神經膠質細胞,這些細胞會產生星形細胞瘤、神經膠質瘤、髓母細胞瘤和室管膜瘤等。
說到治療腦腫瘤,就不得不提血腦屏障(BBB),這一屏障作用限制了許多分子使其無法轉運進入CNS。但是“壞人”進不去,“好人”也進不去了。許多抗腫瘤藥物無法有效進入CNS。盡管有的CNS疾病會使得BBB功能紊亂,但是研究發現藥物仍然難以到達腫瘤病灶去治療患者。
研究證明,成人和兒童的BBB的滲透性是十分類似的,因此也許可以通過表面功能化的納米藥物系統進而穿越BBB,治療腦部腫瘤,已有實驗數據也同樣證明了這一點。但是否在兒科腦部腫瘤中也同樣適用,還需要進一步的研究評估。
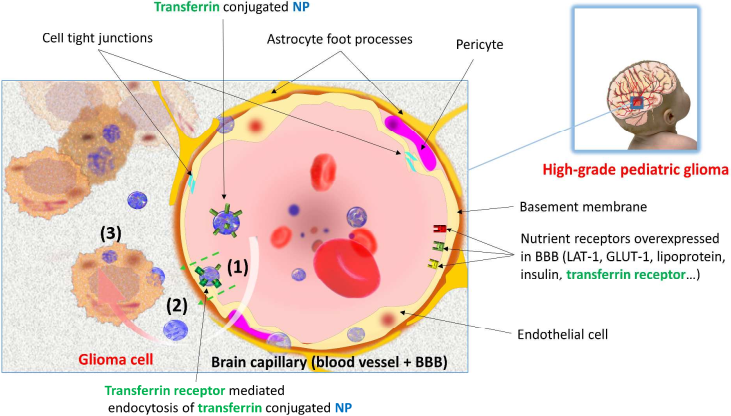
圖4 納米材料穿越BBB用于治療兒科腦腫瘤
神經膠質瘤同樣是兒科癌癥中的典型病例,許多抗癌藥對這類病癥的作用不盡如人意。而且兒童病例往往和成年人有所區別,對于劑量的把控就顯得更加困難,由此所造成的毒性風險同樣不容忽視。納米技術在針對神經膠質瘤的診療應用方面也有許多報道。例如將碳點和轉鐵蛋白結合作為DOX的輸送系統治療兒科神經膠質瘤。通過這樣一種處理,使得細胞對于DOX的攝取增強,療效顯著。但是其安全性仍待進一步考察。
目前治療視網膜細胞瘤的方法大多數摘除,但是這對患者的視力破壞很大。而通過冷凍療法或者化療等方式可以盡量挽救患者的視力。其中,利用納米技術介導的藥物遞送系統可以有效降低化療的毒性風險。例如將脫鐵轉運蛋白和乳鐵蛋白作為順鉑藥物的載體,大大改善了細胞對于藥物的攝取,并且毒性顯著降低。
研究證實引入納米技術對視網膜母細胞瘤的局部治療和非侵入性治療具有積極的作用。目前這類研究也已經進入臨床研究階段,但研究對象都是成年人。但其對于藥物全身性毒性的降低緩解將也給兒童病例的治療康復帶來了曙光和希望。
骨肉瘤在兒科癌癥中的占比約為5%。但由于其很容易向肺部惡性轉移,造成死亡率仍然不容忽視。氨甲蝶呤是自70年代以來使用較多的針對此類病癥的藥物,但是也有毒性較大和快速的血液清除的缺點。為了改善藥物的不足,利用聚乳酸-羥基乙酸納米材料將藥物封裝的策略可以有效抑制腫瘤的生長并且改善其在體內的毒性和半衰期。相似的策略用于DOX也有案例報道。
雙膦酸鹽是治療骨吸收紊亂的常用藥物。研究稱雙膦酸聚合物納米材料也可以作為化療藥物的載體。利用EPR效應,納米載體可以很好地進入腫瘤,并且基本不會造成劑量誘發的心臟毒性。對于解決治療兒科癌癥中的藥物安全性問題是一種很好的策略。
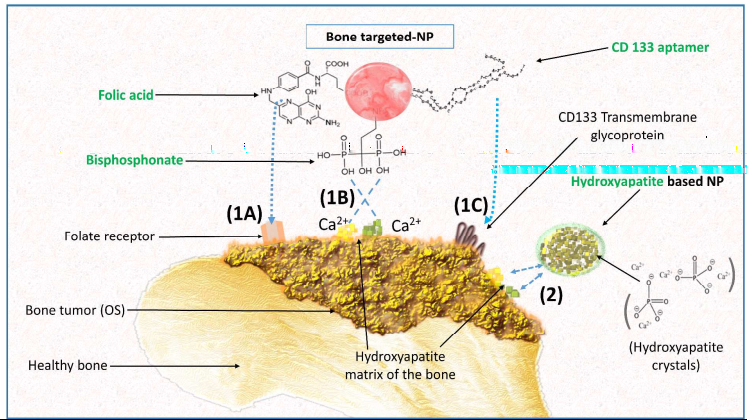
圖5 修飾靶向配體的策略用于治療骨瘤的藥物遞送
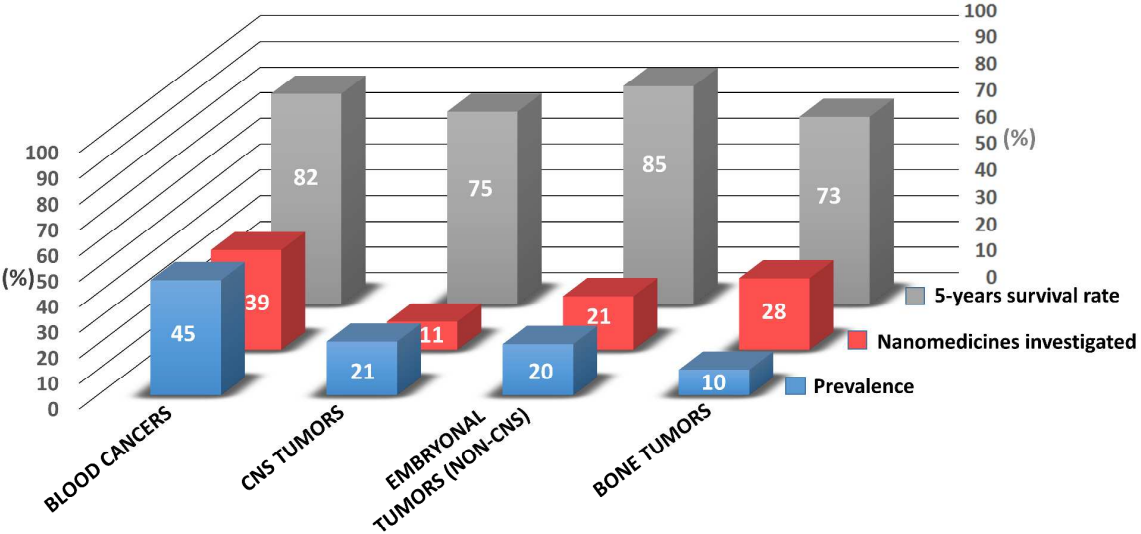
圖6 納米技術應用于兒科癌癥的狀況調查
3. 納米醫學技術用于兒科癌癥領域的重要里程碑
針對兒童的藥物研究的緊迫性調使得FDA在1997年予以許可批準進行相關研究。從1995年DOX被開發以來,一些抗癌納米藥物已經批準用于成年人,但是針對兒童人群的研究卻沒有得到許可。盡管用于兒科臨床研究的標準化和規范化的具體協議方案已經達成,并于2007年在美國由FDA完成了修正案,但是不同研究機構之間仍然缺乏有效合作,這對于臨床實驗的開展是不利的。
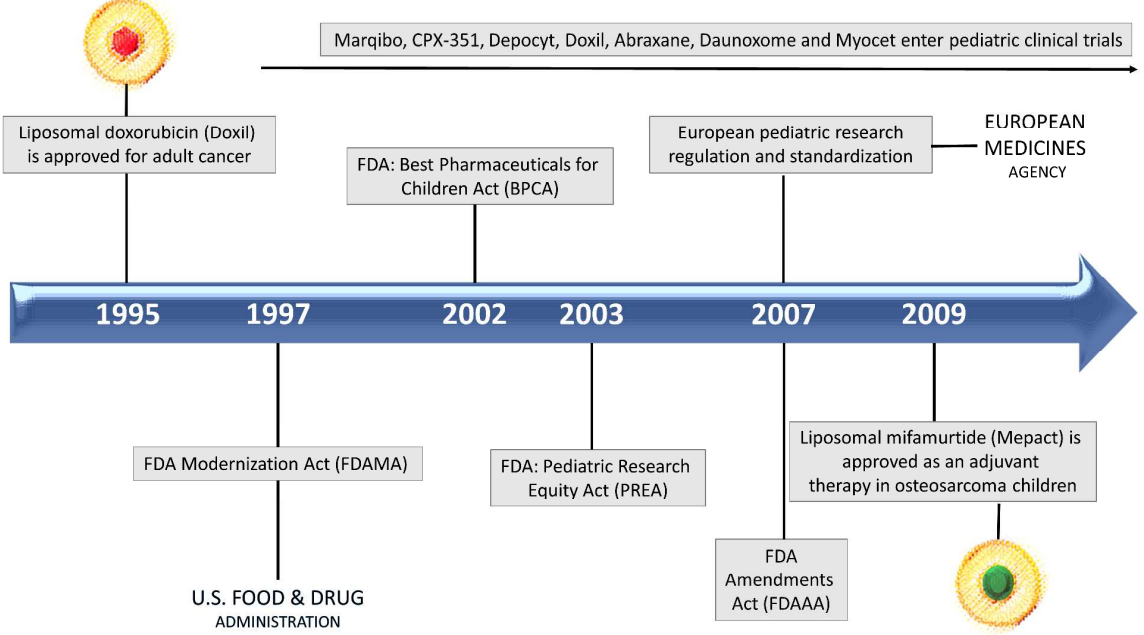
圖7 納米醫學在兒科癌癥領域的歷史沿革
可喜的是,盡管道路艱辛,但是一些納米材料最近已經在兒科臨床試驗中達到了第三階段。在2009年,米伐木肽被批準用于兒科骨原性肉瘤。同年FDA批準的用于治療成人缺鐵性貧血的超順磁性氧化鐵也作為臨床使用的兒科成像的造影劑。
綜上所述,盡管目前納米技術在成年癌癥患者中的研究取得許多成果,但是在面對兒科癌癥時卻仍然需要更好的發展。例如除去單一化療以外,聯合治療也應當被考慮用于兒科癌癥的治療方案之中。并且只有充分認識兒童與成年人之間的生理差異,才能有針對性的進行臨床實驗。
臨床實驗所面臨的的倫理問題和體外實驗的不足使得研究兒科癌癥注定將是一個道阻且長的過程。但是我們也有理由相信,通過兒科腫瘤學家和臨床醫生的充分合作,利用納米技術改善的治療方案在不久的將來也可以在兒科癌癥的診療領域取得更大的進步!
參考文獻:
Rodríguez-Nogales C, González-Fernández Y, et al. Nanomedicines for Pediatric Cancers[J]. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b03684
https://pubs.acs.org/doi/10.1021/acsnano.8b03684











