蛋白質-蛋白質相互作用在幾乎所有的生物過程中發(fā)揮著重要作用,包括信號轉導、細胞生長和免疫防御。鑒于這些相互作用在穩(wěn)態(tài)和疾病反應中的關鍵作用,與體內蛋白質相互作用的合成蛋白質(例如工程抗體)代表了現(xiàn)代醫(yī)學中最具變革性的治療方式之一。目前,大多數(shù)合成蛋白質是使用實驗平臺開發(fā)的,這些平臺不知道這些蛋白質在何處以及如何與它們的靶標結合。盡管計算設計方法取得了進步,但預測與靶標相互作用的區(qū)域的氨基酸序列仍然是結構生物學中最具挑戰(zhàn)性的問題之一。然而,對蛋白質-蛋白質相互作用的深入理解、結構數(shù)據(jù)可用性的增加以及機器學習的進步為改進設計蛋白質-蛋白質相互作用的方法奠定了基礎。
長期以來,科學家們一直認為蛋白質通過其表面的互補區(qū)域相互作用,就像相鄰的拼圖塊一樣。然而,蛋白質-蛋白質界面從來都不是完全互補的,蛋白質表面由于原子運動而不斷變化。此外,這些表面的形狀和它們形成的互補化學相互作用(如氫鍵)的類型千差萬別,這使得識別互補的表面尤其具有挑戰(zhàn)性。
2020年,洛桑聯(lián)邦理工學院Bruno E. Correia等人在Nature Methods上報道了一種稱為 MaSIF 的方法,將蛋白質表面模式轉化為數(shù)字陣列,可用于識別傾向于形成蛋白質-蛋白質相互作用的區(qū)域,以及與特定靶標互補的表面。
近日,Bruno E. Correia聯(lián)合牛津大學Michael Bronstein等人提議可以使用這些展示來創(chuàng)建與生物醫(yī)學相關靶標結合的新蛋白質,方法是首先識別蛋白質中的靶標位點,然后從大型蛋白質表面數(shù)據(jù)庫中識別互補表面。成果發(fā)表在Nature上。

為實現(xiàn)這一靶標,研究人員從公共數(shù)據(jù)庫中可用的蛋白質結構中構建了小蛋白質片段(或種子)的數(shù)據(jù)庫。選擇這些種子以形成與感興趣的靶標位點互補的區(qū)域的基礎,并隨后使用計算設計將其整合到更大的蛋白質單元中。
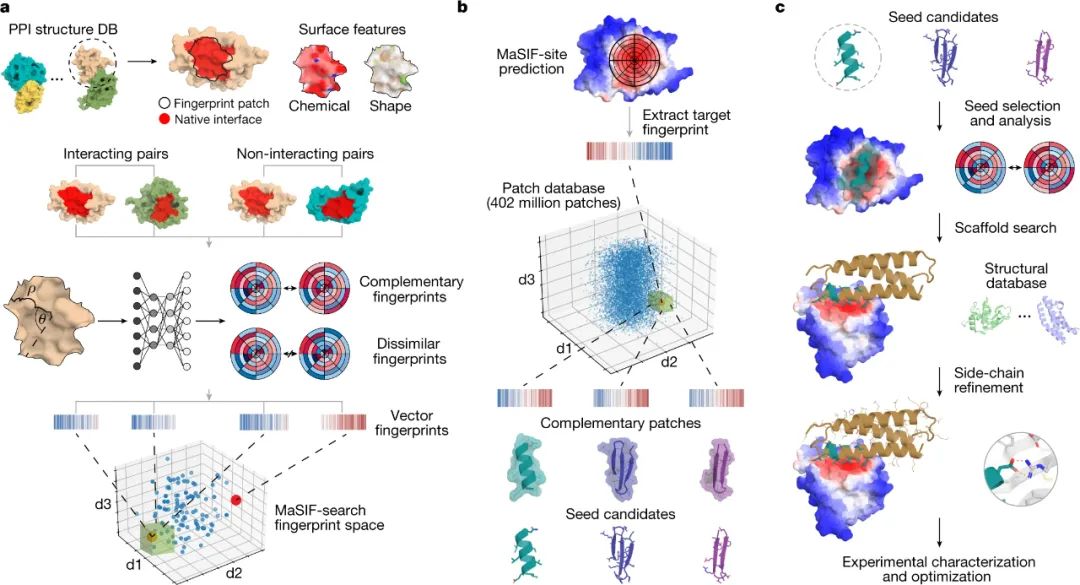
圖|以表面為中心的全新位點特異性蛋白質結合劑設計
通過這種方法,研究人員為 SARS-CoV-2 病毒的刺突蛋白和癌癥免疫治療的三個重要靶點(PD-1、PD-L1和CTLA-4)創(chuàng)建了新的蛋白結合劑,它們的結合親和力都接近傳統(tǒng)抗體。此外,所有設計的蛋白質都參與了它們被開發(fā)的位點。總的來說,該管道可以很容易地推廣到幾個具有治療意義的蛋白質靶點,并且可以直接從計算機生成蛋白質結合劑。
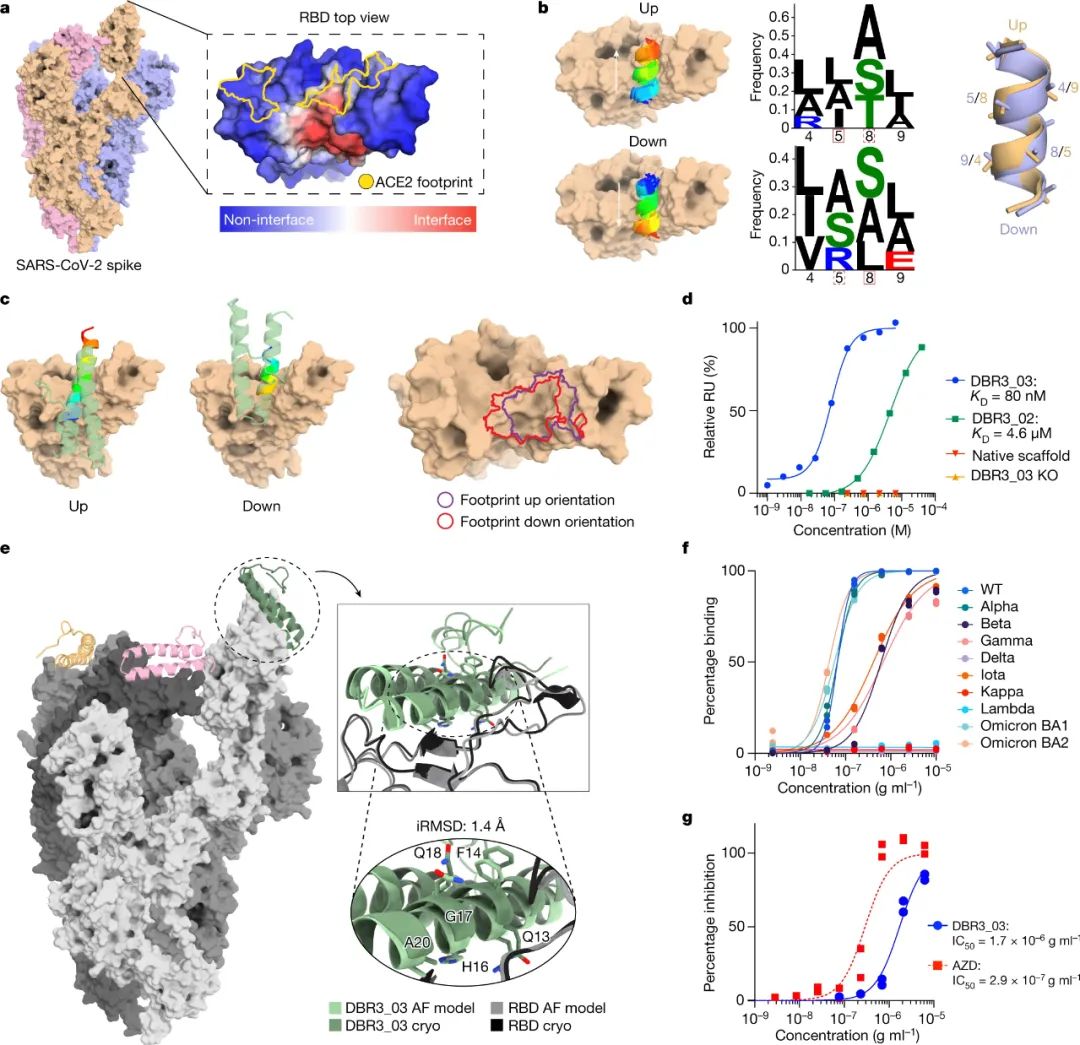
圖|針對RBD的SARS-CoV-2 型結合劑的設計和優(yōu)化
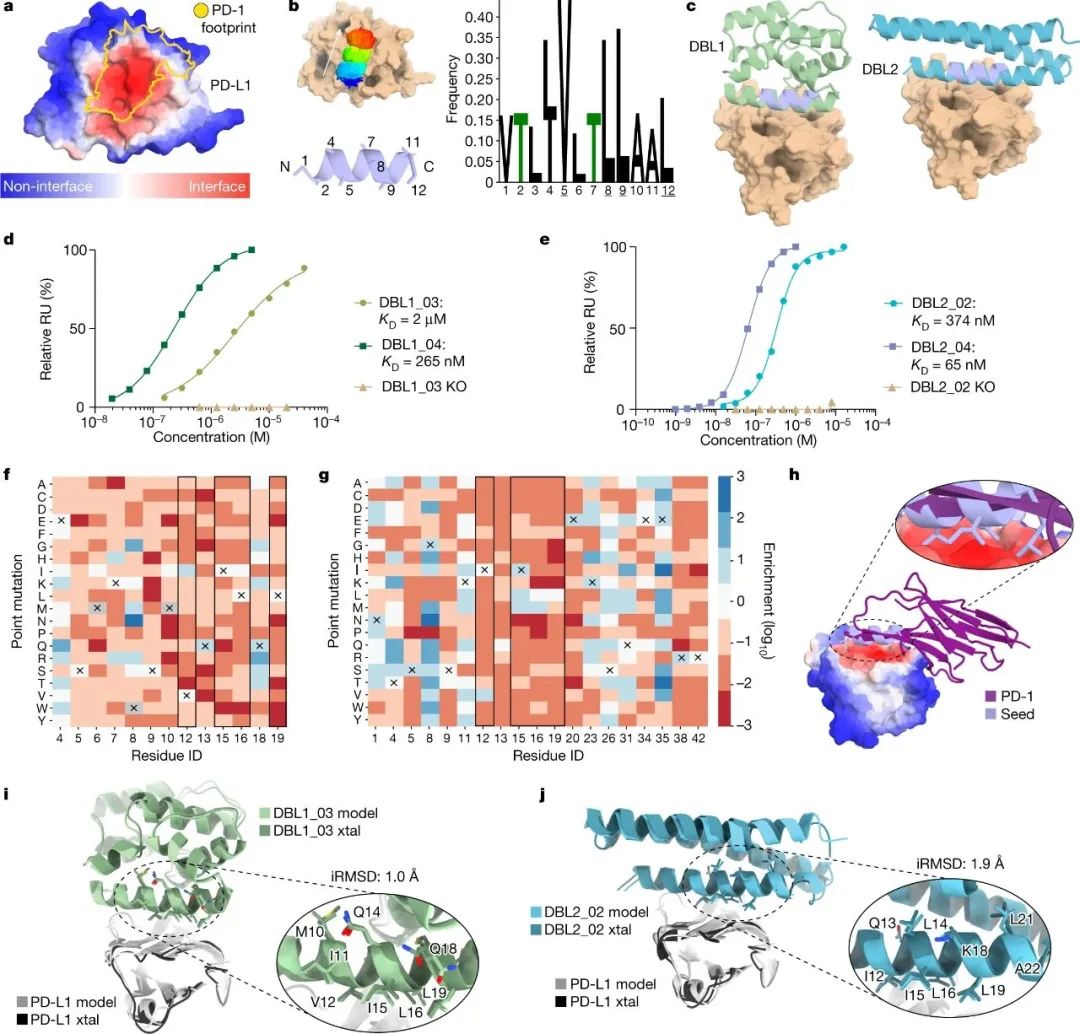
圖|針對平面的PD-L1結合劑的從頭設計和優(yōu)化
總而言之,該研究為許多基礎生物學和治療應用打開了大門。科學家們可以使用該管道來創(chuàng)建比靶向特定位點甚至特定構象狀態(tài)的抗體更小的蛋白質結合劑。可以選擇位點來降低突變蛋白逃避合成蛋白結合的風險,就像世界上經(jīng)歷過的一些 SARS-CoV-2 變體一樣,這些變體對各種 COVID-19 疫苗不太敏感。編碼合成蛋白質的基因可以插入細胞療法中,例如針對癌癥進行修飾的免疫細胞。
當前的管道依賴于3D蛋白質種子數(shù)據(jù)庫,該數(shù)據(jù)庫雖然很大,但并不能普遍代表所有類型的蛋白質界面。所選片段是結構化且可預測的,這與抗體等中發(fā)現(xiàn)的片段不同。此外,該方法不模擬蛋白質中潛在的構象變化。總體而言,當可以使用當前工具預測合成蛋白質的構象結構并且靶標處于特征明確的構象中時,它表現(xiàn)良好。
參考文獻:
1. Gainza, P., Wehrle, S., Van Hall-Beauvais, A. et al. De novo design of protein interactions with learned surface fingerprints. Nature (2023).
https://doi.org/10.1038/s41586-023-05993-x
2. Gainza, P. et al. Nature Methods 17, 184–192 (2020).











