
第一作者:孟周琪
通訊作者:劉莊
通訊單位:蘇州大學(xué)、東華大學(xué)、山東師范大學(xué)
研究亮點:
1. 制備高效的近紅外激光激活的混合水凝膠系統(tǒng)CuS/131I-PEGDA/AIPH。
2. 該系統(tǒng)可以有效提高CuS/131I的瘤內(nèi)保留并多次持續(xù)改善瘤內(nèi)乏氧來增強放射治療效果。
通過將治療性放射性物質(zhì)放入腫瘤或附近的區(qū)域中進行治療的短距離放射治療。在這一治療方案中,生成的氧自由基被用于來攻擊生物分子如DNA,然后殺死腫瘤細胞。因此與外束放射治療相似,氧也在增強和誘發(fā)短距離放射治療中癌癥細胞的死亡方面起著關(guān)鍵作用。
然而,由于實體腫瘤微環(huán)境的缺氧性質(zhì),乏氧的腫瘤細胞比正常細胞更能抵抗輻射,從而導(dǎo)致了這一治療方法對某些類型的癌癥的治療效果很差。此外,在一些臨床病例中,局部植入放射源例如125I可能無法為整個腫瘤提供同質(zhì)均勻的劑量分布,也會導(dǎo)致短距離放射治療效果不佳。
由于水凝膠能夠?qū)⑸锘钚晕镔|(zhì)封裝在前體中,然后將其轉(zhuǎn)化為針對目標(biāo)病灶(如腫瘤)的交叉連接的水凝膠網(wǎng)絡(luò),從而使長期的藥物釋放能夠持續(xù)地保留的特點使得其獲得了研究人員的極大關(guān)注。由此可以設(shè)想制備在腫瘤內(nèi)實現(xiàn)溶膠-凝膠轉(zhuǎn)換的放射性同位素膠囊,對于改善易于操作的短距離放射治療效果來說會很有幫助。
目前有不同的方法來觸發(fā)體內(nèi)的水凝膠的原位形成,如光,和特定的酶。在這些策略中,使用光引發(fā)劑觸發(fā)聚合的光誘導(dǎo)凝膠具有突出的優(yōu)勢,因為它可以在時間和空間的精度下進行調(diào)控。然而,大多數(shù)光引發(fā)劑都只能被短波長的光源所激發(fā),而這些光源的組織穿透深度十分有限。因此發(fā)展近紅外(NIR)光激活的水凝膠系統(tǒng),將有希望能夠改善治療型放射性同位素在腫瘤內(nèi)的控制方式,同時有助于克服由于乏氧造成的實體腫瘤的輻射抗性。
有鑒于此,蘇州大學(xué)劉莊教授課題組利用混合水凝膠體系,有效提高了CuS/131I的瘤內(nèi)保留并多次持續(xù)改善瘤內(nèi)乏氧來增強放射治療效果。
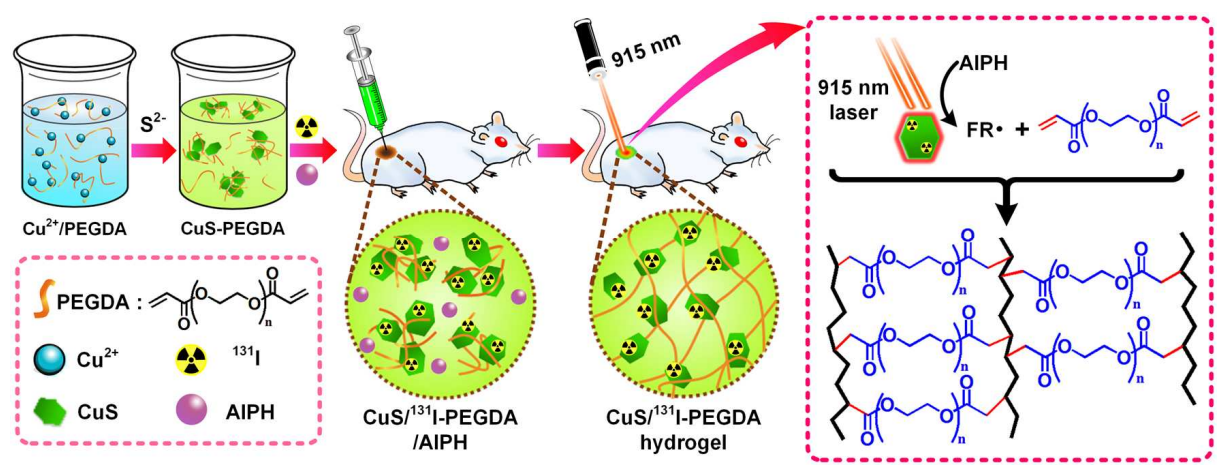
圖1 瘤內(nèi)原位合成CuS/131I-PEGDA水凝膠的示意圖
該課題組使用131I標(biāo)硫化銅(CuS/131I)納米粒子作為光熱-放射療法的試劑;聚乙二醇雙丙烯酸酯(PEGDA)作為聚合物基體;AIPH作為熱引發(fā)劑來實現(xiàn)光致原位凝膠光熱-短距離放射聯(lián)合治療腫瘤。CuS/131I在915 nm激光輻照下會產(chǎn)生熱量適度地提高腫瘤溫度,并通過激活A(yù)IPH熱引發(fā)劑來啟動PEGDA聚合,有效地通過原位凝膠化將CuS/131I固定在腫瘤內(nèi)。通過對腫瘤的反復(fù)照射,缺氧可以得到長期有效的緩解,從而產(chǎn)生顯著的協(xié)同光熱效應(yīng)消除腫瘤。
在這一工作中,親水性的CuS-PEGDA NPs在水溶液中利用原位共同沉淀方法來合成。在透射電子顯微鏡下觀察發(fā)現(xiàn)CuS NPs直徑在5-10 nm,進一步被PEGDA封裝形成50-70 nm大小的CuS-PEGDA。而高分辨率TEM(HRTEM)圖像顯示了CuS清晰的晶格邊緣,其平面間的d間距為2.81 ?,與CuS的六角形結(jié)構(gòu)的(103)晶格邊緣一致。

圖2 CuS/131I-PEGDA水凝膠及其前體的制備表征
由于CuS-PEGDA在NIR區(qū)域的強烈吸收,研究人員對CuS-PEGDA的光聲(PA)成像性能進行了評價。可以明顯地發(fā)現(xiàn)PA信號強度會隨著銅的濃度的增加而線性上升。隨后對CuS-PEGDA NPs的光熱轉(zhuǎn)換性能進行了評估,結(jié)果顯示CuS-PEGDA NPs的溫度變化與濃度密切相關(guān),并且在循環(huán)照射五次后仍然保持了良好的光熱穩(wěn)定性。

圖3 活體成像及光熱轉(zhuǎn)化結(jié)果
CuS-PEGDA/AIPH溶液被注射到帶有4T1腫瘤的Balb/c小鼠體內(nèi),PA成像數(shù)據(jù)顯示,10分鐘的時間內(nèi)整個腫瘤中幾乎是均勻分散的。隨后腫瘤的PA信號顯示輕微的下降,表明CuS NPs的可能通過淋巴引流泄漏到腫瘤周圍組織。因此CuS-PEGDA NPs全腫瘤均勻分布以10分鐘為最佳時機。利用紅外(IR)熱感攝像機來監(jiān)控溫度變化,發(fā)現(xiàn)在激光的照射下,注射CuS-PEGDA / AIPH發(fā)熱腫瘤可以使得溫度升高并保持在43度,而注射PBS的小鼠的溫度變化則非常小。

圖4活體伽馬射線成像及生物分布結(jié)果
生物分布結(jié)果實驗證明,當(dāng)向腫瘤注入131I NPs或CuS/131I-PEGDA NPs時,這些納米顆粒將逐漸轉(zhuǎn)移到其他器官,腫瘤的保留率很低。與之形成鮮明對比的是,對于注射了CuS/131I-PEGDA /AIPH并用激光照射的腫瘤,在其中發(fā)現(xiàn)了更高的放射性殘留,并且很少轉(zhuǎn)移到小鼠身體的其他部位。研究結(jié)果證實,近紅外激光引發(fā)原位凝膠的CuS/131I-PEGDA /AIPH系統(tǒng)可以有效地保留CuS/ 131I納米顆粒使得其在腫瘤內(nèi)長期富集,有利于更有效穩(wěn)定的腫瘤治療。
利用免疫熒光染色使用檢查腫瘤的缺氧狀態(tài)實驗表明,由于局部熱療效應(yīng)促進腫瘤內(nèi)血流,腫瘤缺氧信號在NIR觸發(fā)光熱后的最初幾個小時內(nèi)明顯減弱。然而,缺氧狀態(tài)也將在稍后逐漸恢復(fù)并在24后達到初始狀態(tài)。因此反復(fù)地照射腫瘤是可以緩解缺氧來改善短距離放射治療的。結(jié)果也發(fā)現(xiàn)每一輪的近紅外激光輻照后,腫瘤治療CuS-PEGDA / AIPH都大大削弱了腫瘤的缺氧信號。

圖5 一次和多次治療對于改善乏氧的對比
相對于對于只有一輪的NIR激光照射的腫瘤,重復(fù)的光熱會導(dǎo)致長期的腫瘤缺氧緩解。基于PEGDA水凝膠對CuS/131I的長期腫瘤內(nèi)保留的優(yōu)良性能,以及利用NIR激光在該系統(tǒng)中觸發(fā)重復(fù)光熱和腫瘤缺氧緩解的特性,可采用一次注射但多次治療的方法進行光熱治療。
活體治療實驗表明,僅依靠PTT治療將無法有效地切除腫,因此相應(yīng)地這些組的小鼠在治療后僅有20-24天的壽命。同時,利用CuS/131I NPs或CuS/ 131I-PEGDA/AIPH進行單輪的近紅外激光治療,雖然顯示腫瘤增長有被抑制,但在之后的效果也不明顯。而在小鼠腫瘤內(nèi)注射CuS/131I-PEGDA/AIPH和并且用三輪近紅外激光照射后發(fā)現(xiàn)腫瘤迅速縮小,最終在第 10天消失。

圖6 活體腫瘤治療效果
這一組的小鼠存活了超過60天,沒有一個死亡,而所有其他對照組的小鼠在26天內(nèi)相繼死亡。這種顯著的治療效果的優(yōu)勢不僅要歸功于NIR激光引發(fā)的原位膠凝形成所導(dǎo)致的CuS/131I長期在腫瘤內(nèi)保留,而且還于多次觸發(fā)的腫瘤缺氧緩解,以進一步提高放射性同位素131I對腫瘤細胞的破壞效力有關(guān)。
總之,這一工作開發(fā)出一種高效的NIR激活的混合水凝膠系統(tǒng)CuS/131I-PEGDA /AIPH,改善了短距離放射療法的效果并減少了副作用,為推動這一療法的應(yīng)用提供了新的思路。
參考文獻:
Meng Z, Chao Y, et al. Near-Infrared-Triggered in situ Gelation System for Repeatedly Enhanced Photothermal-Brachytherapy with a Single Dose[J]. ACS Nano, 2018.
DOI: 10.1021/acsnano.8b04544











