盡管納米技術和生物醫學工程取得了顯著進步,但目前只有少數可注射的醫用納米載體 (NC) 可用于癌癥診斷和治療。這主要是由于 NC 在正常器官中的脫靶積累和長期保留引起的潛在毒性問題。非腎臟可清除的粒徑(>10nm)可能導致不受控制的分布曲線,這是傳統NCs利用增強的滲透性和保留效果的主要先決條件。由于臨床轉化率有限,這種老式的NC設計面臨著向腎臟可清除的超小納米平臺的范式轉變,與非腎臟可清除的對應物相比,它有幾個優點:(1)通過尿液排泄迅速消除分布在非靶向組織的NC,(2)腫瘤血管的高滲透性,以及(3)單核吞噬細胞系統的吸收高度減少。這些有利的特點使得大劑量給藥的細胞毒性貨物分子具有更高的腫瘤選擇性,從而提高療效,并將不良反應降至最低。
然而,腎臟可清除的NCs并不是沒有缺點,阻礙了它們的臨床轉化。一個主要的缺點是微量注射的NCs造成的殘留毒性,它可能面臨不經意的慢性積累。盡管有短期的生物相容性,但長期或終身暴露于不可降解的外來材料,如二氧化硅、金屬和合成聚合物納米顆粒,使其臨床使用受到阻礙。為了解決這個問題,報道了由可生物降解的有機材料(包括β-環糊精(CD)接枝的聚賴氨酸)組成的可腎臟清除的NCs,即H-Dots,顯示了高效的腫瘤靶向藥物輸送和低背景組織保留。然而,這些NCs的腫瘤選擇性主要是由于它們在正常組織中的停留時間大大減少,而不是增強了腫瘤的歸宿能力。這表明,通過延長腎臟可清除的有機NCs的腫瘤保留時間,可以實現更高的腫瘤選擇性。雖然靶向配體可以被引入到NC結構中,但這種所謂的主動靶向策略并不總能確保提高選擇性,會意外地誘導調理作用和隨之而來的脫靶積累,主要是通過單核吞噬細胞系統的攝取。因此,要想在臨床上取得成功,需要對最佳的NC結構進行微妙的調整,平衡腎臟可清除NC的靶向效率和非靶向積累。
結直腸癌(CRC)是第三大最常見的診斷癌癥,其死亡率位居第二。手術切除后的輔助化療(ACT)是目前治療II期和III期CRC的主要方法。然而,化療藥物的嚴重毒性往往限制了化療的有效性,即使是使用小劑量的各種藥物進行聯合治療。這種情況需要創新的方式來改善或取代現有的ACT治療方案。
鑒于此,首爾大學Dae-Duk Kim、忠南大學Jae-Young Lee等人報道了腎臟可清除的 CD 納米平臺的開發,該平臺可以促進腫瘤保留,而不會在 CRC 治療中引起成像和治療劑的任何脫靶積累。

首先,研究人員設計和合成了20種不同的環糊精衍生物(CD 1-20),通過改變環糊精和谷氨酸之間的連接部分(P2)、谷氨酸和苯硼酸(PBA)之間的連接部分(P3)以及連接至谷氨酸鏈接部分上的帶電基團,設計了不同的衍生物結構。通過熒光素酰胺試驗和1H NMR分析證實,這些帶電基團成功地與環糊精衍生物結合成CD 16-20。接著,對這些環糊精衍生物進行了膠體穩定性篩選,最終選出了CD 16-20,并通過對其顆粒大小和電荷進行測量,CD 16-20 衍生物在體內的尺寸為5-6.6nm,同時它們的帶電特性與修飾基團相對應,證明這些衍生物具有高的膠體穩定性和腎臟清除能力,適合作為靶向藥物載體進行靜脈注射。
研究人員探討了不同CD衍生物與ACy7的包合物的生物分布情況。在小鼠實驗中,與自由ACy7相比,這些載藥復合物的靶向性更強,肝臟和肺部的積累減少,腎臟的選擇性增強,同時增加了腫瘤的分布效率。其中,帶有PBA基團的CD衍生物CD17/ACy7在腫瘤組織中的積累水平最高,是一種潛在的腫瘤靶向治療藥物。PBA- (ZW)-CD 被選為優化的腎臟可清除 CD 衍生物用于進一步研究。
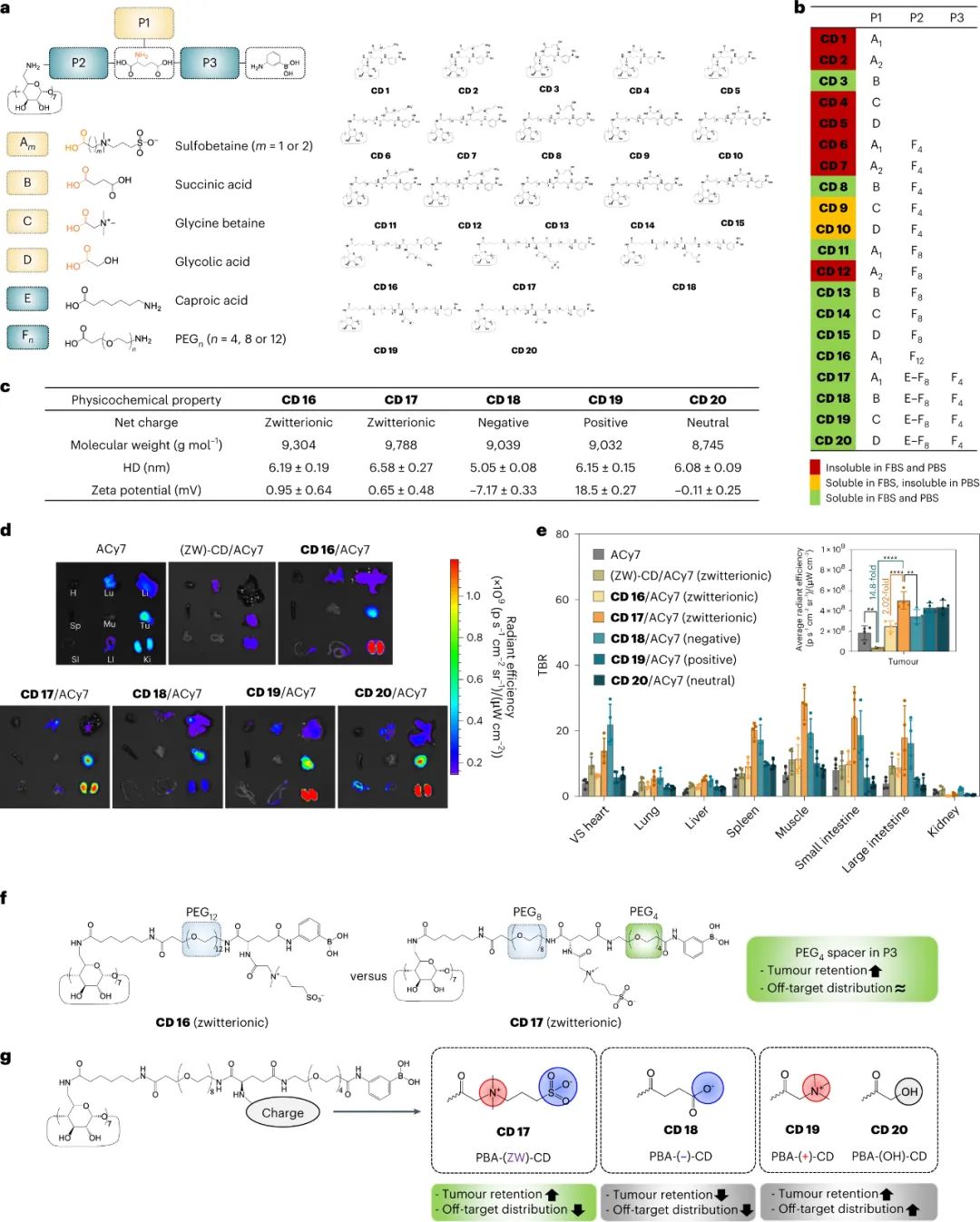
圖|腎臟可清除的CD衍生物,可增強腫瘤滯留并減少脫靶積聚
然后,研究人員探討了PBA-(ZW)-CD/ACy7的腫瘤靶向性和生物分布。實驗結果表明,PBA-(ZW)-CD/ACy7可以通過PBA-唾液酸相互作用靶向腫瘤,并且PBA-(ZW)-CD分子中的磺酸鹽基團可以減少其與正常組織的非特異性結合,從而提高了藥物的靶向性。實驗還表明,PBA-(ZW)-CD/ACy7在小鼠模型中可以被快速分布到全身,經腎臟排泄后選擇性地積聚在腫瘤組織中,從而可以用于腫瘤手術的輔助成像,提供準確的腫瘤切除范圍。此外,PBA-(ZW)-CD/ACy7的藥代動力學研究表明,PBA-(ZW)-CD分子還可以促進藥物分子的腎臟排泄,減少其在正常組織中的滯留。
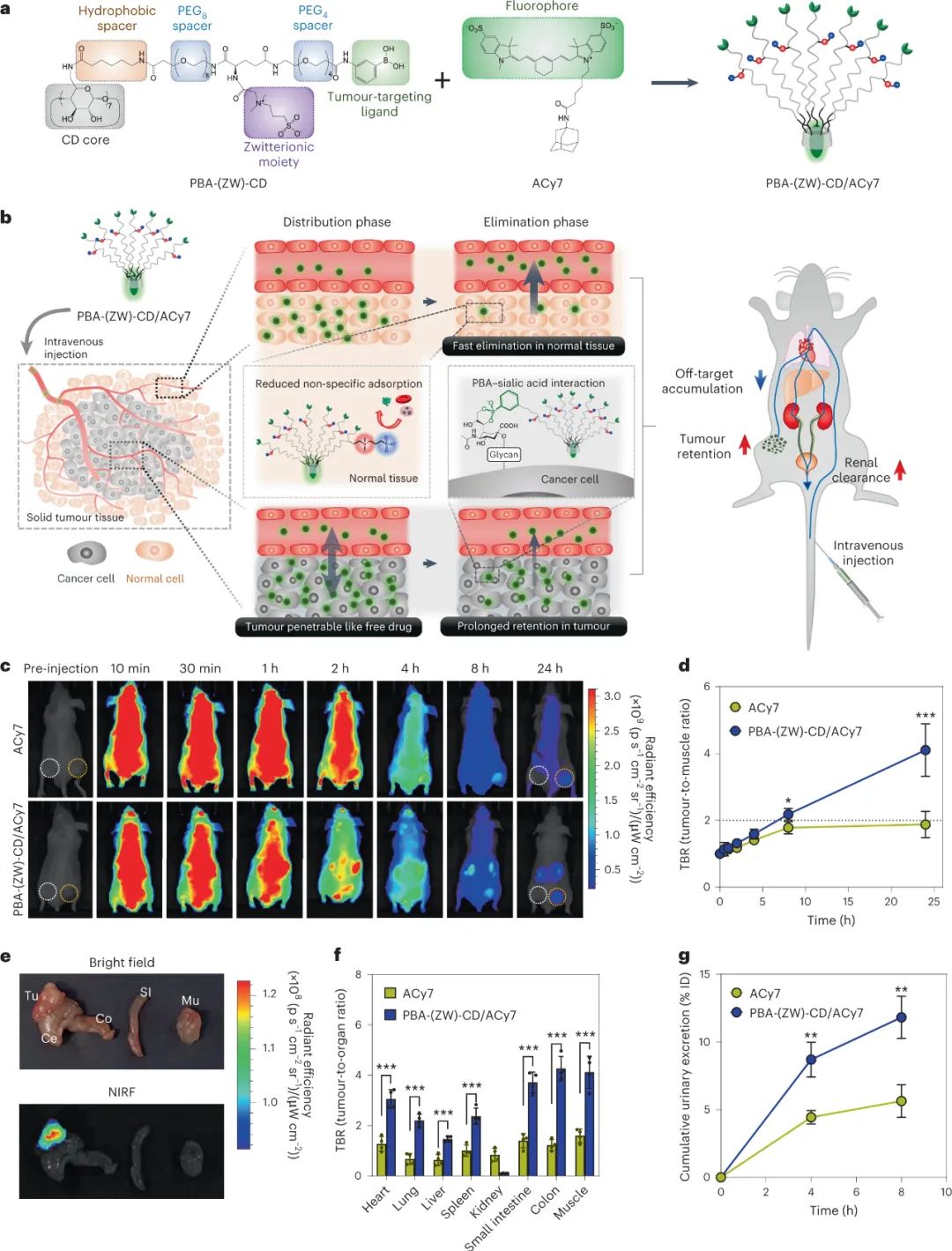
圖|PBA-(ZW)-CD/ACy7的腫瘤靶向性、藥代動力學和尿液排泄
研究人員使用PBA-(ZW)-CD制備了包含兩種化療藥物多柔比星(DOX)和烏利司他(UXT)的復合物,以評估其在結直腸癌治療中的潛力。實驗發現,PBA-(ZW)-CD/DOX的平均水合直徑(HD)在pH 7.4下為13.04±3.85 nm,而在pH 5.5下下降至7.09±0.26 nm。PBA-(ZW)-CD/UXT在pH 5.5和pH 7.4下的平均HD分布相似,均為6.30±0.11 nm和6.30±0.09 nm。PBA-(ZW)-CD/藥物顯示出pH依賴性釋放特性,這可能轉化為對腫瘤組織的選擇性藥物暴露。另外,包合物的ζ電位在酸性pH下增加,這歸因于客體藥物的電離,而在pH 7.4下保持帶電性和雙性離子性。
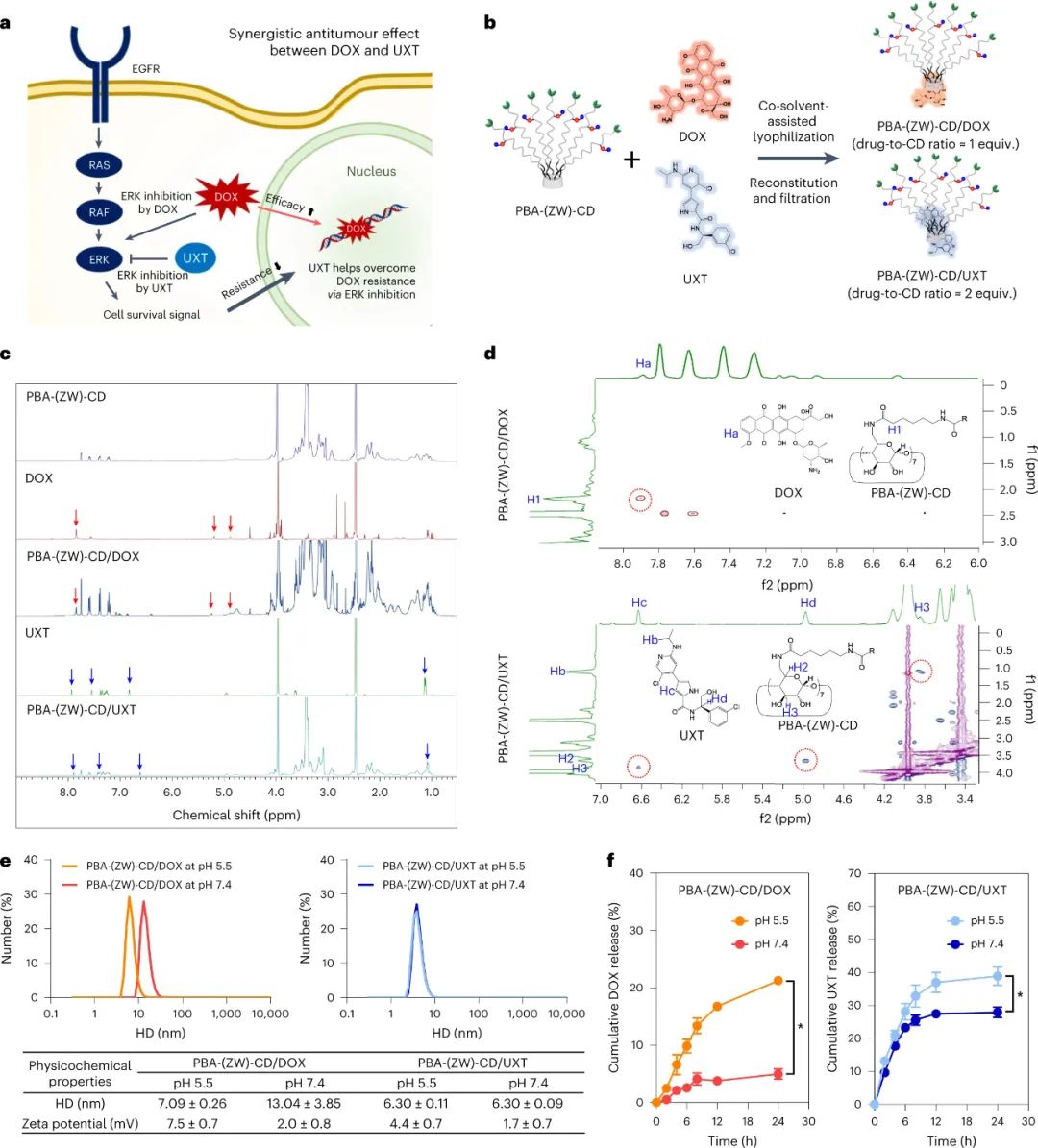
圖|PBA-(ZW)-CD/藥物包合物的制備和表征
隨后,研究人員研究了PBA-(ZW)-CD/藥物復合物的生物分布,并將其與自由藥物進行了比較。結果表明,與自由藥物相比,PBA-(ZW)-CD/DOX處理組的DOX在非靶組織中的暴露顯著降低。此外,PBA-(ZW)-CD可以增強腫瘤組織對DOX和UXT的保留能力,同時降低藥物在正常組織中的分布。PBA-(ZW)-CD/藥物復合物可以像游離藥物溶液一樣容易地穿透腫瘤微環境,促進藥物在整個腫瘤組織中的均勻輸送。
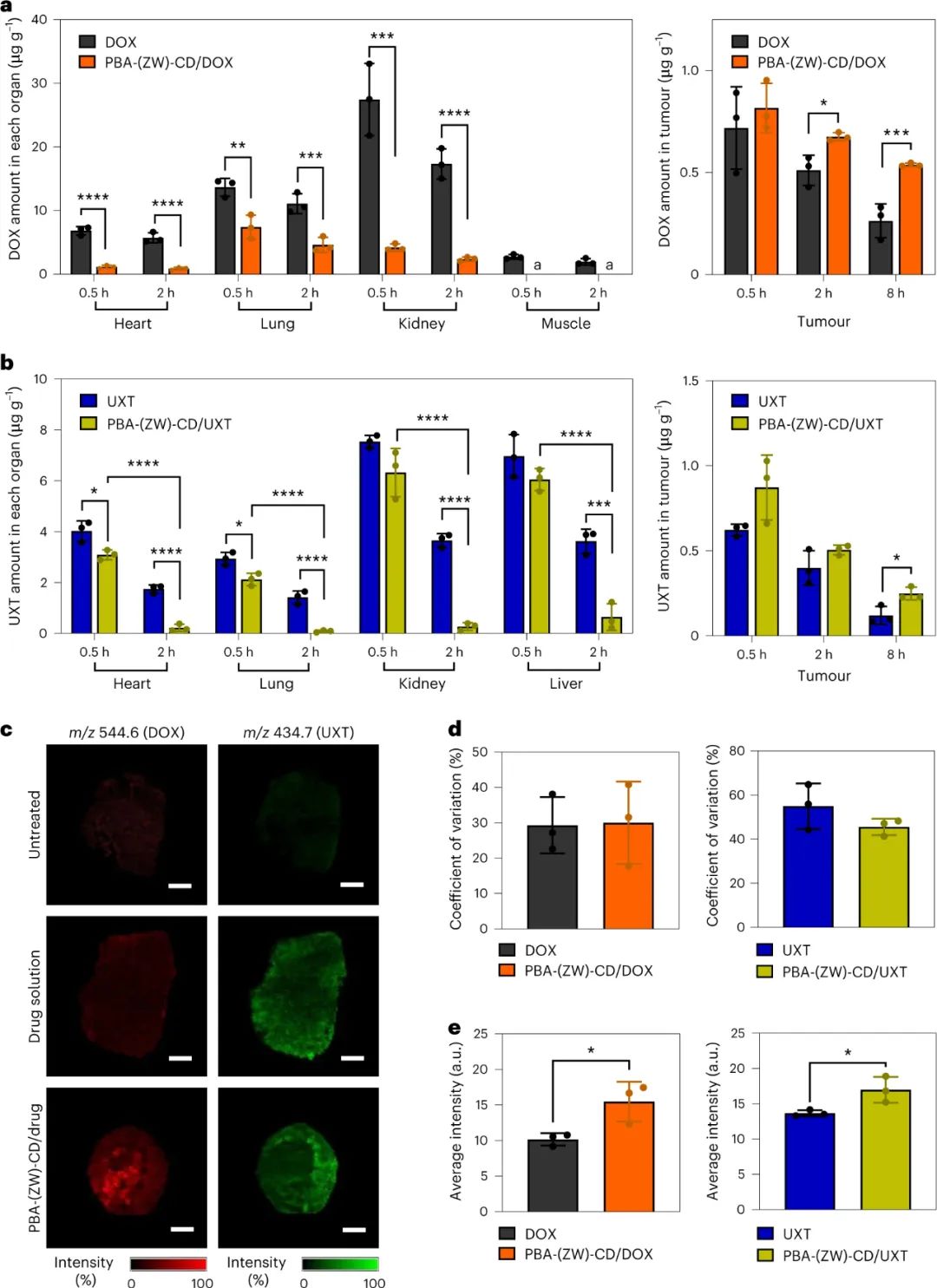
圖|PBA-(ZW)-CD/藥物包合物的生物分布
最后,研究人員利用PBA-(ZW)-CD/drug配合物來增強化療藥物DOX和UXT的治療效果。實驗結果顯示,與單獨使用藥物相比,PBA-(ZW)-CD/drug復合物顯著提高了抗腫瘤效果,同時減少了DOX對正常器官和免疫細胞的毒性,因為PBA-(ZW)-CD改善了DOX的分布。聯合療法的實驗結果表明,PBA-(ZW)-CD/drug復合物對抑制腫瘤生長的效果明顯優于單獨使用藥物,并且未發現明顯的系統毒性。在一個模擬大腸癌的小鼠模型中,聯合療法的抗腫瘤效果也得到了驗證,同時減少了腹膜轉移的發生。實驗結果還表明,PBA-(ZW)-CD可以降低化療藥物的毒性,減輕患者的不良反應,具有潛在的臨床應用價值。
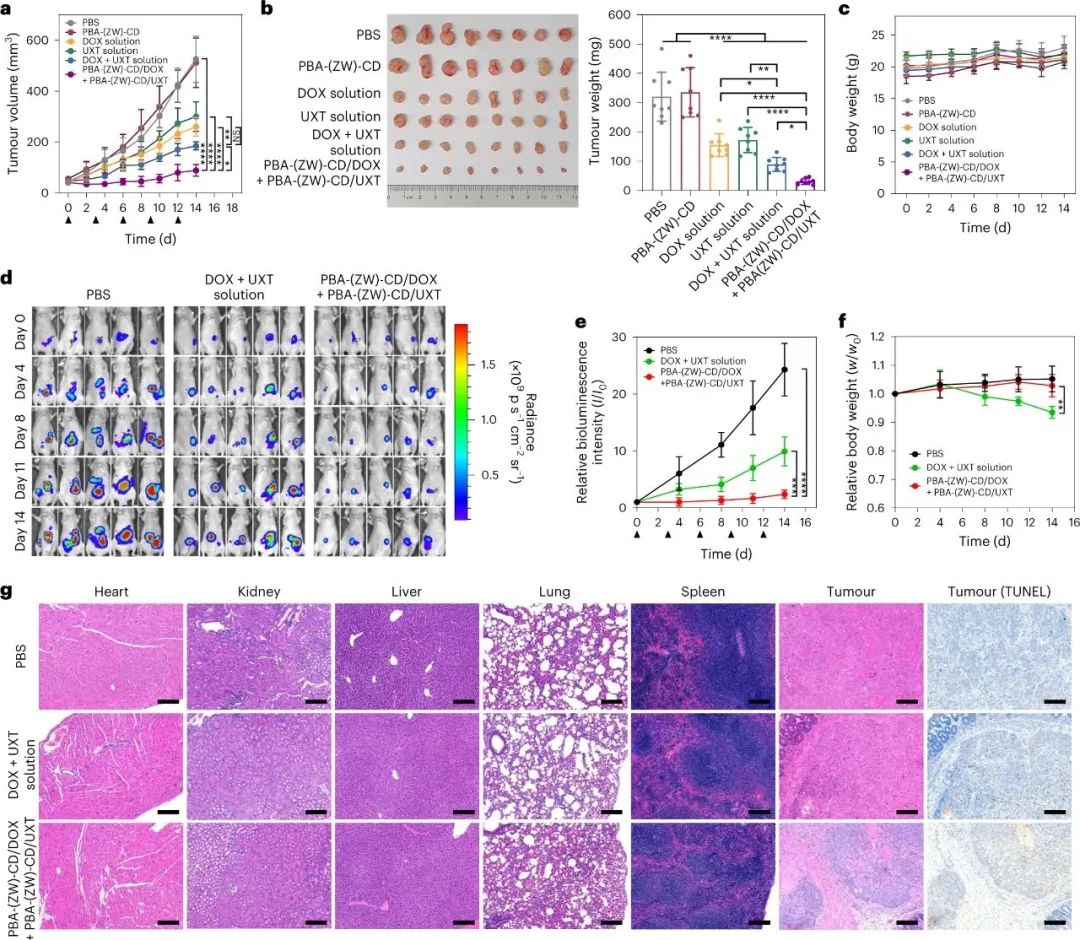
圖|CRC模型中的PBA-(ZW)-CD/藥物輔助聯合治療
綜上所述,研究人員提出了一種精心設計的腎臟可清除兩性離子 CD,即 PBA-(ZW)-CD,用于CRC 選擇性成像和藥物輸送。總而言之,PBA-(ZW)-CD 可作為一種有前途的 CRC 靶向納米平臺,具有很高的臨床轉化潛力。
參考文獻:
Baek, MJ., Nguyen, DT., Kim, D. et al. Tailoring renal-clearable zwitterionic cyclodextrin for colorectal cancer-selective drug delivery. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01381-8











