免疫抑制劑(ICIs)的發展為癌癥治療帶來了革命性的變化。ICIs的作用是幫助人體免疫系統釋放出對僅由癌癥細胞表達的蛋白質(稱為新抗原)突變版本的免疫。新抗原的肽段可能被免疫系統視為外來物,并能激活稱為T細胞(特別是CD8 T細胞),這些細胞能夠殺死癌癥細胞。胰腺癌通常對ICIs沒有反應,它也被稱為“癌癥之王”。這被認為部分是因為這些腫瘤表達的新抗原水平低于其他類型的腫瘤,因此不太可能激活抗腫瘤T細胞的強烈免疫反應。近日,紀念斯隆-凱特琳癌癥中心Vinod P. Balachandran等人挑戰了這一想法,并描述了一種可以通過編碼個體特異性新抗原的疫苗來激活新抗原特異性T細胞的方法。他們的研究建立在先前的研究基礎上,研究表明,長期存活的癌癥患者具有高質量的新抗原,可以刺激抗腫瘤T細胞。
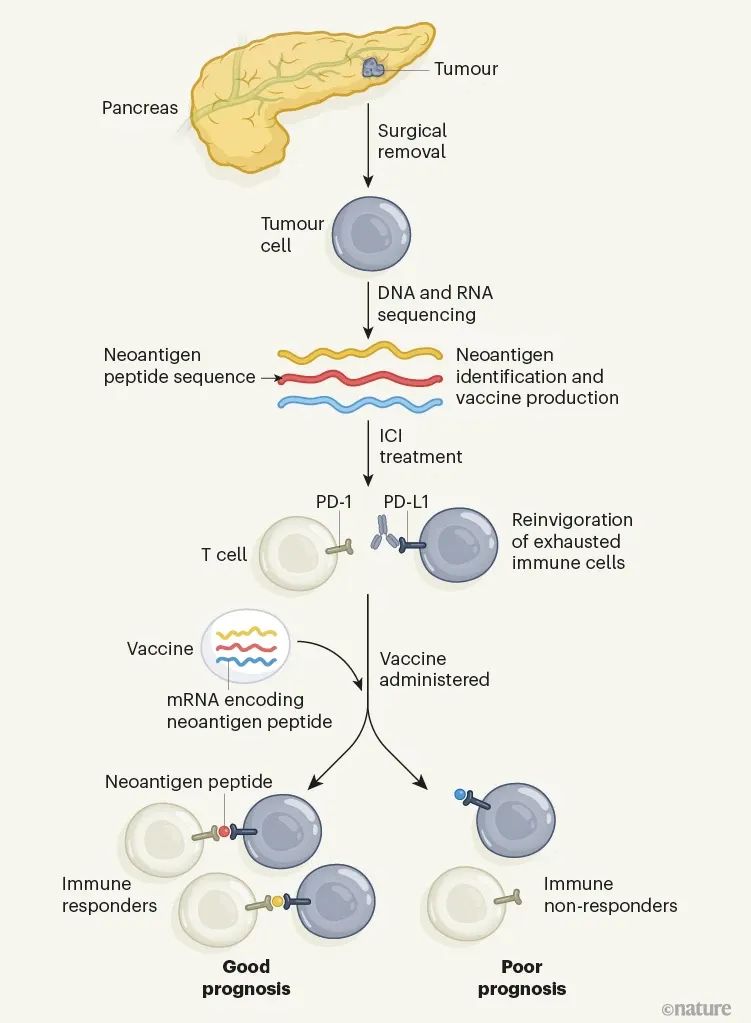
該研究團隊為 16 名已通過手術切除腫瘤的胰腺癌患者設計了與新抗原相對應的信使 RNA 疫苗。接受這種手術的個體通常有高達80%的疾病復發幾率。mRNA 疫苗最多可為每位患者編碼 20 種新抗原,這些新抗原是通過對患者手術切除的腫瘤中的DNA和RNA進行測序來鑒定的。疫苗在手術后九周左右通過靜脈注射,并計劃在下一階段的研究(II 期臨床試驗)中加快疫苗生成和給藥的時間。這種快速的治療時間突顯了基于mRNA的癌癥疫苗的益處,特別是對于高度侵襲性腫瘤。
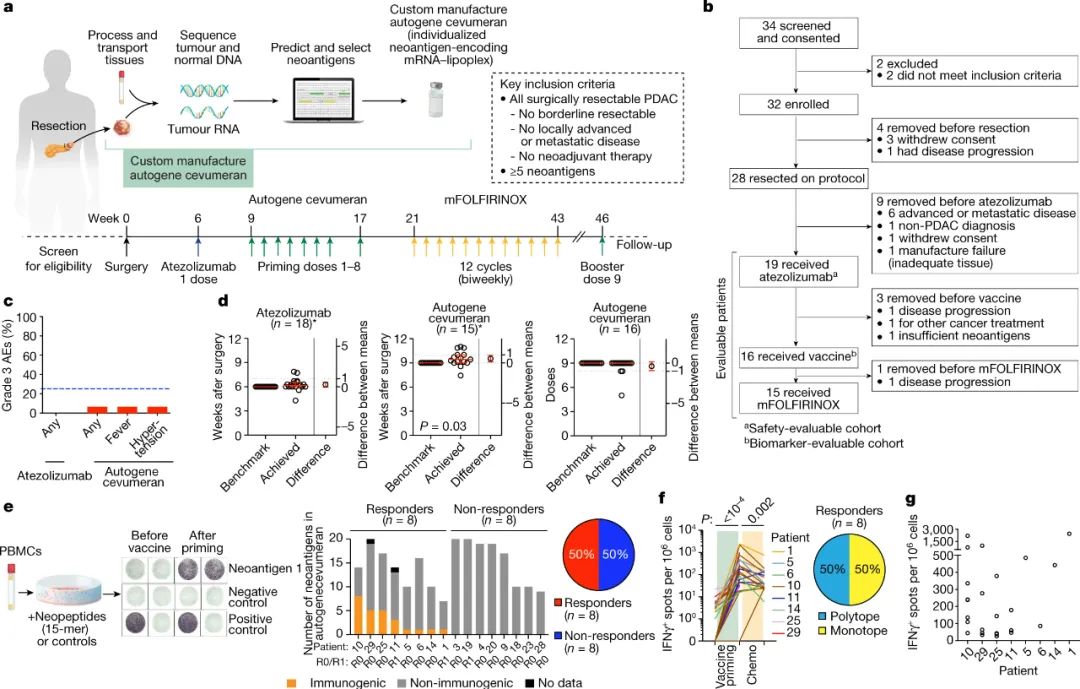
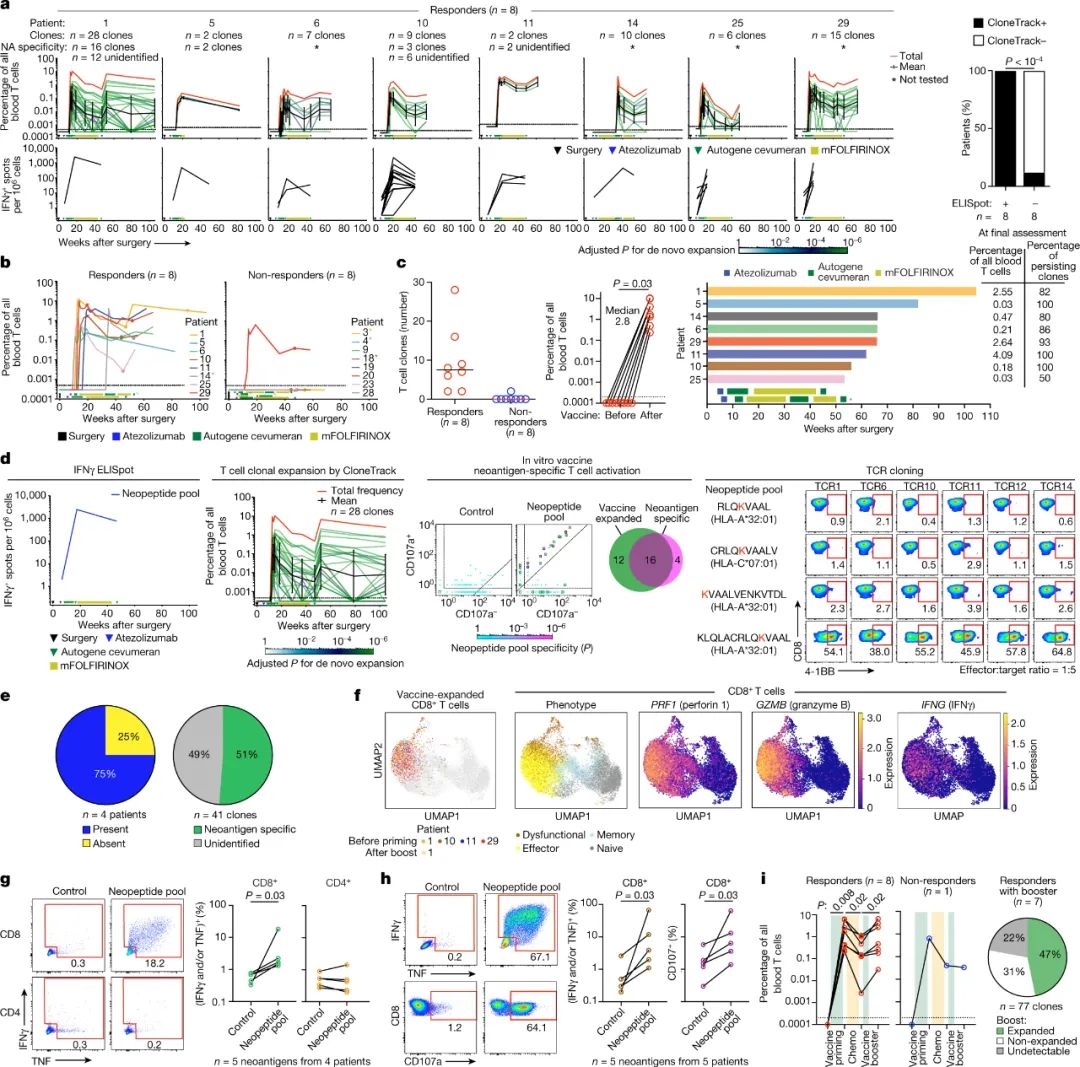
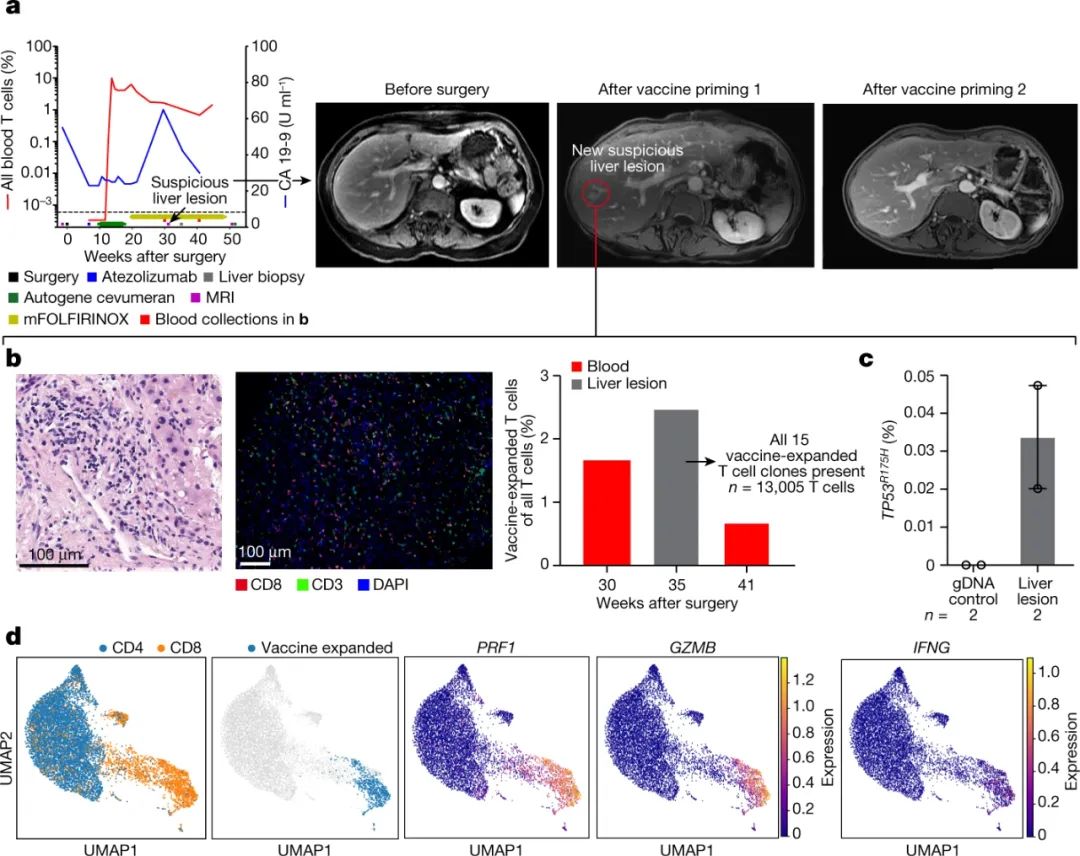
圖|個體化的mRNA新抗原疫苗在PDAC患者中是安全,可行和免疫原性的在試驗中有一半的人接種疫苗后,在血液中檢測到識別與 mRNA 編碼肽相對應的特定新抗原的 T 細胞——這些人被稱為免疫應答者。在這些反應者中,一半對不止一種新抗原產生 T 細胞反應(多位點反應),而另一半則對單一新抗原產生反應(單位點反應)。值得注意的是,在所有免疫應答者中,在手術后 18 個月的中位隨訪時間沒有癌癥復發的證據,而無反應者的中位隨訪時間為 13.4 個月。這些數據非常有希望,將為計劃中的進一步臨床試驗提供框架。在接種 mRNA 疫苗之前,所有患者還接受了單劑量的ICI,稱為 atezolizumab。Atezolizumab 以在腫瘤細胞上發現的蛋白質 PD-L1 為靶點,并通過重新激活預先存在的腫瘤反應性 T 細胞發揮作用。作者分析了 ICI 治療后的患者血液樣本,并確定了增殖(擴增)的 T 細胞譜系——T 細胞激活以響應新抗原識別的標志。作者通過對與參與免疫反應的部分 T 細胞(T 細胞受體 β 鏈)對應的 DNA 進行測序來鑒定這些譜系。在 atezolizumab 治療下增殖的 T 細胞不同于在 mRNA 疫苗接種后增殖的 T 細胞,這提供了疫苗激活新抗原特異性 T 細胞的證據。圖|mRNA疫苗擴增多克隆、多功能效應CD8+T?細胞最后一次 mRNA 疫苗接種后 4 周,患者接受了化療,這有時會抑制免疫細胞,但作者發現疫苗增強的 T 細胞并未受到抑制。這突出了一個事實,即序貫聯合治療策略對胰腺癌患者是可行的。也許數據集中最令人信服的部分是免疫細胞在肝臟區域積聚的證據,在接種疫苗后,一個應答者有異常變化的跡象(稱為病變)。雖然沒有證據表明該病變中存在癌癥,但所有疫苗誘導的T細胞譜系都存在于免疫細胞的聚集中。有趣的是,在病變中檢測到TP53基因的突變版本,并與患者胰腺腫瘤中的TP53突變相匹配,這增加了一些癌癥細胞遷移到此位置的可能性。肝臟病變隨后消失,這表明疫苗可以幫助消除擴散到遠處的腫瘤細胞(微轉移)。研究人員使用兩種基于血液的測試(ELISpot和T細胞受體測序方法)追蹤T細胞譜系。這些有利于檢測高強度T細胞反應(具有強烈 T 細胞激活跡象的反應),但可能無法捕獲低強度反應。大約 11% 的接種新抗原明顯引起了高強度的 T 細胞反應。在 16 人中的 4 人中,只有一種新抗原驅動了免疫反應。因此,盡管一種高質量的新抗原可能足以觸發 T 細胞介導的腫瘤殺傷,但重要的是要了解為什么未檢測到針對疫苗中其他新抗原的免疫反應。此外,對于引起低強度 T 細胞反應的新抗原,有可能增強反應,例如通過給予更多劑量的 ICI 也可能防止 T 細胞耗竭。同樣重要的是,鑒于應答者和非應答者在臨床特征上的相似性,需要調查為什么一半的人對疫苗接種沒有反應。兩組的基線免疫功能標志相似,如對另一種mRNA疫苗(一種針對冠狀病毒 SARS-CoV-2)的反應和初始胰腺腫瘤中CD8 T細胞的積累(密度)。相比之下,作者發現兩組之間的差異在于,免疫應答者的腫瘤的突變多樣性低于非應答者。這種較低的多樣性可能反映了免疫系統對腫瘤早期反應的后果,這表明免疫系統能夠更好地識別免疫應答者的腫瘤。使用應答者的數據,比較每種新抗原在其驅動T細胞應答的預測能力方面的質量,結果顯示,如先前報道的那樣,預測的更高質量的新抗原驅動更強的抗原特異性T細胞應答。與一些個性化疫苗研究不同,該研究顯示,新抗原特異性CD8 T細胞的激活占主導地位,這些細胞被認為是直接殺死腫瘤細胞的關鍵因素。有趣的是,作者沒有發現另一種新抗原特異性T細胞——CD4輔助T細胞——盡管疫苗中包含的新抗原被選擇并優先激活這兩種T細胞類型(盡管設計用于檢測低強度T細胞反應的測試可能會捕獲疫苗誘導的CD4 T細胞反應)。眾所周知,CD4 T 細胞是幫助 CD8 T 細胞發揮功能和延長控制腫瘤生長壽命的關鍵伙伴。這就提出了一個問題,即如何生產 mRNA 疫苗以促進兩種類型 T 細胞的最佳激活,包括優化免疫細胞的持久性、減少衰竭和免疫記憶的發展。優先選擇 CD4 特異性新抗原仍然是一個挑戰,而改進其識別的技術反過來可能會導致 CD4 T 細胞產生高質量的反應。此外,mRNA疫苗本身的某些方面,例如 mRNA 的設計和包裹疫苗的脂質納米顆粒的組成,可能會提供進一步優化 T 細胞特異性反應的機會。該研究已經確定了使用基于 mRNA 的新抗原疫苗治療胰腺癌的可行性,胰腺癌是一種以前被認為過于激進而不適合個性化治療的疾病。這些數據還強調了胰腺癌新抗原的效力,希望它們可能會導致針對這種難治性癌癥開發新的治療方案。Rojas, L.A., Sethna, Z., Soares, K.C. et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature (2023).https://doi.org/10.1038/s41586-023-06063-y