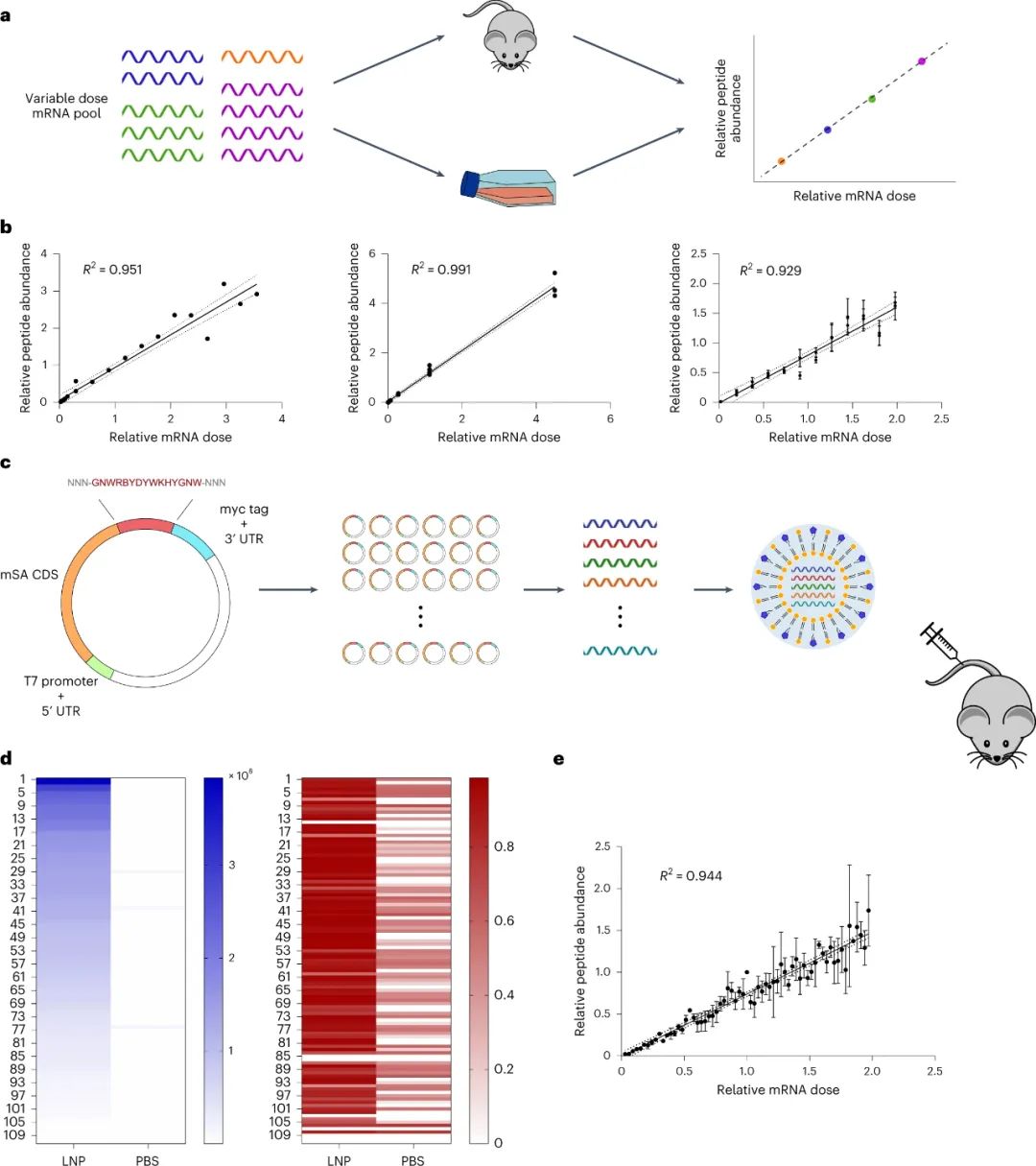
RNA療法通過直接控制體內(nèi)特定細(xì)胞內(nèi)的蛋白質(zhì)生成,在治療多種疾病方面具有巨大潛力。特別是,由于 mRNA 表達(dá)的瞬時(shí)性和合成納米顆粒 (NP) 重復(fù)給藥的可能性,使用脂質(zhì)納米顆粒 (LNP) 非病毒遞送 mRNA 是一種用于遞送治療性蛋白質(zhì)的有吸引力的方法。此外,mRNA LNPs已經(jīng)應(yīng)用于蛋白質(zhì)替代療法、疫苗接種和基因編輯以及預(yù)防COVID-19的臨床前模型。盡管取得了這些進(jìn)展,但仍然需要安全、特異和有效的傳遞載體。遞送脂質(zhì)開發(fā)的一個(gè)挑戰(zhàn)是體外研究預(yù)測體內(nèi)生物分布和療效的能力差,以及傳統(tǒng)體內(nèi)研究的低通量性質(zhì)。雖然這些問題已經(jīng)通過應(yīng)用批量分析和DNA和或RNA條形碼等方法得到了部分解決,但這些方法都有各自的缺點(diǎn),限制了它們作為臨床前研究的篩選方法。此外,雖然DNA和或RNA條形碼可以提供有關(guān)同一動物內(nèi)幾十個(gè)NPs的單獨(dú)生物分布的大量信息,但以前的研究表明,LNPs轉(zhuǎn)運(yùn)到一個(gè)特定的組織并不一定導(dǎo)致在該組織內(nèi)的表達(dá),而且,往往某種LNP積累量很低的組織的功能傳遞率會比積累量高得多的組織高得多。最近,已經(jīng)報(bào)道了一種利用LNPs與Cre mRNA和DNA條形碼共同組成的轉(zhuǎn)基因Ai14小鼠體內(nèi)篩選NPs功能mRNA傳遞的方法,稱為'FIND'。簡而言之,在這個(gè)系統(tǒng)中,成功轉(zhuǎn)染的細(xì)胞將構(gòu)成性地表達(dá)tdTomato,而與tdTomato信號共同定位的DNA條形碼可以被量化,作為功能傳遞程度的間接測量。雖然這比原來的DNA條形碼檢測有了很大的改進(jìn),但它仍然有幾個(gè)重要的局限性。例如,只要目標(biāo)細(xì)胞被單一類型的NP成功轉(zhuǎn)染,被內(nèi)化或保留在目標(biāo)細(xì)胞表面的NP就會在FIND篩選中產(chǎn)生陽性結(jié)果。這可能會導(dǎo)致誤導(dǎo)性的結(jié)果,特別是考慮到研究表明每個(gè)細(xì)胞在多個(gè)內(nèi)體中吸收多個(gè)NPs。為了避免這種 "旁觀者"效應(yīng),理想的功能傳遞的多重檢測將直接測量每個(gè)NP所影響的蛋白質(zhì)生產(chǎn)量。此外,含有mRNA條形碼和DNA條形碼的LNPs已被證明會導(dǎo)致明顯不同的生物分布,這可能導(dǎo)致額外的偏差。最后,F(xiàn)IND 依賴于轉(zhuǎn)基因 Ai14 小鼠模型的使用,排除了其在大型動物模型和 Cre-Lox 報(bào)告系統(tǒng)不可用的特定疾病模型中用作篩選系統(tǒng)。鑒于此,麻省理工學(xué)院Daniel G. Anderson等人開發(fā)了一種基于肽條形碼的篩選系統(tǒng),通過將不同的肽條形碼編碼 mRNA 包裝到每種不同類型的 LNP 中,可以同時(shí)評估同一動物體內(nèi)的多個(gè) LNP。然后可以將條形碼 LNP 合并并以單次劑量施用給同一動物,一旦在目標(biāo)組織或細(xì)胞類型中發(fā)生成功遞送的 mRNA 的翻譯,就可以用液相色譜法和串聯(lián)質(zhì)譜法(LC-MS/MS)對每個(gè)肽條形碼序列的表達(dá)進(jìn)行定量。因此,每個(gè)獨(dú)特的 LNP 配方都會產(chǎn)生自己獨(dú)特的測量結(jié)果,即在分析的組織或細(xì)胞類型中直接量化受其影響的蛋白質(zhì)生產(chǎn)。因?yàn)檫@種方法不依賴于任何報(bào)告轉(zhuǎn)基因的存在,所以它本質(zhì)上是獨(dú)立于模型的,理論上可以用于任何臨床前模型。
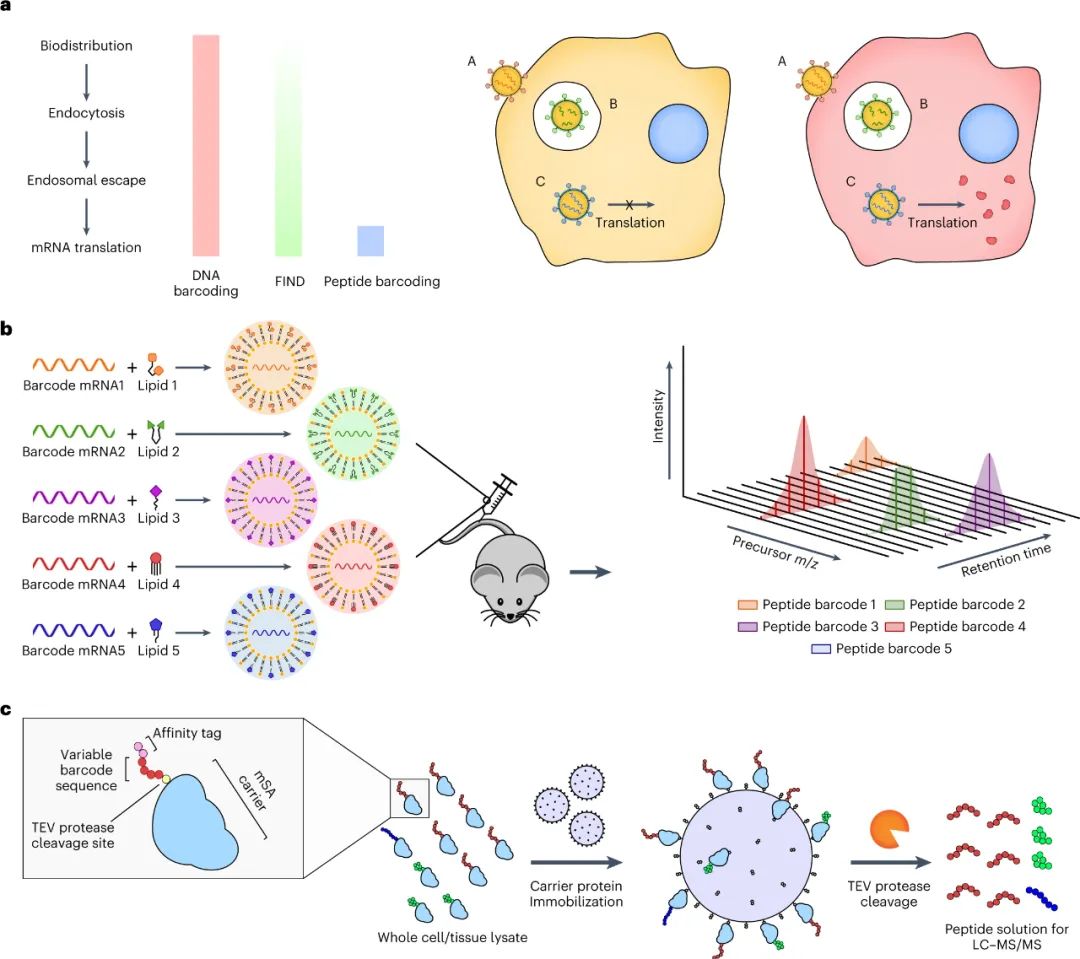
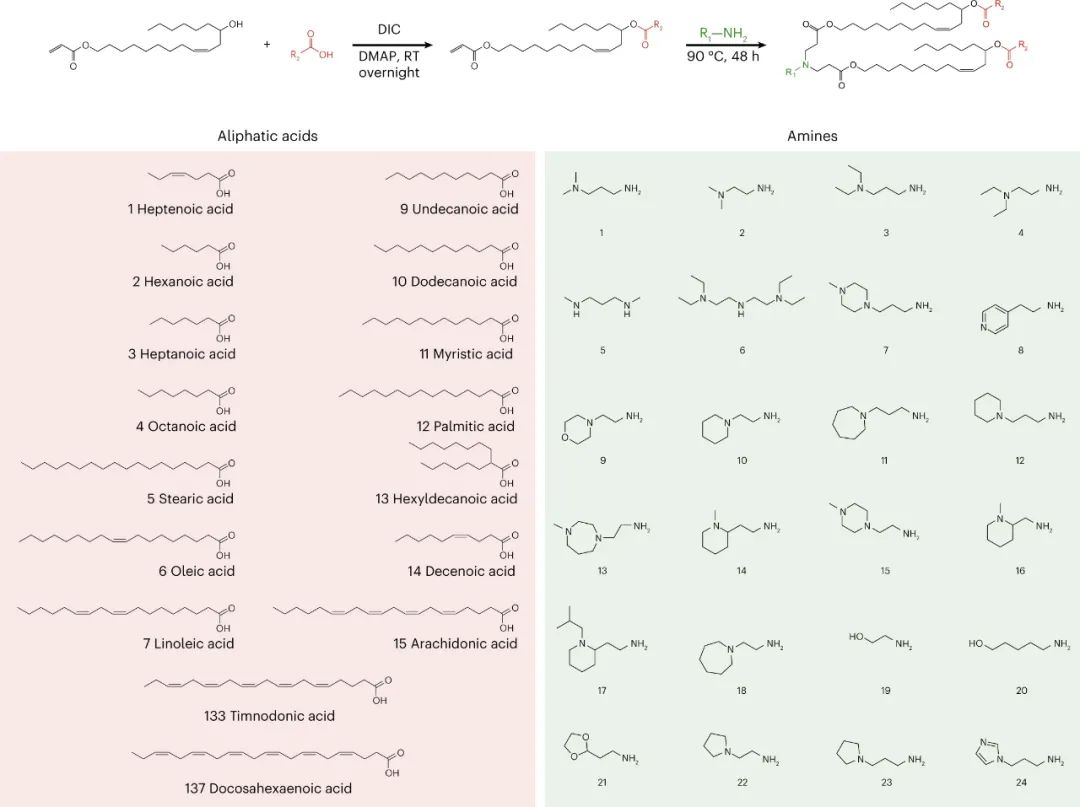
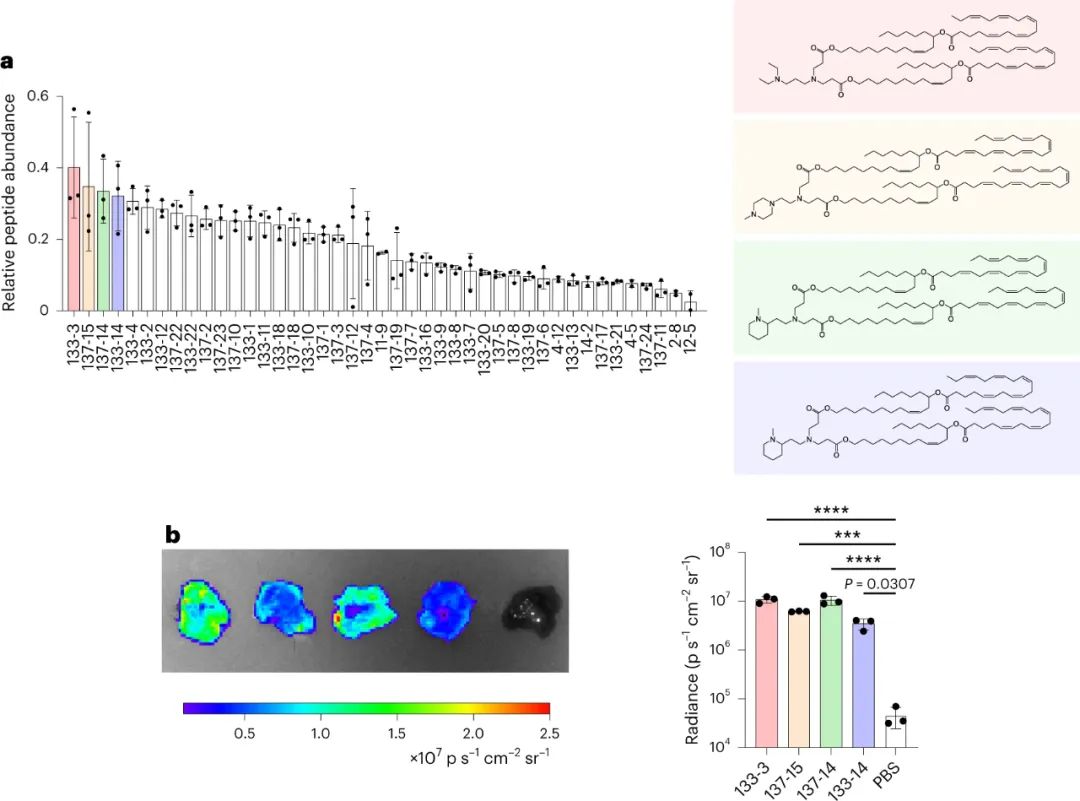
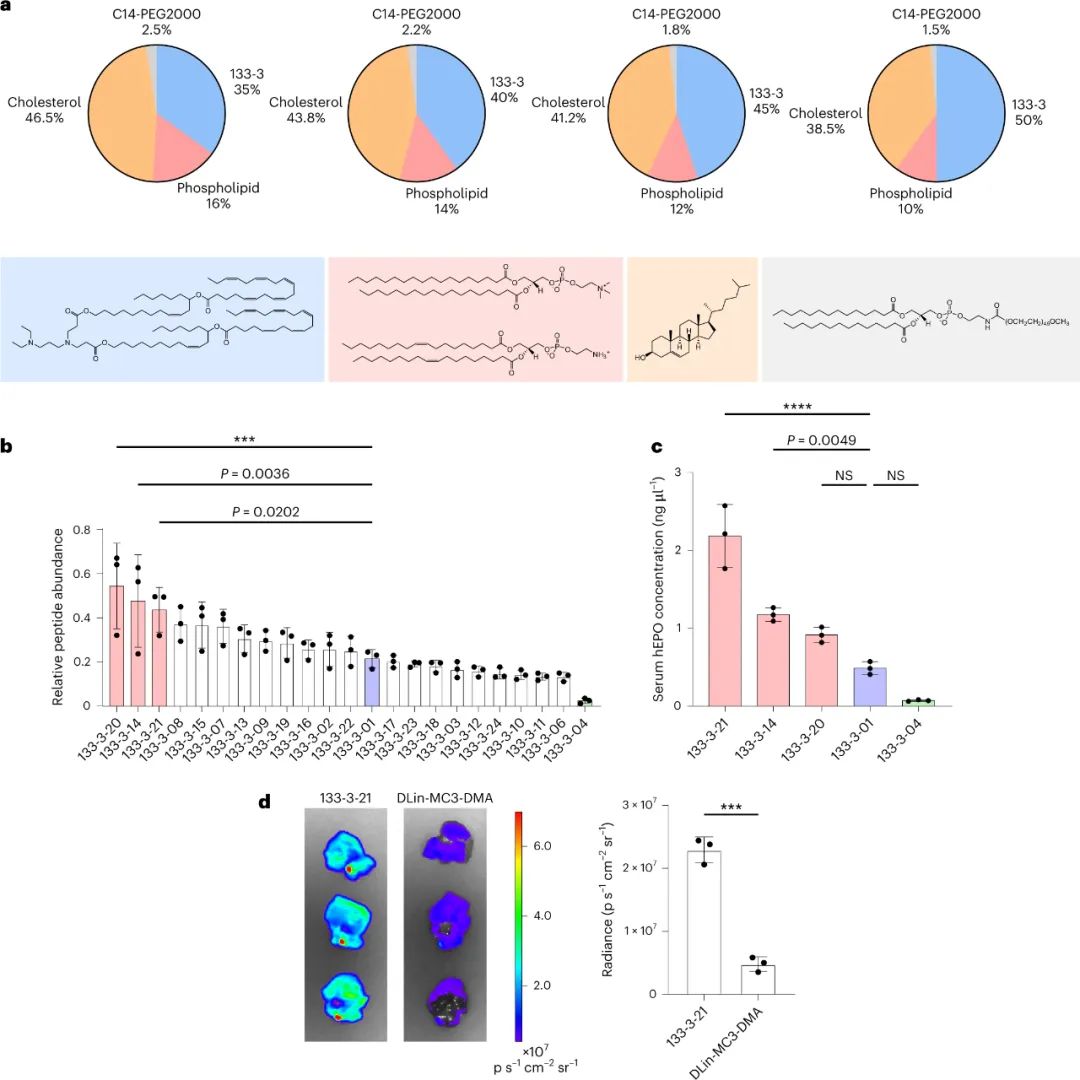
該研究團(tuán)隊(duì)開發(fā)了一種篩選功能性mRNA遞送的理想系統(tǒng),該系統(tǒng)具有模型無關(guān)性,可應(yīng)用于任何疾病的臨床前模型。該方法使用多種蛋白質(zhì)產(chǎn)生的測量方法,每種方法之間是正交的,因此可以在同一實(shí)驗(yàn)中測試多種組合,具有高靈敏度和廣泛的動態(tài)范圍。為了實(shí)現(xiàn)每個(gè)納米顆粒(NP)內(nèi)的正交功能輸出,最簡單的方法是使每個(gè)NP影響產(chǎn)生獨(dú)特的蛋白質(zhì)。通過使用包含肽條形碼編碼的mRNA制備的NP,將肽條形碼與攜帶蛋白質(zhì)融合在一起。當(dāng)這些NP功能性地遞送到靶細(xì)胞的細(xì)胞質(zhì)中時(shí),這些肽條形碼將可以通過LC-MS/MS和ELISA進(jìn)行檢測和定量。為了減少靶細(xì)胞中非條形碼蛋白的背景噪音,研究人員使用了一種單體鏈鏈鐵蛋白(mSA)作為攜帶蛋白,每個(gè)肽條形碼都與一個(gè)生物素化支架結(jié)合。研究人員首先在生物素化珠子上固定帶條形碼的mSA,然后通過煙草花葉病毒(TEV)蛋白酶將攜帶蛋白的C端末端剪切,釋放肽條形碼到溶液中。最后,將肽條形碼混合物從生物素化珠子中分離出來,并在液相色譜質(zhì)譜上進(jìn)行定量分析。研究人員證明,該方法能夠準(zhǔn)確測量不同mRNA的功能性遞送到細(xì)胞的數(shù)量。研究人員還對該方法進(jìn)行了優(yōu)化,擴(kuò)展了肽條形碼mRNA庫的大小和增加了篩選的吞吐量。圖2|肽條形碼分析的驗(yàn)證和擴(kuò)展然后,研究人員試圖證明肽條形碼可用于開發(fā)和優(yōu)化 LNP 配方。為此,研究人員使用圖 3 所示的組合反應(yīng)和組分合成了一個(gè)包含384種獨(dú)特的可電離脂質(zhì)的文庫,所有這些都具有相同的一般支化尾部結(jié)構(gòu),其中包含幾個(gè)可生物降解的酯鍵。然后,研究人員將每種離子化脂質(zhì)分別與1,2-二油酰-sn-甘油-3-磷酸酯(DOPE)、膽固醇和C14-PEG2000混合制成一個(gè)單獨(dú)的LNP,然后測試每種LNP通過肝臟蛋白產(chǎn)生的mRNA遞送效果。使用肽條形碼技術(shù),僅使用8只小鼠(每只小鼠48個(gè)獨(dú)特的LNP,不包括重復(fù)實(shí)驗(yàn))就對整個(gè)文庫進(jìn)行了篩選。為了避免可能的假陽性,他們設(shè)置了一個(gè)最小的肽點(diǎn)積閾值為0.8。在評估了384種LNP后,有43種結(jié)果的肽點(diǎn)積大于此閾值,其中大多數(shù)(43個(gè)中的37個(gè))是來自于替莫糖酸(133-)或二十二碳六烯酸(137-)。然后,他們使用螢火蟲熒光素(FLuc)試驗(yàn)驗(yàn)證了肽條形碼分析中確定的前四名結(jié)果,并發(fā)現(xiàn)當(dāng)單獨(dú)評估時(shí),所有四種 LNP 都會在肝臟中產(chǎn)生高水平的 FLuc 蛋白。圖3| 384種具有可生物降解的酯鍵和廣泛的尾部分支的可電離脂質(zhì)的合成圖4|使用肽條形碼評價(jià)可電離脂質(zhì)系列研究人員對領(lǐng)先化合物RM133-3進(jìn)行了配方的優(yōu)化,探索如何進(jìn)一步提高其性能。他們通過改變磷脂質(zhì)的身份(DOPE與DSPC),可離子脂肪酸與mRNA重量比(10、15和20)以及制劑中脂質(zhì)組分的摩爾比例來生成24個(gè)不同的肽條形碼LNP庫,并發(fā)現(xiàn)其中三個(gè)配方表現(xiàn)顯著高于原始RM133-3配方。同時(shí),研究人員發(fā)現(xiàn),含有DOPE的配方明顯優(yōu)于含有DSPC的配方。最終,他們使用FLuc實(shí)驗(yàn)驗(yàn)證了表現(xiàn)最佳的LNP,發(fā)現(xiàn)RM133-3-21的效力約為目前臨床使用的基準(zhǔn)可離子脂肪酸DLin-MC3-DMA的4.5倍。綜上所述,該研究討論了基于 LC-MS/MS 的測定法的開發(fā),該測定法用于測量同一動物體內(nèi)多個(gè)納米顆粒 (NP) 載體對 mRNA 的體內(nèi)功能傳遞。該方法使用 NPs 的肽條形碼,它是靈敏的,可以在低至 0.001 mg kg?1的劑量下檢測肝蛋白表達(dá)。然而,肽條形碼方法不能用于篩選導(dǎo)致目標(biāo)蛋白敲降的有效載荷的功能傳遞。與混合不同可電離脂質(zhì)種類相關(guān)的非線性效應(yīng)也可能發(fā)生,這可能導(dǎo)致 NP 功效等級排序的差異。該文章提出了幾個(gè)需要進(jìn)一步探索的領(lǐng)域,這些領(lǐng)域可能會提高該檢測的靈敏度、準(zhǔn)確性和通量。Rhym, L.H., Manan, R.S., Koller, A. et al. Peptide-encoding mRNA barcodes for the high-throughput in vivo screening of libraries of lipid nanoparticles for mRNA delivery. Nat. Biomed. Eng (2023).https://doi.org/10.1038/s41551-023-01030-4