特別說明:本文由學研匯技術中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。現存問題
有機化學家通常依靠以Diels-Alder反應為代表的環加成反應,或分子內環化反應,從無環前體合成環狀體系。然而,這些前體的合成通常需要多個步驟,而且環化反應本身很難促進和控制。可以通過對預成型的環狀起始物質進行修飾來構建復雜的碳環。然而,通過經典方法對這些起始材料的細化可能需要冗長的合成序列,以將反應性從先前存在的功能傳遞到所需的功能化位點。C-H活化提供了另一種斷開連接的方法,可以繞過這一限制,并能夠快速有效地獲得各種功能化環支架,但這種方法的一般適用性取決于近端和遠端C-H鍵的位點選擇性功能化方法的發展(圖1a)。但目前在近端存在競爭的碳氫鍵的情況下,實現對遠端官能化的選擇性仍然是一個主要的挑戰。基于大環烷的定向模板的最新進展為控制(雜)芳環的C(sp2)-H的遠程活化提供了一種解決方案。但飽和化合物C-H功能化的方法在很大程度上僅限于激活環系統的近端位點。一些跨環的C-H活化已經被報道過,但其中絕大多數是通過5元鈀環進行的,這就需要在環內或直接連接到環上的氮原子才能到達遠端的C-H鍵(圖1b)。此外,由于亞甲基C-H活化的挑戰性,幾乎所有關于跨環功能化的報道都采用了預安裝的雙齒導向基團,這限制了轉化的范圍和下游衍生化產物的機會。因此,必須開發一種通用的和原生官能團導向的方法來實現簡單的單環底物的跨環功能化。
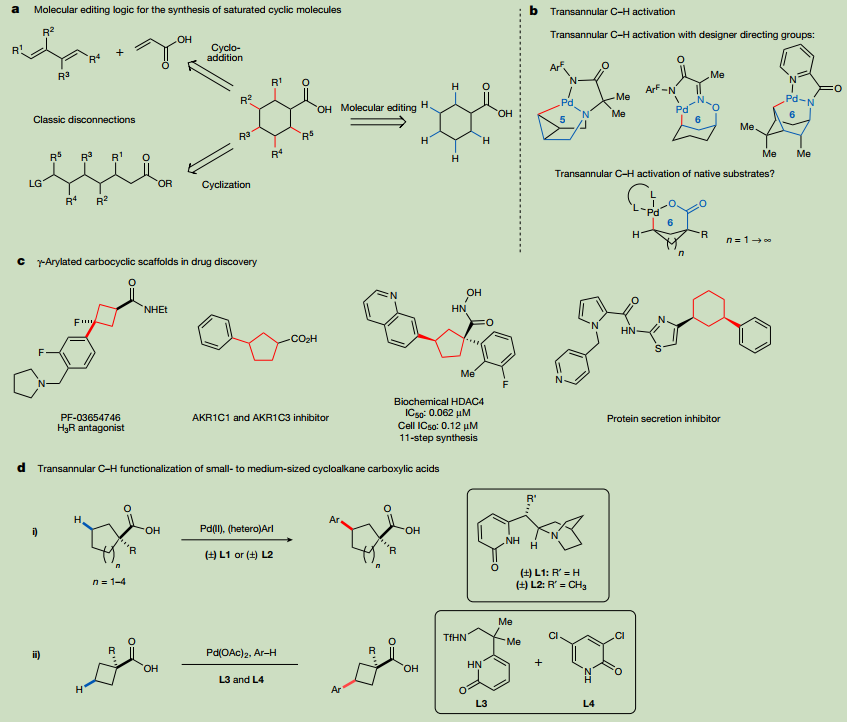
基于此,美國加州斯克里普斯研究所余金權教授團隊報告了實現飽和碳環支架最終分子編輯的第一步:中小型環烷烴羧酸的γ-選擇性跨環C-H基化的發展(圖1d)。喹啉吡啶配體使羧酸底物從環戊烷到環辛烷環的跨環γ-芳基化成為可能。環丁烷羧酸的跨環芳基化是通過酸底物和簡單芳烴偶聯體的雙碳氫活化實現的。這些轉化在通常反應性更高的β-C-H鍵的存在下,對γ-位置的跨環芳基化表現出極好的選擇性,為獲得有價值的化合物家族提供了便利。值得注意的是,γ-芳基化環烷酸及其衍生物可以顯示出重要的生物活性,這使得這種轉化對藥物化學特別有價值(圖1c)。論文以《Transannular C–H functionalization of cycloalkane carboxylic acids》題發表在Nature上。

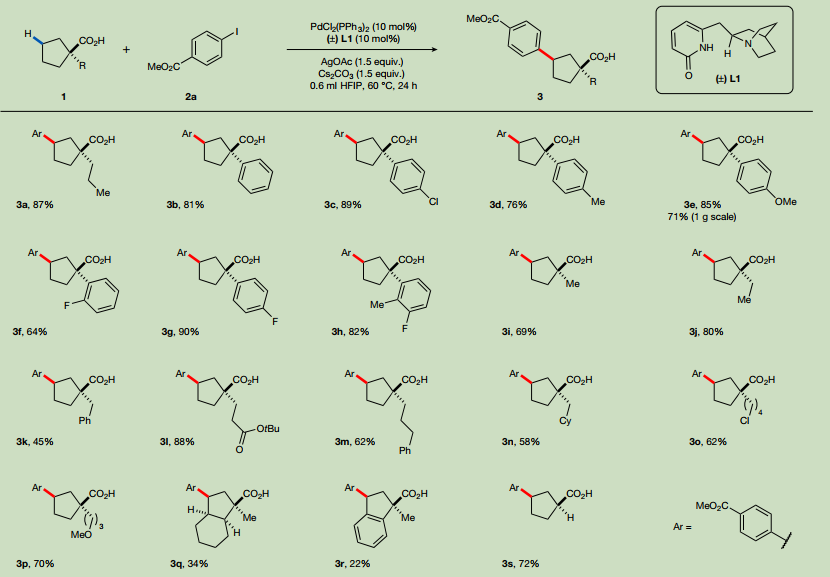
研究以α-丙基環戊烷羧酸1a為模型基態,進行跨環碳氫基化的研究。研究發現觀察到喹啉-吡啶酮配體能夠激活游離酸的β-和γ-亞甲基C-H,以30%的收率提供所需的γ-芳基化產物。喹嘌呤-吡啶酮配體L1在促進跨環γ-芳基化方面具有獨特的效果,其產物3a的產率為69%。進一步優化能夠以87%的分離收率獲得所需的γ-芳基化產物。通過改變環烷烴羧酸的結構和環尺寸以及雜芳基碘化物偶聯體的身份,研究了跨環碳氫功能化的普遍性。首先檢查了α-季環戊烷羧酸的底物范圍(圖2)。無論芳基環上的電子性質如何,都能提供良好到優異的跨環γ-C(sp3)-H芳基化產物。沒有觀察到γ-C(sp2)-H或β-C(sp3)-H的芳基化產物,表明該反應具有良好的區域選擇性。該反應也有良好的可擴展性。
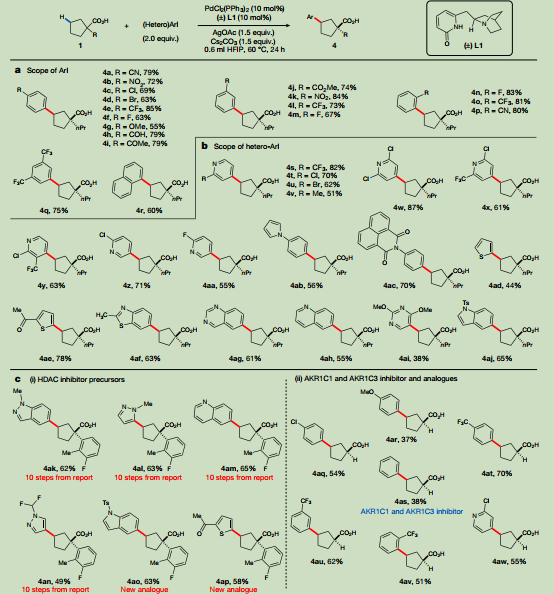
進一步使用α-丙基環戊烷羧酸作為模型底物,檢查了芳基碘化物(ArI)偶聯的范圍(圖3a)。廣泛的電子可變對取代芳基碘化物與該方案兼容,提供55-85%收率的跨環芳基化產物。缺電子的芳基碘化物的產率略高于有給電子基團的芳基碘化物。間位和鄰位取代芳基碘化物在反應中也表現良好。值得注意的是,噻吩-、苯并噻唑-、喹唑啉-、喹啉-、嘧啶-和吲哚基雜芳基碘化物都是γ-芳基化反應中成功的偶聯成分,其中2-乙酰基-5-碘噻吩的產率最高(78%)。2,4-二甲氧基-5-碘嘧啶的產率僅為38%,這可能是由于二甲氧基具有很強的給電子作用。通過制備幾種已報道的組蛋白去乙酰化酶(HDAC)抑制劑前體(圖3c),證明了該方案在藥物化學方面的潛力。利用跨環γ-C-H芳基化反應,外消旋4ak及其類似物4al-4an可以很容易地從市售的α-芳基環戊烷羧酸中以49-65%的收率得到單對映體。值得注意的是,α-芳基化環戊烷羧酸4am的酰胺化提供了有效的HDAC抑制劑,其半最大抑制濃度值低至0.062 μm(圖1c)。與先前報道的途徑相反,跨環碳氫活化化學提供了非對映控制,并且允許芳基取代基的變化。
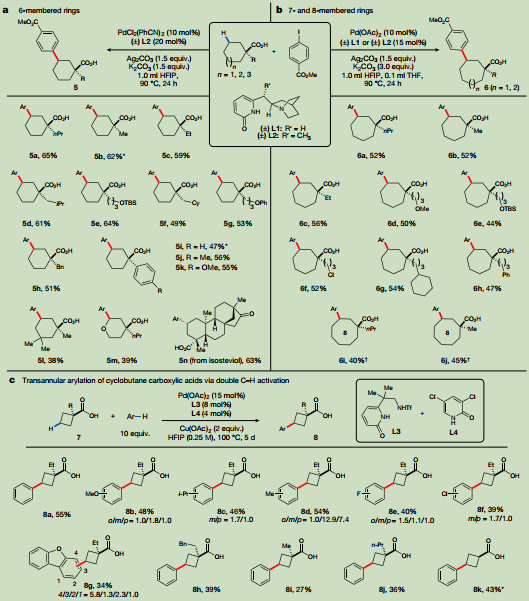
研究了較大和較小的環烷烴羧酸的跨環γ-C-H芳化(圖4)。確定的環戊烷羧酸芳化α-丙基環己烷羧酸的最佳條件,γ-芳化產物的收率僅為35%。經過對配體和反應條件的簡單優化,發現L2可以以65%的分離產率提供所需的產物。檢查了環己烷羧酸的跨環γ-芳基化的底物范圍(圖4a)。對于含有多個潛在反應位點的底物進行研究,均可以觀察到良好的區域選擇性。含四氫吡喃的底物的跨環芳基化進展順利,這表明該方法可以應用于一些飽和雜環的功能化。對代表性的α-烷基和α-芳基環己烷羧酸進行X射線晶體分析,證實了環己烷產物的結構和相對立體化學性質。7元和8元環烷烴羧酸也實現了跨環γ-C-H基化,相應的產物產率中等至較高(圖4b)。由于小環的剛性,預計環丁烷羧酸的跨環芳基化將是最具挑戰性的。當α-乙基環丁烷羧酸按照環戊烷羧酸的反應條件進行反應時,只會生成不需要的β-芳基化產物。檢查環丁烷羧酸γ-芳基化反應的范圍。模型α-乙基環丁烷底物與一系列電子中性至富電子芳烴反應有效。缺乏電子的芳烴偶聯伙伴導致產率有所降低。芳烴的間位和對位烷基化之間只有適度的選擇性,但除電子偏置芳烴外,鄰位官能化是強烈不受歡迎的。此外,環丁烷羧酸上α-取代基的變化是可以容忍的。
小結
研究實現了環烷烴羧酸與喹啉-吡啶酮配體(L1,L2)的跨環γ-亞甲基C-H甲基化,并通過磺酰胺-吡啶酮配體(L3)和單齒吡啶酮(L4)的雙C-H活化。環尺寸從4到8的各種環烷烴羧酸是與各種(雜)碘化芳基/芳烴偶聯伙伴反應的有效底物。優異的區域選擇性表明,底物含有多個潛在位點的C-H活化。因此,這些反應提供了獲得γ-芳基化環烷烴酸的一般和直接途徑。預計這種方法將簡化γ-芳基化環烷烴的合成,有助于推動新療法的設計和發現。https://doi.org/10.1038/s41586-023-06000-zGuowei Kang et al. Transannular C–H functionalization ofcycloalkane carboxylic acids.Nature (2023).DOI:10.1038/s41586-023-06000-z










