大多數(shù)人類脊髓損傷 (SCI) 病例在解剖學上是不完整的,這意味著損傷附近、上方和下方的神經(jīng)元回路中的某些連接得以保留。然而,至少有兩個主要的病理過程會阻止這些備用連接發(fā)揮作用。首先,創(chuàng)傷性損傷導致的細胞死亡和血管破裂會引發(fā)炎癥,并通過一個稱為繼發(fā)性損傷的過程產(chǎn)生活性氧(ROS)等細胞毒性因子,進一步損害原發(fā)性損傷中未發(fā)生的脊柱連接,加劇功能缺陷。
在過去的十年中,人們付出了巨大的努力來開發(fā)可以挽救幸免的脊柱連接的保護性治療策略,例如神經(jīng)保護材料的移植。然而,這些程序可能會進一步損傷受傷的脊髓并導致不可預(yù)測的副作用。其次,SCI 會引發(fā)興奮性的巨大變化,破壞受損脊髓中神經(jīng)回路的整體平衡。先前的研究報道,通過 KCC2 的基因激活抑制作用的抑制性而非興奮性中間神經(jīng)元,可以增加整體興奮性,并將最初休眠的中繼或內(nèi)源性脊髓回路轉(zhuǎn)變?yōu)?SCI 后的功能狀態(tài)。然而,這種策略在臨床可轉(zhuǎn)化的 SCI 模型中是否有效尚不清楚。此外,選擇性靶向抑制性神經(jīng)元并改變其活性的微創(chuàng)藥理學方法的發(fā)展仍然是該策略臨床應(yīng)用的瓶頸。
將藥物偽裝成神經(jīng)遞質(zhì)可以促進它們輸送到合成這些神經(jīng)遞質(zhì)的神經(jīng)元中。因此,浙江大學王緒化等人假設(shè)可以使用類似的策略來遞送靶向抑制性中間神經(jīng)元的藥物。具體而言,研究人員將藥物CLP-257與γ-氨基丁酸(GABA)或多巴胺偶聯(lián),后者是一種經(jīng)驗證的KCC2激活劑,可降低細胞內(nèi)氯離子濃度并降低神經(jīng)元興奮性,據(jù)報道在運動控制中發(fā)揮重要作用。

為了促進微創(chuàng)給藥和 ROS 響應(yīng)性釋放,研究人員設(shè)計并合成了一種具有聚乙二醇(PEG)基親水鏈段和具有硼基ROS清除劑的疏水鏈段的兩親性嵌段共聚物,以包封疏水性前藥。這些基于膠束的納米藥物可以靜脈注射,并且 ROS 響應(yīng)性地在損傷部位釋放前藥。該藥理學方法在患有 SCI 的大鼠中引起了實質(zhì)性的功能恢復,表明了針對 SCI 和其他神經(jīng)系統(tǒng)疾病的治療有希望的方向。
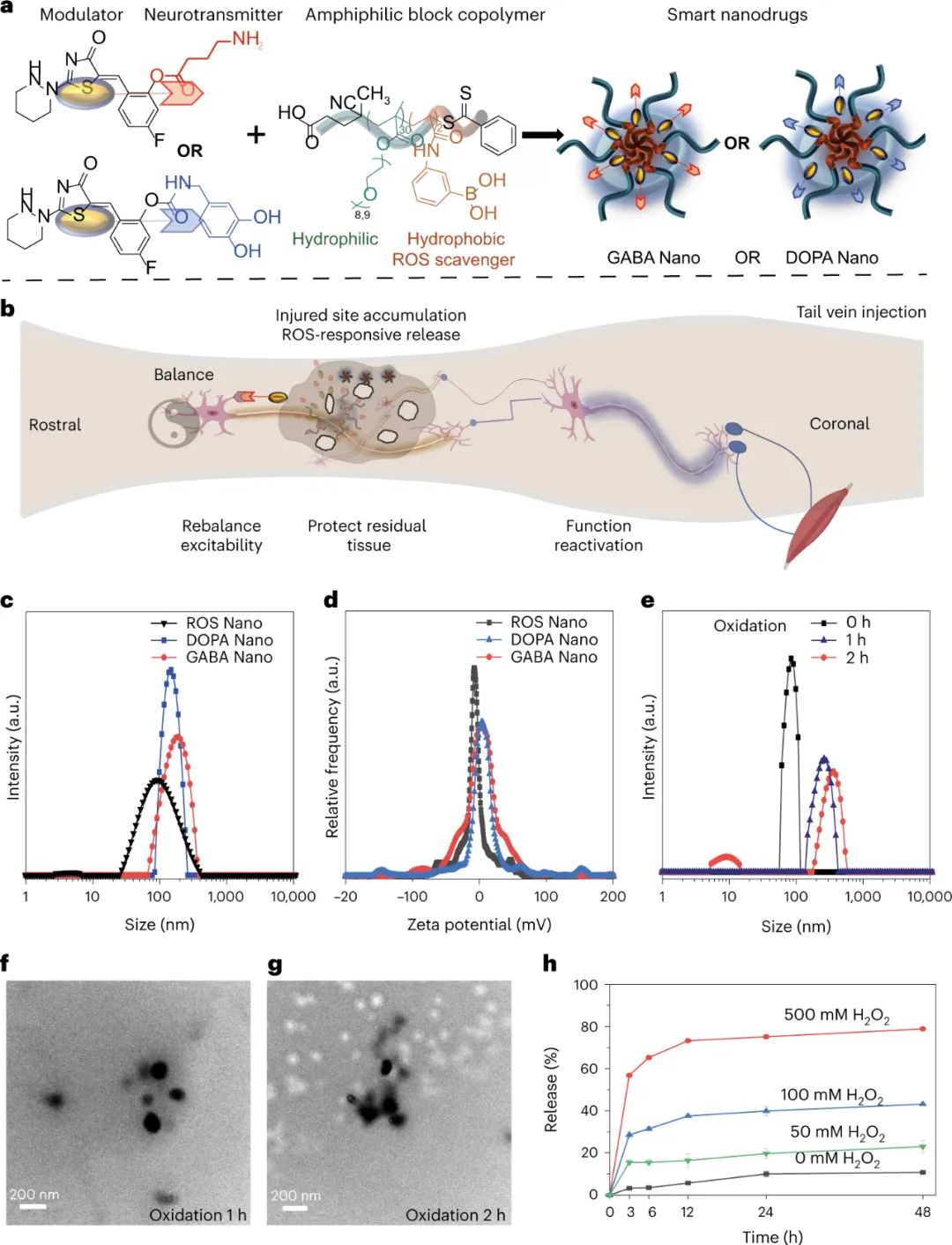
圖|智能納米藥物的設(shè)計和表征
為了驗證納米載體的ROS響應(yīng)性,研究人員在大鼠身上使用了嚴重挫傷性 SCI 模型,并給予了載有前藥 GABA 和多巴胺鹽酸鹽 (DOPA) 的納米藥物。使用熒光染料 Cy5.5 研究了納米藥物的分布和釋放曲線。結(jié)果表明,納米藥物在注射后不久就在脊柱病變部位周圍聚集,約6小時達到最大濃度,并持續(xù)48小時。分布分析揭示了在鄰近病變的延髓區(qū)域的聚集偏好,這可能是由于脊髓血管閉塞。進一步的分析包括對帶有 GABA 能和多巴胺能神經(jīng)元標記的脊髓切片進行免疫染色。共定位分析表明,很大一部分用 GABA Nano 或 DOPA Nano 標記的細胞確實是目標神經(jīng)元。定量分析表明,大約 80% 的標記細胞是預(yù)期的目標神經(jīng)元。納米藥物表現(xiàn)出高選擇性和效力,毒性極小。
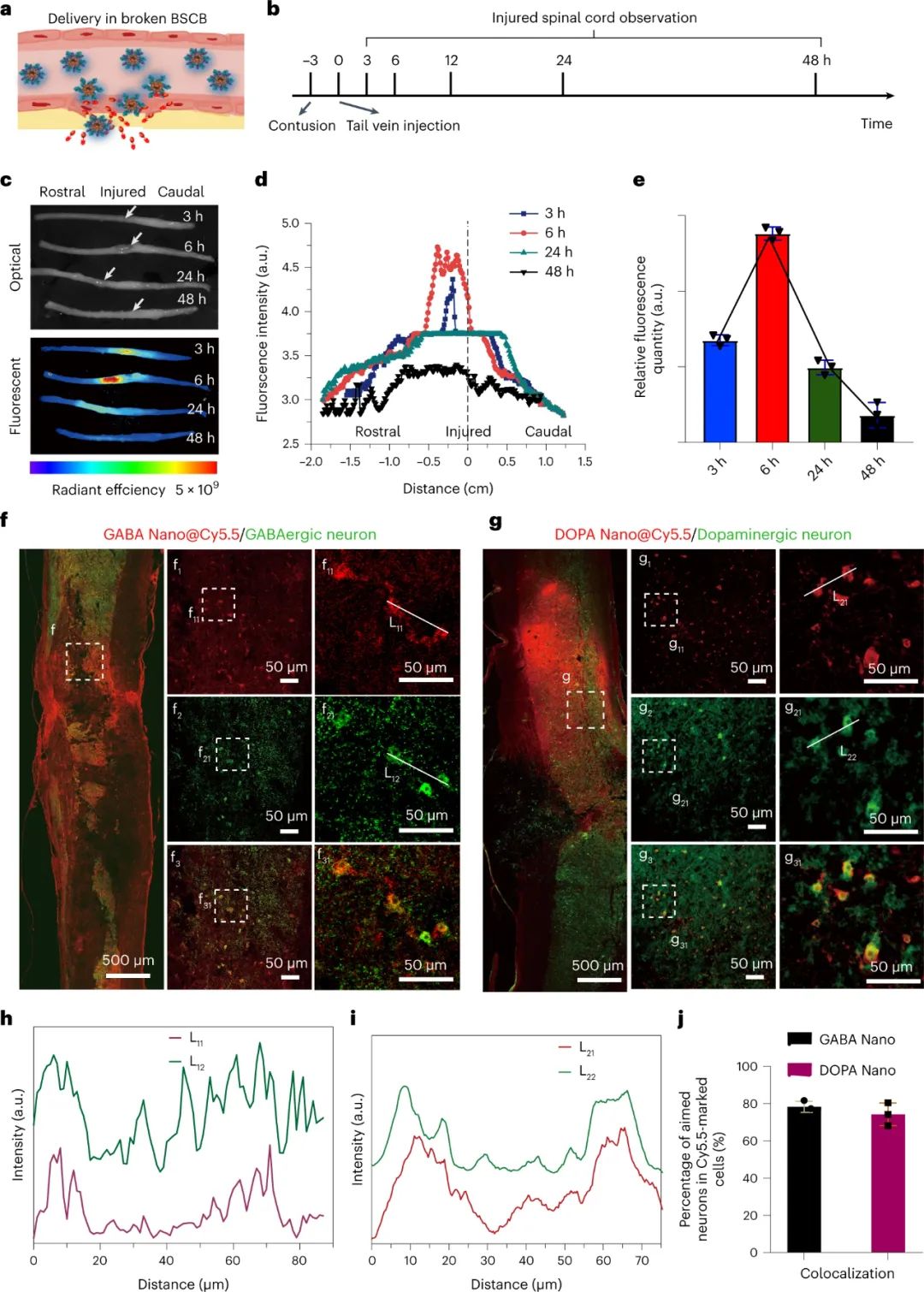
圖|智能納米藥物在脊髓損傷部位積聚,并選擇性地靶向特定神經(jīng)元
此外,研究發(fā)現(xiàn),即使在脊髓損傷晚期,納米藥物可以通過響應(yīng)ROS釋放藥物前體,滲透到受損脊髓中。研究人員觀察到納米藥物可以將熒光染料運送到受損脊髓的鄰近區(qū)域,尤其在SCI后7天注射的大鼠中熒光強度最高。這種現(xiàn)象與預(yù)期相反,但解釋是藥物穿透與納米粒子解聚和釋放小分子藥物的效率相關(guān)。研究還發(fā)現(xiàn)納米藥物優(yōu)先靶向神經(jīng)元而不是星形膠質(zhì)細胞,并能在恢復的血脊髓屏障(BSCB)中滲透,而在未受損的脊髓中沒有觀察到熒光。這些結(jié)果表明,該藥物傳遞系統(tǒng)可以在脊髓損傷晚期將疏水性小分子化合物送入脊髓。
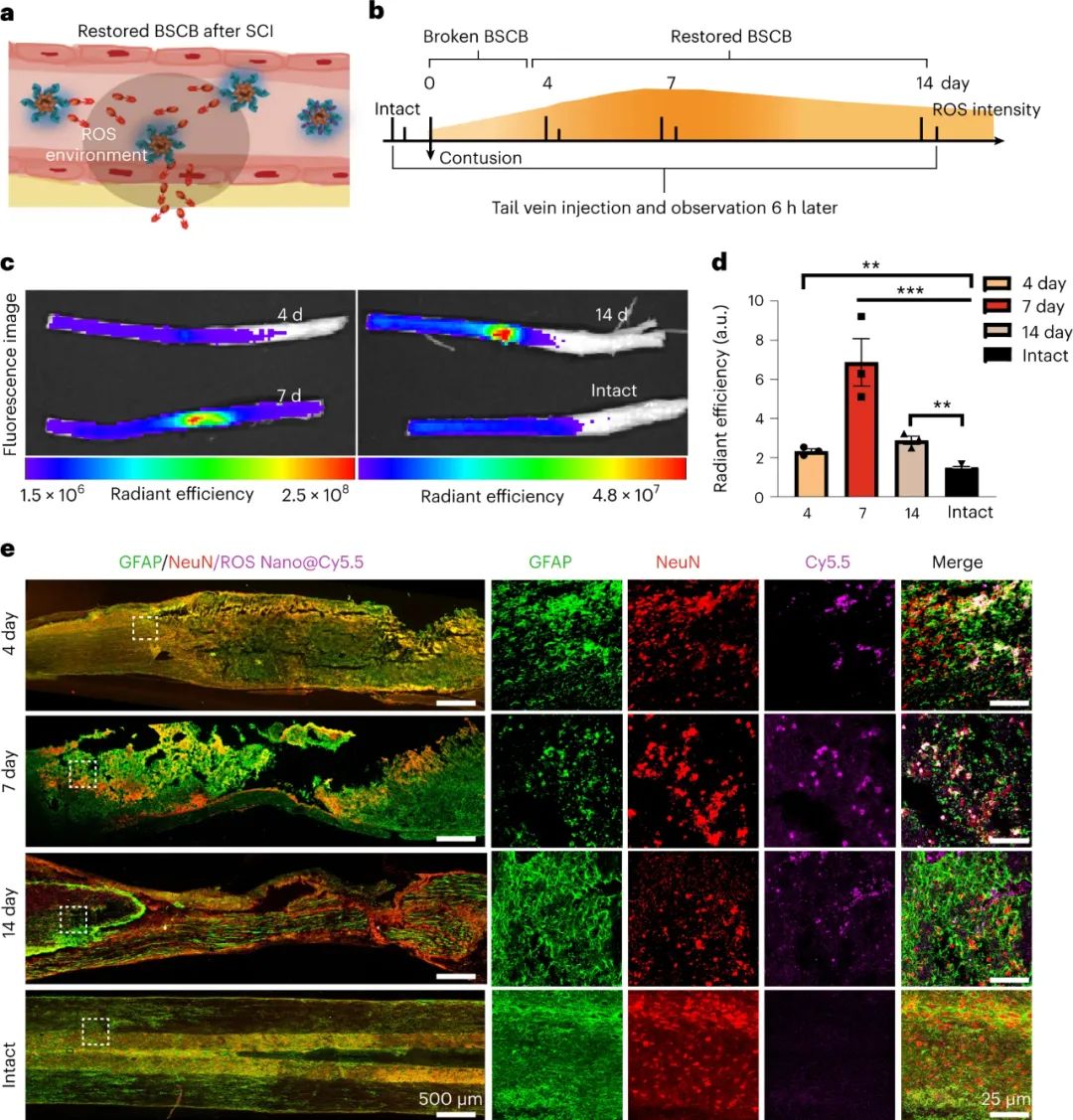
圖|ROS響應(yīng)性納米藥物遞送系統(tǒng)即使在BSCB恢復后也能將小分子遞送到脊髓中
研究結(jié)果表明,經(jīng)過納米藥物治療的大鼠在脊髓損傷后9周,與對照組相比,脊髓形態(tài)變形明顯減少。對脊髓切片進行H&E染色顯示,治療組的囊性腔明顯較小。進一步定量分析發(fā)現(xiàn),在PBS治療組,腔體占據(jù)了約27.3%的脊髓體積,而在ROS納米粒子治療組,腔體體積僅為PBS治療組的一半左右,約為15.8%。此外,治療組顯示了更多的灰質(zhì)和減少的病理組織。此外,通過追蹤下行軸突,研究發(fā)現(xiàn)ROS納米粒子治療組的大鼠下行軸突數(shù)量明顯增加。這些數(shù)據(jù)進一步驗證了納米藥物治療脊髓損傷的神經(jīng)保護效果。
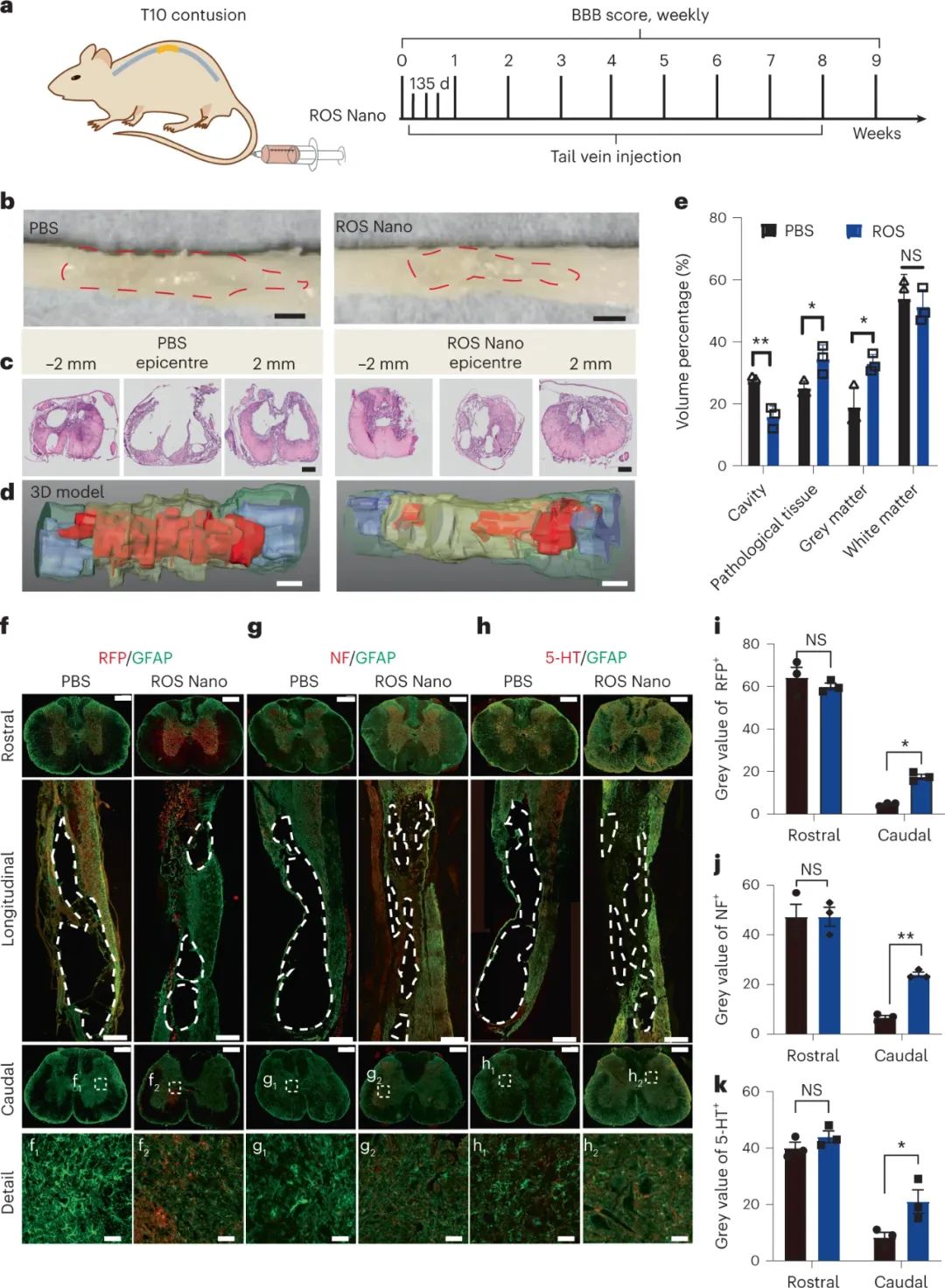
圖|ROS納米治療保護備用組織/軸突免受二次損傷
研究人員發(fā)現(xiàn),在脊髓損傷后使用神經(jīng)元靶向治療可以改善下肢運動功能。他們發(fā)現(xiàn),GABA納米粒子治療在嚴重脊髓損傷模型中顯著改善下肢步態(tài)功能,而DOPA納米粒子治療則僅能引起踝關(guān)節(jié)運動。詳細分析顯示,接受GABA納米粒子治療的大鼠在體重支撐、足趾高度和踝關(guān)節(jié)振幅等方面有顯著改善。肌肉電圖記錄顯示,接受GABA納米粒子治療的大鼠的踝關(guān)節(jié)肌肉顯示出一定的活動。這表明GABA納米粒子治療通過神經(jīng)保護和神經(jīng)調(diào)節(jié)作用協(xié)同作用,促進了功能恢復。
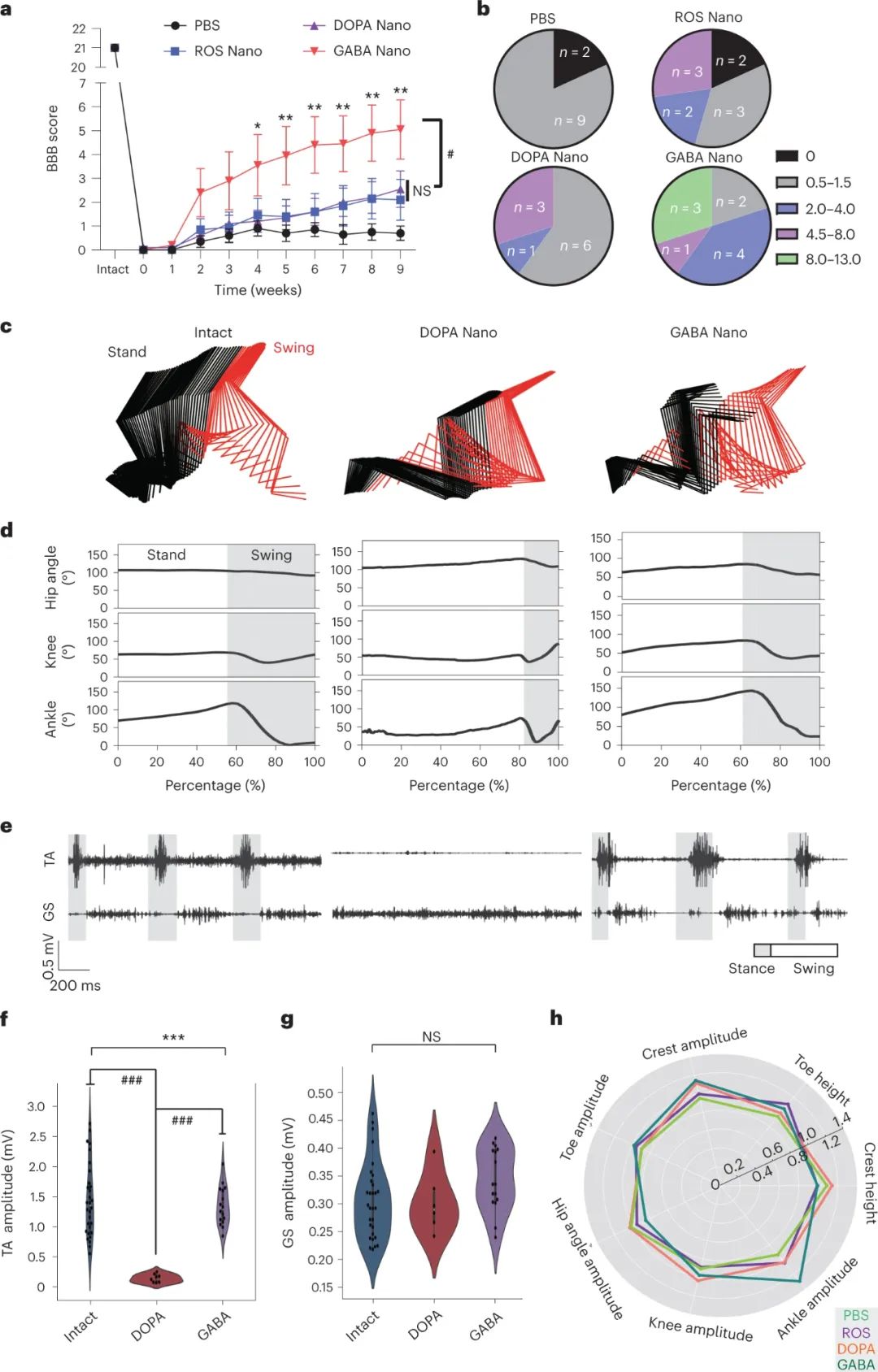
圖|GABA納米治療可改善嚴重挫傷性脊髓損傷大鼠后肢運動功能的恢復
最后,研究人員發(fā)現(xiàn),GABA納米粒子治療通過減少抑制性中間神經(jīng)元的興奮性,在脊髓損傷后促進功能恢復。他們利用c-Fos蛋白免疫反應(yīng)作為檢測脊髓中間神經(jīng)元活動的指標。結(jié)果顯示,GABA納米粒子治療降低了T8背角中c-Fos陽性神經(jīng)元的密度,并增加了中間和腹側(cè)脊髓中的存在,使其與原始神經(jīng)元的分布更加接近。此外,GABA納米粒子治療還顯著增加了L2節(jié)段中的c-Fos陽性神經(jīng)元數(shù)量。這些結(jié)果表明,GABA納米粒子治療能夠改變脊髓損傷引起的不規(guī)則活動模式,使得保存的神經(jīng)回路能夠與脊髓局部回路相互融合,并重新參與腰骶中樞模式生成器的功能。
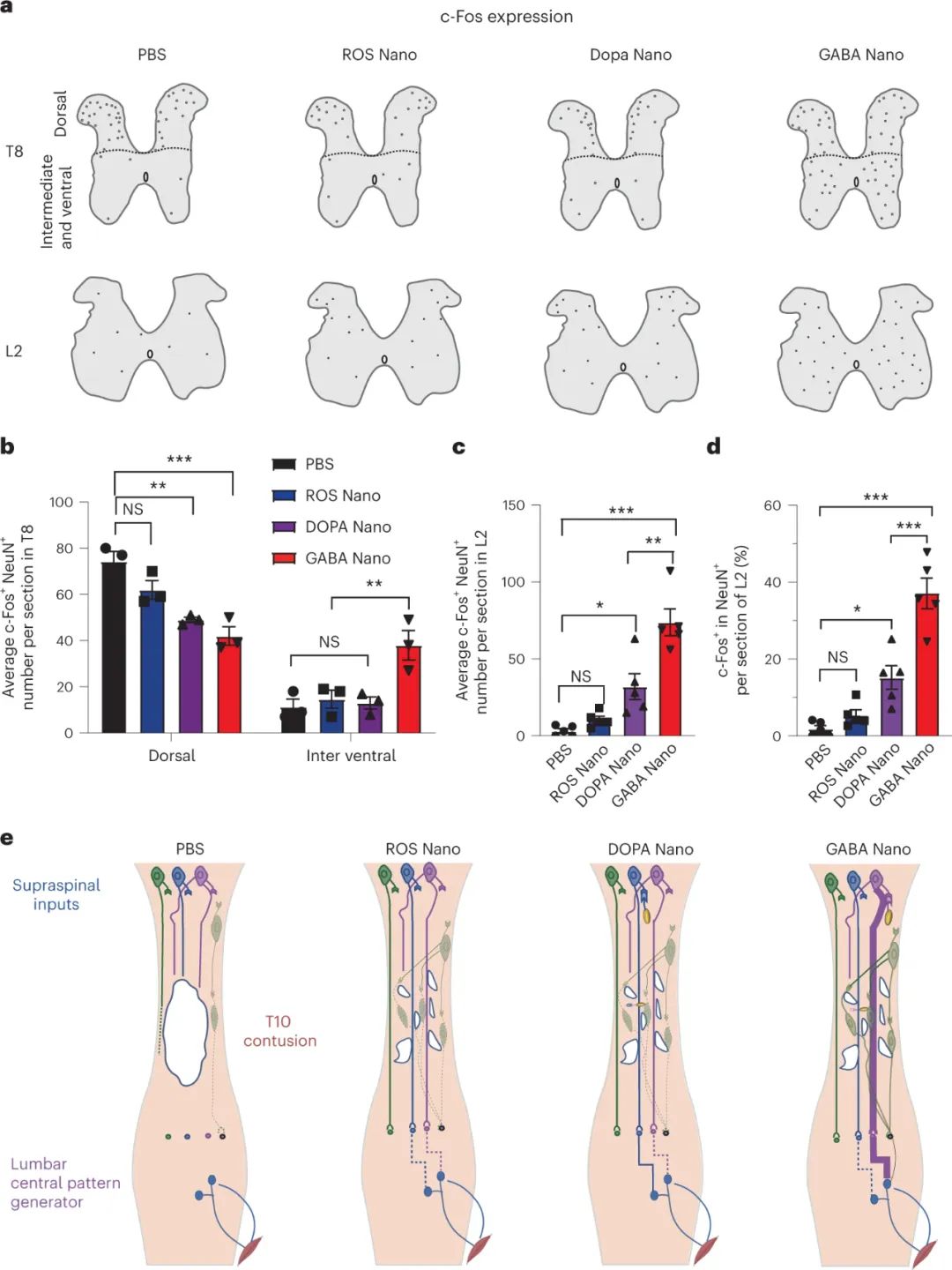
圖|GABA納米治療可重新平衡神經(jīng)元活動,并激活挽救的殘余脊髓回路以發(fā)揮功能
綜上所述,本文提供了一種納米系統(tǒng),用于在 SCI 治療中將藥物輸送到脊髓,并提出了一種開創(chuàng)性的藥理學方法,通過靶向特定神經(jīng)元亞型、保護幸存組織和重新平衡神經(jīng)調(diào)節(jié)作用來治療 SCI。這允許源自損傷部位保存的軸突和中間神經(jīng)元的脊髓回路正確地整合到脊柱網(wǎng)絡(luò)中并觸發(fā)后肢運動。雖然 CLP-257 已被證明可以穿透 BSCB,但在進入臨床試驗之前,將納米藥物系統(tǒng)的遞送效率與裸 CLP-257 藥物的遞送效率進行比較至關(guān)重要。
參考文獻:
Zuo, Y., Ye, J., Cai, W. et al. Controlled delivery of a neurotransmitter–agonist conjugate for functional recovery after severe spinal cord injury. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01416-0











