光驅動癌癥療法(例如光動力療法(PDT))的出現引起了越來越多的興趣。與傳統化療相比,這些光激活治療具有多種獨特的優勢,包括時間和空間上可控的激活、不與化療藥物產生交叉耐藥性以及微創性。迄今為止,這些 PDT 藥物的治療效果非常有希望。幾種作為 PDT 活性劑的光敏劑 (PS) 已被批準用于臨床癌癥治療,還有許多其他藥物正在進行臨床試驗。
典型的 PS 會間接損害生物分子:需要氧氣來產生活性氧 (ROS) 以誘導細胞死亡。然而,大多數實體瘤組織具有缺氧微環境的特點,這極大地限制了傳統PS的抗癌功效。盡管某些 I 型 PS 并不完全依賴氧氣來產生 ROS,但這些試劑仍然不能通過直接破壞細胞內生物分子來殺死細胞。因此,所產生的 ROS的細胞損傷效率仍然會受到低水平的氧氣、內源性細胞內還原劑和 PS 有限的量子產率的影響。此外,這些PDT藥物的進一步應用仍然受到其短波長激發光相對較低的組織穿透能力的限制。除此之外,癌細胞有多種機制可以恢復被 PS 產生的 ROS 破壞的細胞內氧化還原平衡,從而在使用傳統 PS 時導致耐藥性問題。除了細胞內氧化還原平衡外,其他類型的細胞內穩態如細胞內pH(intracellular pH, pHi)也可以通過協同機制來解決耐藥問題;癌細胞相對較高的pHi不僅有利于癌癥的增殖、轉移和侵襲性,而且還會導致治療耐藥性。
因此,開發能夠直接氧化細胞內成分并以不依賴于氧的方式有效破壞pHi 穩態來消除癌細胞的長波長光激活抗癌藥物不僅有望解決傳統 PDT 藥物的局限性,還有望降低癌癥惡性度。
開發可以雙光子激發(TPE)方式激發的化合物已被證明是延長激發波長的有效策略。鑒于此,香港城市大學朱光宇、何明亮等研究人員將此策略應用于可光活化的Pt(IV)配合物。

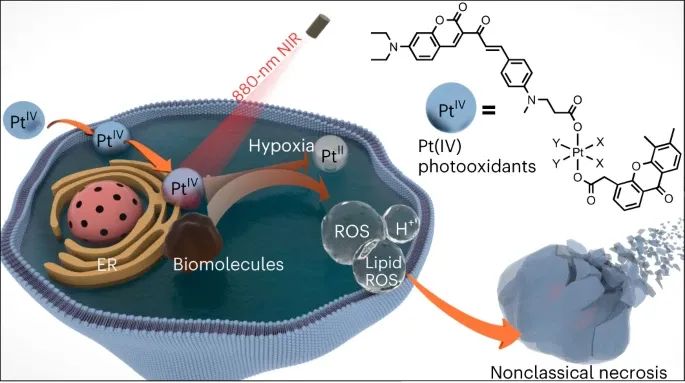
示意圖
設計、合成、表征和光化學
首先,研究人員設計和合成了一種基于香豆素的光敏配體(配體3),可以通過880納米激光進行雙光子激發。已有研究表明,將過渡金屬引入光敏劑可提高光動力療法效率,并產生更多的激發態電子構型。研究人員將配體3與Pt(IV)配合物結合,以獲得改進的近紅外激活Pt(IV)配合物。合成了兩個配合物5a和5b,并證明它們在細胞中具有高穩定性和高效的光活化。這是首次實現通過雙光子激發的近紅外光活化小分子Pt(IV)配合物。
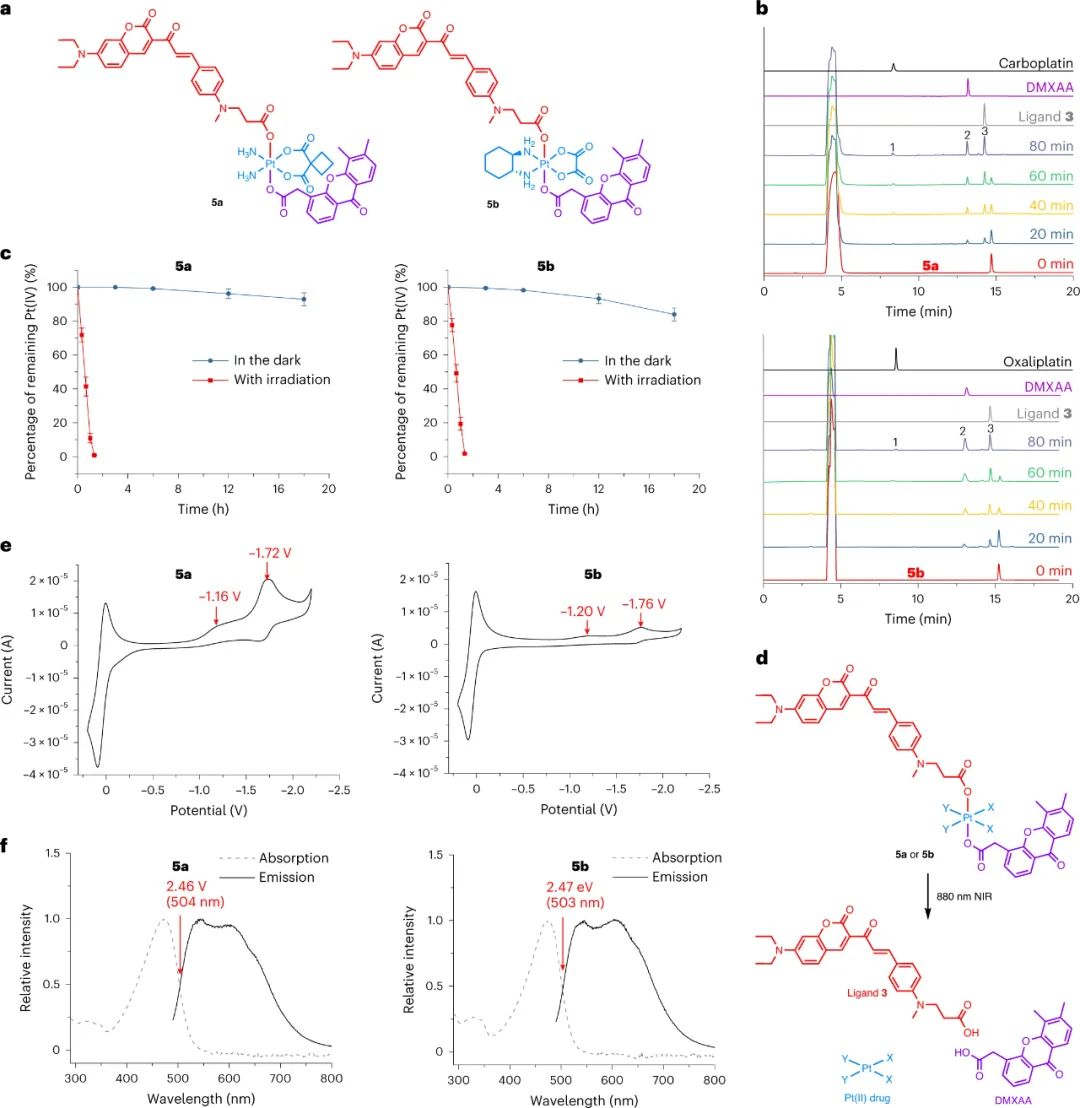
圖|5a和5b的光活化和電化學性質
電化學和光氧化性能
激發態還原電位實驗表明,與鉑的綴合可以顯著增強有機光敏配體的光氧化能力。由于它們顯示出強大的光氧化劑潛力,研究人員進一步測量了它們的光氧化能力。研究人員假設在生物環境中,常規生物分子很可能充當電子給體,并被Pt(IV)配合物氧化。為了證實這一假設,研究人員研究了5a和5b對多種生物分子的氧化能力,包括NADH、血紅素、DNA、牛血清白蛋白(BSA)和細胞裂解液中的蛋白質。總體而言,5a和5b能夠有效地氧化這些生物分子,即使在沒有氧氣的情況下。實驗結果證實了將鉑引入有機光敏配體中不僅極大地提高了配體的光動力療法效率,而且賦予了所得配合物氧獨立的光氧化能力。研究人員將這種效應稱為金屬增強型光氧化,并預期這種強大的光氧化能力可能導致增強的抗癌效果。
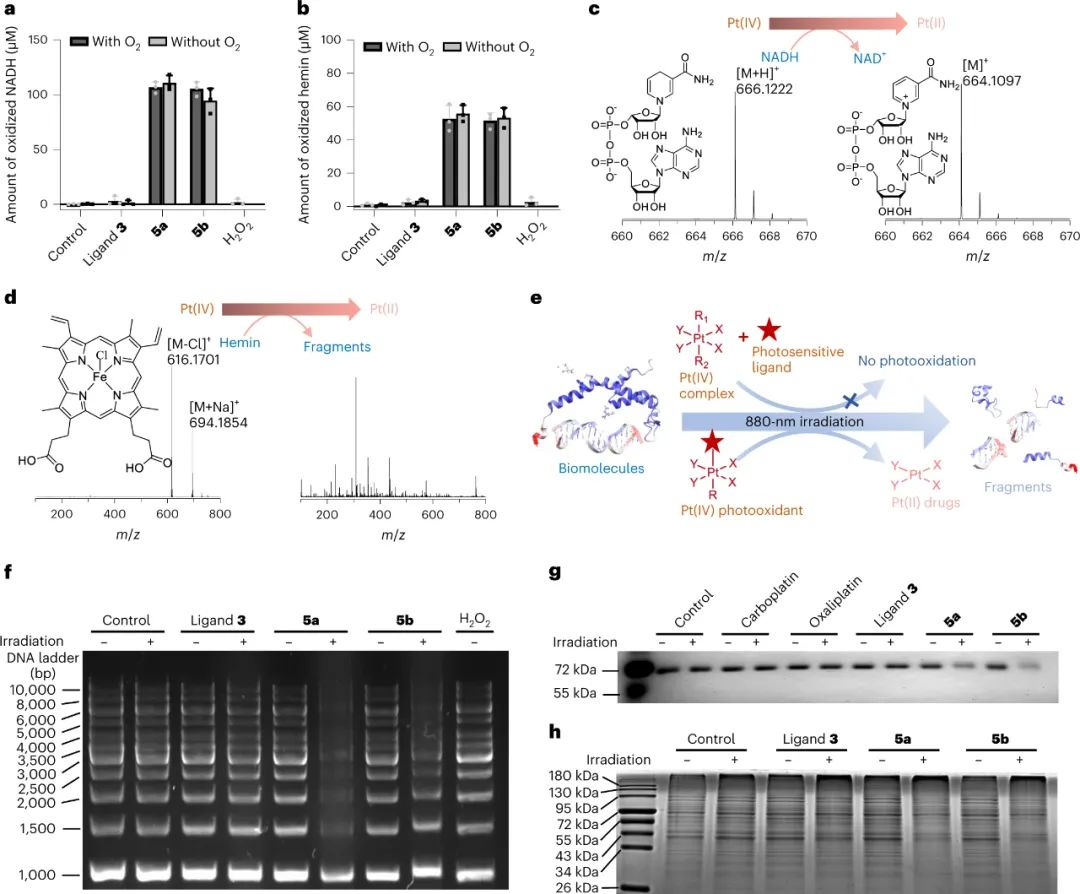
圖|光氧化劑5a和5b在NIR光活化時有效地氧化了傳統的細胞內生物分子。
在內質網中積累
在確認光氧化劑在激活后氧化生物分子的能力后,下一步是評估其細胞滲透能力,這對于其抗癌作用至關重要。癌癥干細胞(CSC)在腫瘤對傳統治療的耐藥性中發揮著重要作用。因此,以 CSC 為目標是非常可取的。檢查了肺癌干細胞 (LCSC) 中 5a 和 5b 的細胞積聚,結果顯示與其相應的 Pt(II) 藥物相比,細胞內積聚增加。在三維腫瘤球體模型中,兩種光氧化劑有效滲透核心區域,而配體 3 保留在外層。定位研究表明,5a 和 5b 主要在內質網 (ER)區域積累。
在體外具有很高的光細胞毒性
實驗結果表明,5a和5b是有效的光氧化劑,可以氧化生物分子并積累在內質網中。它們對多種癌細胞系表現出顯著的光細胞毒性,在黑暗條件下無毒。5a和5b的光細胞毒性明顯高于對應的Pt(II)藥物,并顯示出低抗藥性。這些光氧化劑在缺氧條件下仍保持光細胞毒性,而傳統的光動力療法藥物不具備這種特性。在三維腫瘤球模型中,5a和5b有效地殺死癌細胞,而Pt(II)藥物和配體3則無效。研究揭示了5a的細胞內作用機制,包括誘導氧化應激、降低細胞內pH和引發內質網應激。5a的熒光光譜在光激活后發生了偏移,表明細胞內pH下降。總體而言,這些實驗結果表明合成的光氧化劑具有優越的抗癌活性和獨特的作用機制,相比傳統的化療或光動力療法藥物有著明顯的優勢。
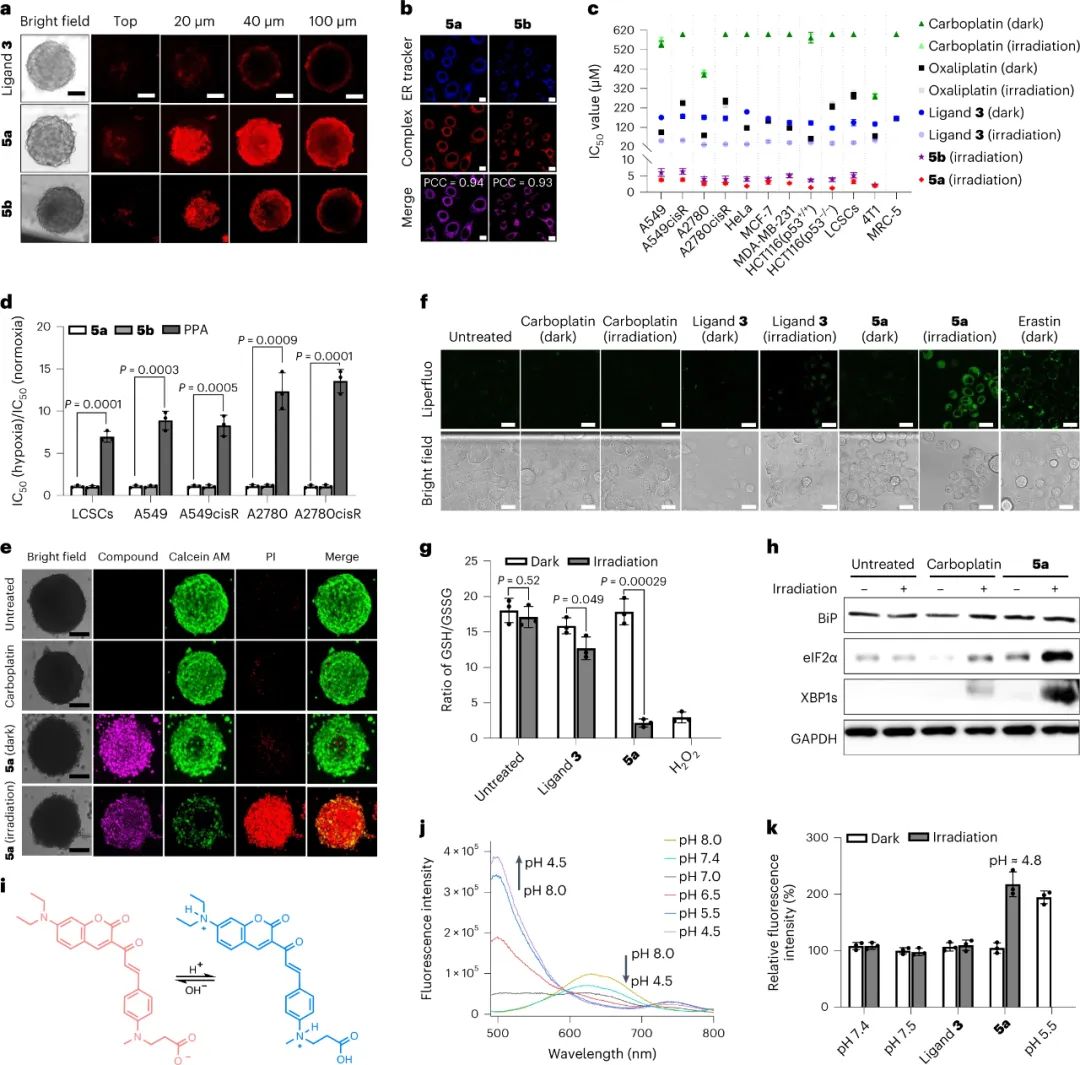
圖|光氧化劑5a和5b在內質網中積累,并在NIR光激活后有效清除癌癥細胞
誘導非經典性壞死
進一步的分析表明,5a誘導的細胞死亡與鐵死亡(ferroptosis)具有相似特征,但與典型的鐵死亡不同,5a誘導的細胞死亡不依賴于鐵元素。同時,5a處理后細胞中出現大量的脂質過氧化產物,而添加鐵死亡抑制劑也無法減少這些產物的生成。此外,5a誘導的細胞死亡與DNA損傷無關,而是由于強烈的細胞內氧化應激和降低的細胞內pH引起。此外,5a還能誘導免疫細胞死亡,并激活免疫細胞,進一步提高抗癌效果。總之,這些實驗結果揭示了5a在細胞死亡機制上的獨特性,通過氧化應激和降低細胞內pH實現非典型的細胞壞死。
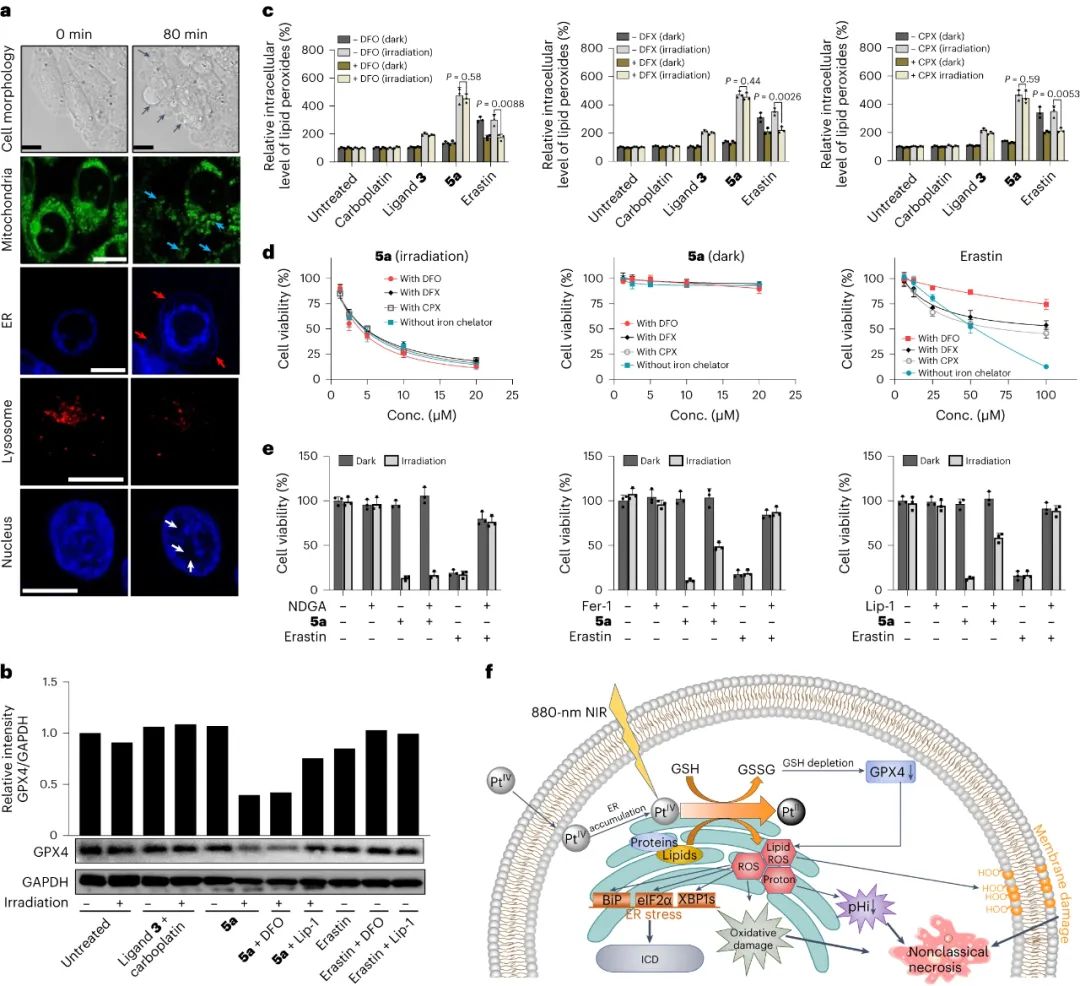
圖|光氧化劑5a在光活化后誘導非經典壞死
體內腫瘤抑制和免疫系統激活
最后,研究人員還檢查了5a的體內腫瘤抑制效果和免疫系統激活。用光激活5a治療后,小鼠的腫瘤體積和腫瘤重量都得以大幅度地減小。在光激活5a處理的小鼠腫瘤組織中,CD4+ 和CD8+ T細胞數量分別大幅增加了7倍和23倍,表明光激活5a可以激活免疫系統并在腫瘤微環境中招募免疫細胞,這有助于其抗腫瘤和抗轉移作用。
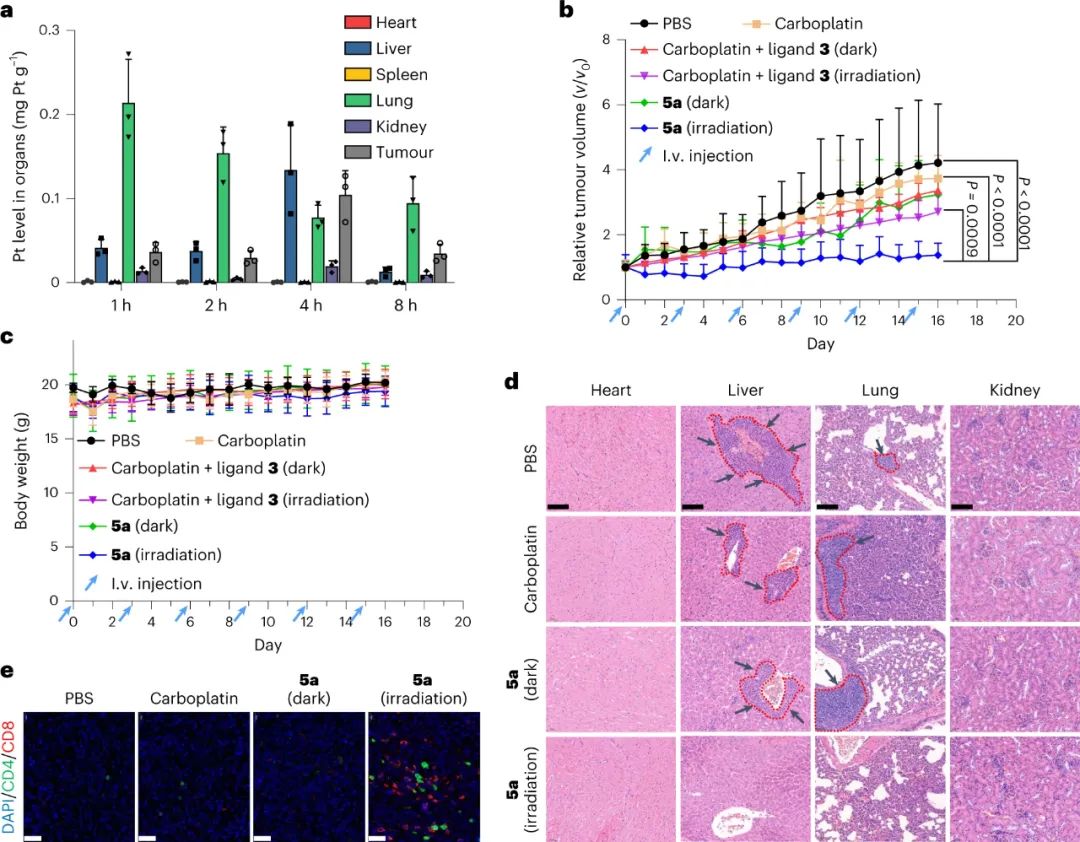
圖|體內抗腫瘤作用
小結:
綜上所述,基于金屬增強光氧化的意想不到的效果,研究人員開發了一類近紅外激活的Pt(IV)光氧化劑,它可以直接氧化細胞內生物分子,并以可控的方式在體外和體內有效地消滅腫瘤細胞。與經典的抗癌PSs相比,這些Pt(IV)光氧化劑具有更長的激活波長,這提高了它們的組織滲透能力并擴大了它們在癌癥治療中的潛在應用。
這項研究提供了開發近紅外激活的 Pt(IV) 抗癌光氧化劑的策略,克服了使用傳統 PS 和化療藥物的主要障礙。此外,結果強調了光活化抗癌金屬配合物的光氧化特性及其獨特的細胞殺傷模式的重要性。作為概念證明,這項研究表明基于金屬增強光氧化的光氧化劑的開發是金屬藥物設計的一個有前途的方向。
參考文獻:
Deng, Z., Li, H., Chen, S. et al. Near-infrared-activated anticancer platinum(IV) complexes directly photooxidize biomolecules in an oxygen-independent manner. Nat. Chem. (2023).
https://doi.org/10.1038/s41557-023-01242-w











