特別說明:本文由學研匯技術中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。現存問題
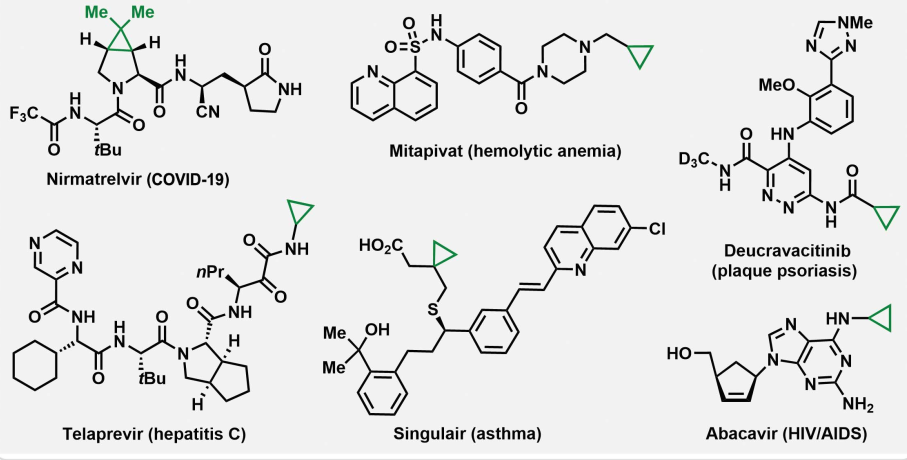
環丙烷在復雜分子和天然產物的合成中具有很高的價值和用途。環丙基部分也廣泛作為臨床前和臨床藥物分子的關鍵設計元素,以實現特定的治療目標,并且是生物活性分子和天然產物的關鍵基元(圖1)。因此,環丙烷化是有機合成中研究最多的張力成環反應之一。但碳質三角形也是最難制造的環之一,因為張力會使環不穩定,并使其在反應過程中容易打開。最優選和最可靠的方法是將碳插入烯烴。但該方法嚴重依賴于反應性卡賓和金屬-類卡賓中間體[[M]=CR2]。經典的西蒙斯-史密斯反應和相關反應也將烯烴轉化為環丙烷,然而,這些反應需要大量不穩定的,通常難以接近的1,1-和1,2-二鹵烷和高活性的Et2Zn或Zn/Cu試劑。最近,催化方法以簡化與替代前體烯烴環丙烷化。但過程也依賴于[M]=CR2中間體的生成和開發和多步合成操作,以原位獲得反應性[M]=CR2中間體。
解決思路
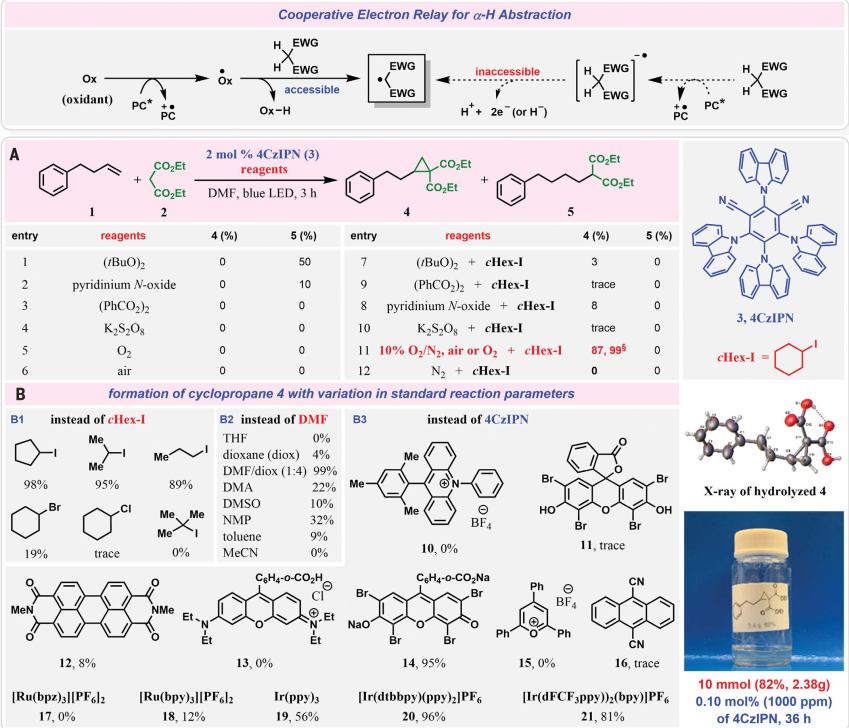
顯然,用簡單、易得、穩定的化學物質在未活化的烯烴上催化環丙基環的分子間結構,在操作上直接且廣泛適用的方式是一個持續的挑戰。基于此,美國賓夕法尼亞州立大學帕克分校Ramesh Giri教授團隊公開了一種簡單的光氧化還原方法,通過電子繼電器系統,通過光敏O2和烷基鹵化物的協同作用,直接將未活化的烯烴與活性亞甲基化合物進行分子間環丙烷化(圖2)。該方法提供了一種在空氣和O2的中性反應條件下,使用穩定的化學物質,無需特殊的安全性和敏感性注意事項,為非活化烯烴的分子間環丙烷化提供了一種簡單、實用和廣泛的方法。相關結果以《Photosensitized O2 enables intermolecular alkene cyclopropanation by active methylene compounds》為題發表在Science上。烯烴與活性亞甲基化合物的直接環丙烷化需要通過氧化還原化學去除兩個質子和兩個電子(圖2)。設想這一過程可以由激發態光催化劑(PC*)通過逐步電子轉移(ET)和α-碳中心自由基的產生來介導。從熱力學的角度來看,直接ET還原活性亞甲基以去除氫化物在酸性α-碳中心可能是不可行的,所以選擇了光激發氧化劑作為中間體來產生高能自由基,這些自由基可以作為α-H提取的relay。因此,首先在LED下,以1,2,3,5-四akis(carbazol9 -yl)-4,6- diyanobene (4CzIPN)作為PC,研究了一系列常見的過氧化物氧化劑,以產生可能從活性亞甲基中提取α-H原子的中間自由基(圖2A)。發現過氧化氧化劑和烷基碘化物的組合提供可觀察數量的環丙烷化產品4。當O2與碘化烷基結合時,光催化反應在3小時內得到定量產率為4的環丙烷化產物,表明O2和碘化烷基是反應成功的關鍵。進一步檢查了不同的有機和有機金屬PC的氧化電位范圍。在幾種常見的PC中(圖2B),伊紅Y鈉鹽,[Ir(dtbbpy)(ppy)2][PF6]和[Ir(dFCF3ppy))2(bpy)]PF6提供高產量的產物4。
根據烷基碘化物和O2在催化轉化中的作用,進一步研究了反應機理。實驗表明,烷基自由基不參與PC自由基陽離子的催化轉化還原。相反,由I2水解或氧化產生的碘化物(I?)或碘酸鹽(IO3?)提供了減少中間PC自由基陽離子所需的電子。為了進一步確認I2的作用,用5 mol % I2取代cHex-I進行了標準催化反應。在O2、空氣和10% O2條件下分別以99%、89%和83%的產率生成環丙基產物4。基于此,研究提出了環丙烷化反應的催化循環(圖3):O2首先被光激發的PC*還原為O2??,它從活性亞甲基化合物中提取α-H生成α-C自由基,在反應中沒有生成碳烯中間體。在沒有烯烴的情況下,α-C自由基發生自由基二聚化,隨后進一步氧化生成單羥基和二羥基化產物(31和32)。α-C自由基隨后很可能與烯烴加成形成次生C自由基,次生C自由基隨后與O2反應生成過氧自由基陰離子。
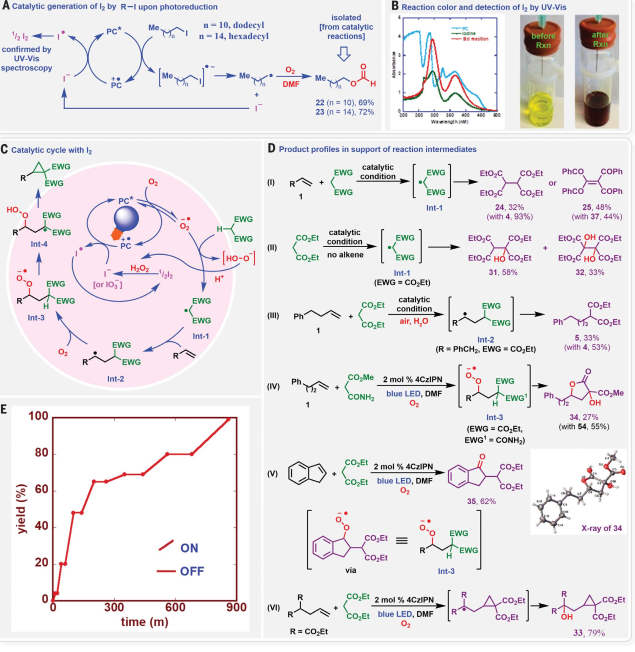
圖 3:通過I2的生成和檢測、產物簡介和光照開關實驗,提出了催化循環及其機理的支持細節
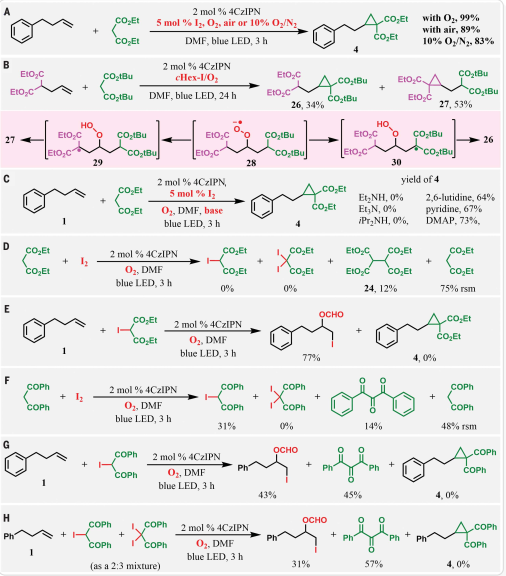
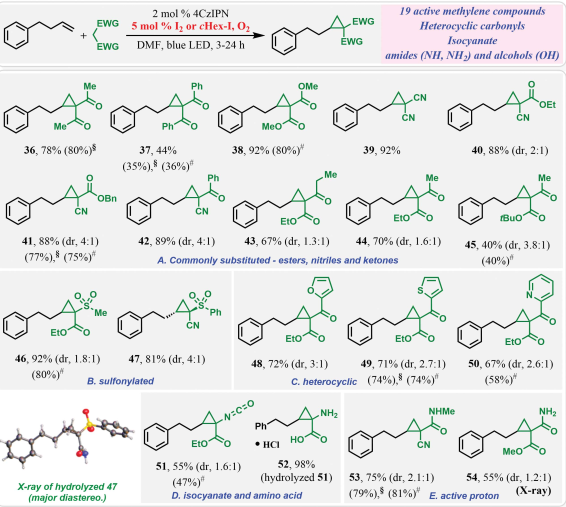
圖 4:與I2的催化反應和進一步的機理研究,探討了羰基和a-碘羰基作為反應中間體的潛在參與在優化的反應條件下,探索了在化學量cHex-I和催化I2存在下以及在空氣和O2中活性亞甲基化合物環丙烷化反應的范圍(圖5)。從合成相容性的角度來看,兩種催化方案下的反應顯示了19種亞甲基化合物在5個不同簇中的廣泛范圍,并生成了一套1,1-二羰基環丙烷。最初檢查了最常見的活性亞甲基化合物的反應性。與具有不同官能團的亞甲基,如氰酸酯、酮酯和酮腈的反應,以中等至良好的非對映選擇性生成三取代環丙烷。對磺酰基環丙烷47的主要非對映體水解產物的XRD分析表明非對映選擇性受立體控制。該反應也與在環丙基核上引入羰基化雜環相兼容,從含呋喃基、噻吩基和吡啶環的活性亞甲基以及具有中等至良好非對映選擇性的酯形成的產物中可以看出(圖5C)。該方法還能耐受一些最敏感的官能團。如異氰酸酯(圖5D)。
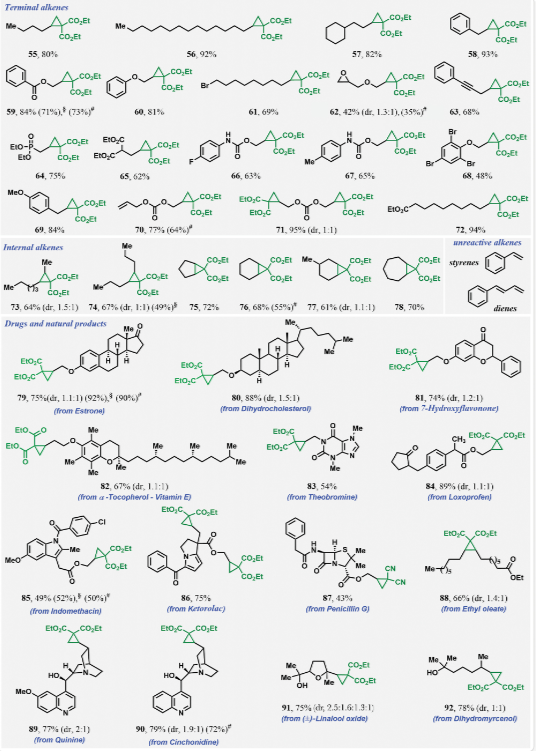
最后,研究考察了烯烴環丙烷化反應的范圍,以丙二酸二乙酯為代表的活性亞甲基化合物(圖6)。該反應與末端含有無環、環烷基和芳基骨架的烯烴有效地進行,并耐受各種官能團,如酯、碳酸酯、氨基甲酸酯、環氧化物、醚、炔、烷基溴和芳基溴。此外,在α-碳上攜帶活性氫的烯烴,如磷酸鹽(64)和丙二酸酯(65),以及在酰胺氮上攜帶活性氫的烯烴,如仲氨基甲酸酯(66和67),也是環丙烷化的優良底物。該反應可用于控制含有兩種烯烴的底物的單環丙烷化(70),也可用于兩種烯烴的雙環丙烷化(71),進一步突出了選擇性環丙烷化的合成實用性。該方法也適用于更具立體挑戰性的線性和環二取代內烯烴的環丙烷化,生成四取代環丙基產品(73至78)。總的來說,當用于復雜底物時,cHex-I的產率高于催化劑I2,這可能是因為cHex-I對催化劑I2的釋放緩慢。還研究了含烯烴的復雜藥物和天然產物的反應范圍(圖6)。o-烯丙化甾體雌酮(79)、二氫膽固醇(80)、o-烯丙化7-羥基黃酮(81)和維生素E(82)中的烯烴生成了收率很高的環丙烷化產物。C-和o-二烯化的非甾體抗炎藥酮酸(86)被有效地轉化為具有兩個三取代環丙基環的產物。油酸乙酯(88)中天然存在的內烯烴也能產率高的四取代環丙基產物。含有游離羥基的脂肪族和雜環天然產物中的其他天然烯烴在不受分子骨架中未受保護的醇的干擾的情況下進行了有效的環丙烷化。
總結
目前光氧化還原協議的進一步發展有可能改變烯烴環丙烷化的方式。特別是,新參數的發現可以克服目前對苯乙烯和1,3-二烯的限制,以及它們在流動系統中的適應性,可以為未來大規模過程化學的實施開辟新的途徑。https://www.science.org/doi/full/10.1126/science.adg3209DHRUBA P.POUDELet al. Photosensitized O2enables intermolecular alkene cyclopropanation by active methylene compounds.Science (2023).DOI:10.1126/science.adg3209