NTU浦侃裔/北化工宋繼彬等Nature Materials:首次報道X-ray激發(fā)的長余輝發(fā)光小分子探針
小奇
奇物論
2023-09-08
光學(xué)顯像劑已廣泛應(yīng)用于生物學(xué)和醫(yī)學(xué)領(lǐng)域,為診斷和光療提供了重要手段。與激光相比,X射線具有更深的組織穿透性,允許將高能量光子傳遞到人體深層病灶部位,用于診斷成像和癌癥放療。X射線最近被用來代替激光來誘導(dǎo)余輝成像具有獨特的優(yōu)勢。然而,此類放射性余輝成像(Radio Afterglow Imaging,RAI)劑鮮有報道,僅限于少數(shù)稀土摻雜的無機納米熒光粉。由于大多數(shù)光敏劑不直接響應(yīng)X射線,因此無機納米熒光粉常被用作X射線光子轉(zhuǎn)化為光的換能器,用于光敏劑的原位激發(fā)。
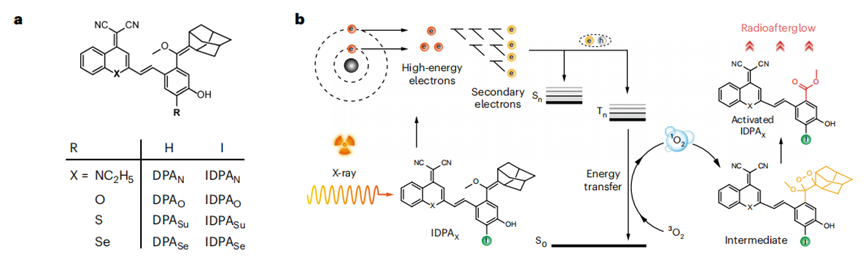
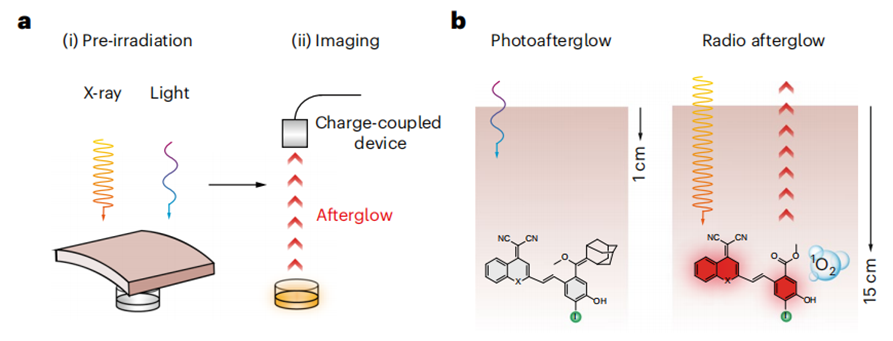
盡管RAI和RDT在腫瘤學(xué)中具有轉(zhuǎn)化潛力,但目前僅有無機納米顆粒被報道;此外,由于它們的放射功能不依賴于生物標志物,且經(jīng)常處于無區(qū)分度的“常亮”狀態(tài),因此癌癥的檢測和治療效果嚴重依賴于腫瘤與正常組織之間的濃度差,導(dǎo)致特異性差。與無機納米粒子相比,有機分子具有明確的結(jié)構(gòu),有利于精確控制理化特性。然而,有機分子中往往含有輕原子(如氫、碳、氧等)和弱的自旋軌道耦合;現(xiàn)有的有機分子X射線吸收能力弱,輻射發(fā)光壽命短和在X射線輻照下單線態(tài)氧產(chǎn)生能力較差。因此,目前還報道有機分子在X射線照射后發(fā)射余輝少之又少。在此,我們首次報道了有機分子發(fā)光體的發(fā)展,它可以有效地進行輻射動力學(xué)過程,產(chǎn)生單線態(tài)氧(1O2),并發(fā)出輻射余輝,用于精確的癌癥診斷。除了其可調(diào)的近紅外(NIR)發(fā)射波長、半衰期長和高效的1O2生成特性外,這些放射性余輝發(fā)光體的結(jié)構(gòu)及多功能性使其能夠構(gòu)建成為一種智能的可激活探針,在目標腫瘤生物標志物存在的情況下,才能打開其放射性余輝動態(tài)過程。首次報道X射線激發(fā)有機小分子余輝發(fā)光新機制。IDPAs的輻射余輝機制是基于化學(xué)缺陷的輻射動力學(xué)形成的新機制,這與無機納米熒光粉有本質(zhì)的區(qū)別。具體機制:X射線光子首先通過光電效應(yīng)和康普頓散射與IDPAs中的原子相互作用,激發(fā)出高能電子(電離)。這些熱電子進一步與周圍的原子相互作用,引發(fā)能量降低的二次電子級聯(lián),形成電子-空穴對(熱化)。由于碘和硫的存在,大量的電子以三重態(tài)激子的形式存在。這些激子躍遷回基態(tài),激發(fā)三線態(tài)氧(3O2)到單線態(tài)氧1O2(敏化)。原位生成的1O2與IDPAs通過環(huán)加成反應(yīng)生成二氧雜環(huán)丁烷中間體。最后,該中間體在釋放光子(余輝)的同時逐漸分解為相應(yīng)的活化產(chǎn)物(活化的IDPAx)。更深層次的腫瘤成像和治療。IDPAs的輻射余輝動力學(xué)過程能在15 cm超高靈敏度的記錄組織深度下被誘導(dǎo)。并且,由于其智能的生物標志物觸發(fā)的放射性余輝,組織成像穿透深度達5 cm,信噪比高達234,比X射線激發(fā)的無機納米粒子發(fā)射近紅外二區(qū)余輝高5.7倍。同時,不僅可以對超小腫瘤(0.64 mm)進行超靈敏的檢測,而且可以將放療的特異性提高到分子水平。Jingsheng Huang , Lichao Su, Cheng Xu, Xiaoguang Ge, Ruiping Zhang*, Jibin Song*, Kanyi Pu*. Molecular radio afterglow probes for cancer radiodynamic theranostics, Nature Materials, 2023, 10.1038/s41563-023-01659-1
加載更多

2122

版權(quán)聲明:
1) 本文僅代表原作者觀點,不代表本平臺立場,請批判性閱讀!
2) 本文內(nèi)容若存在版權(quán)問題,請聯(lián)系我們及時處理。
3) 除特別說明,本文版權(quán)歸納米人工作室所有,翻版必究!