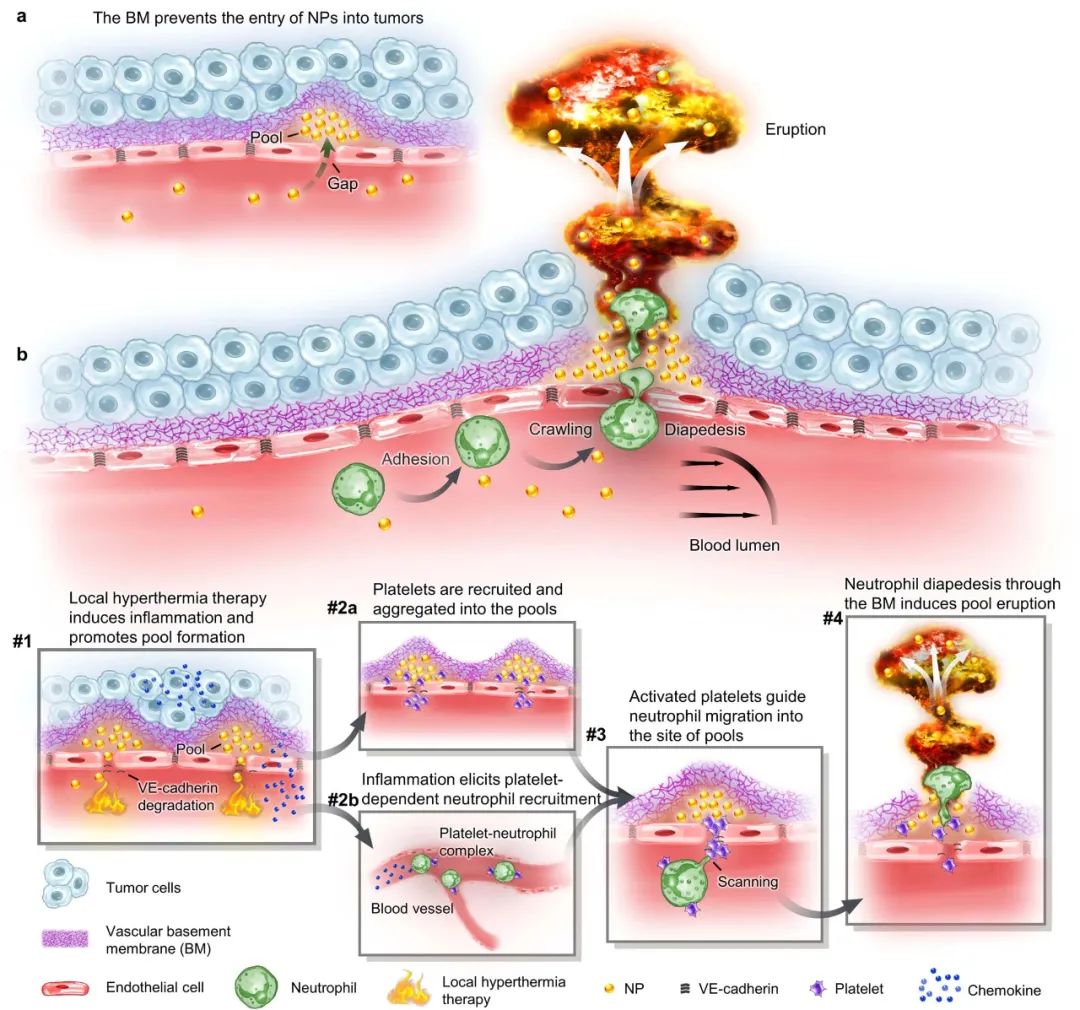
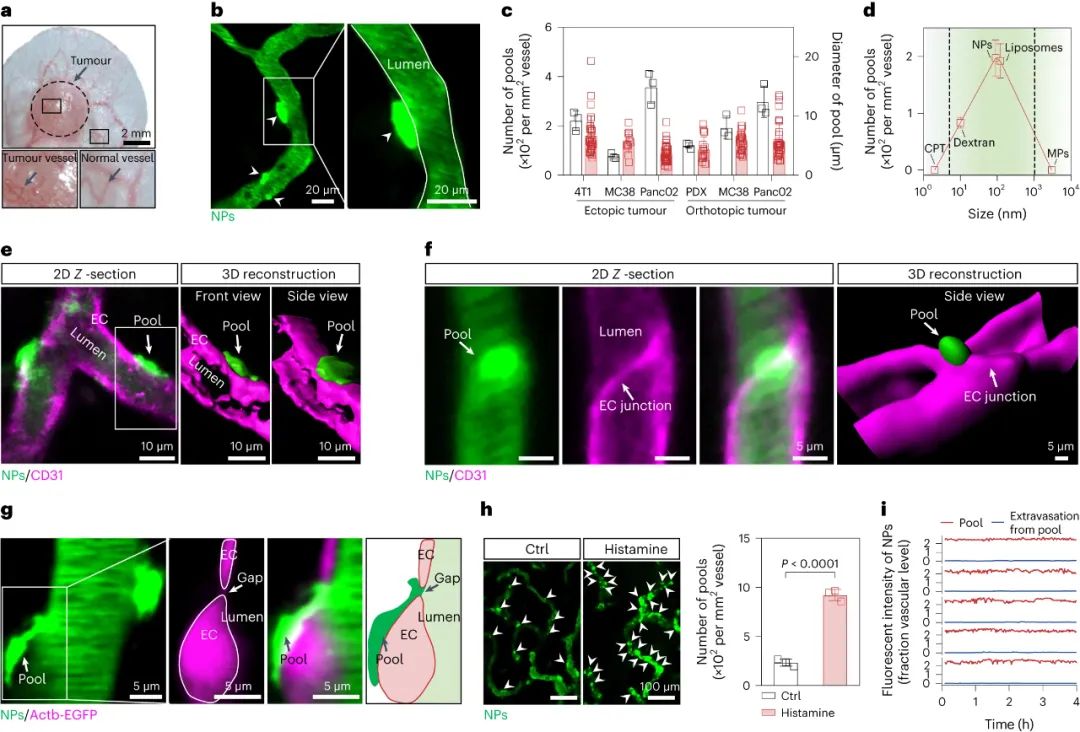
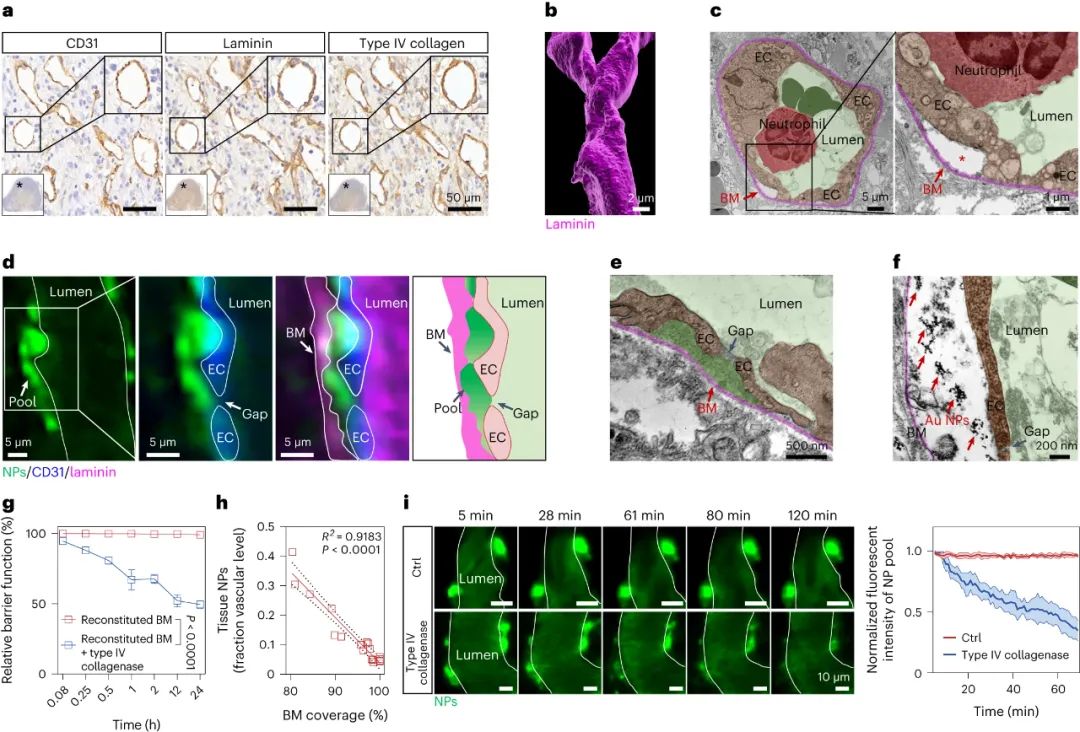
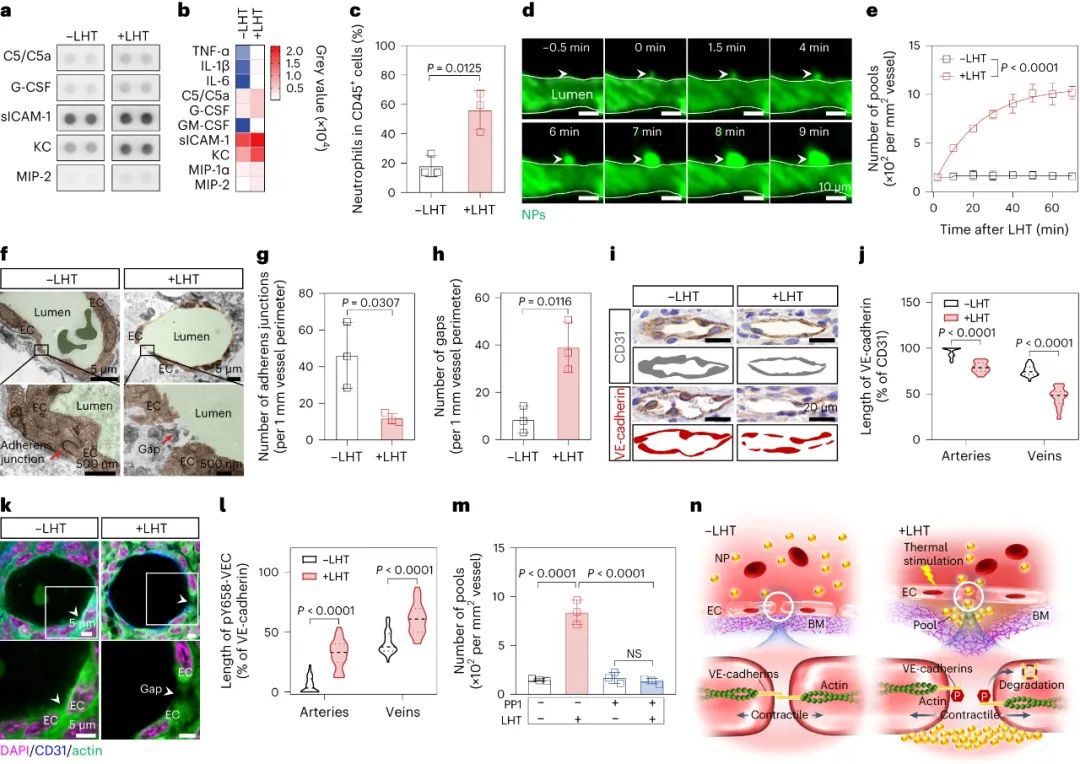
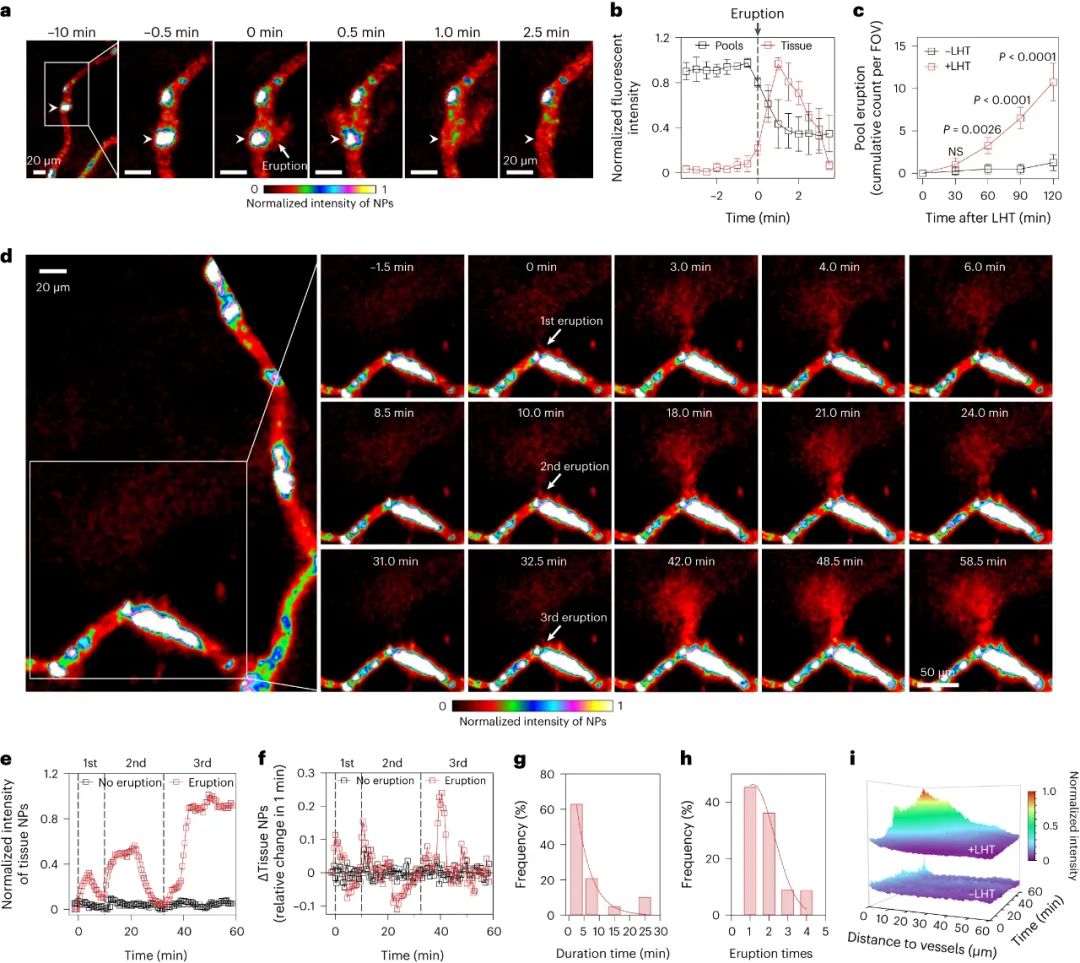
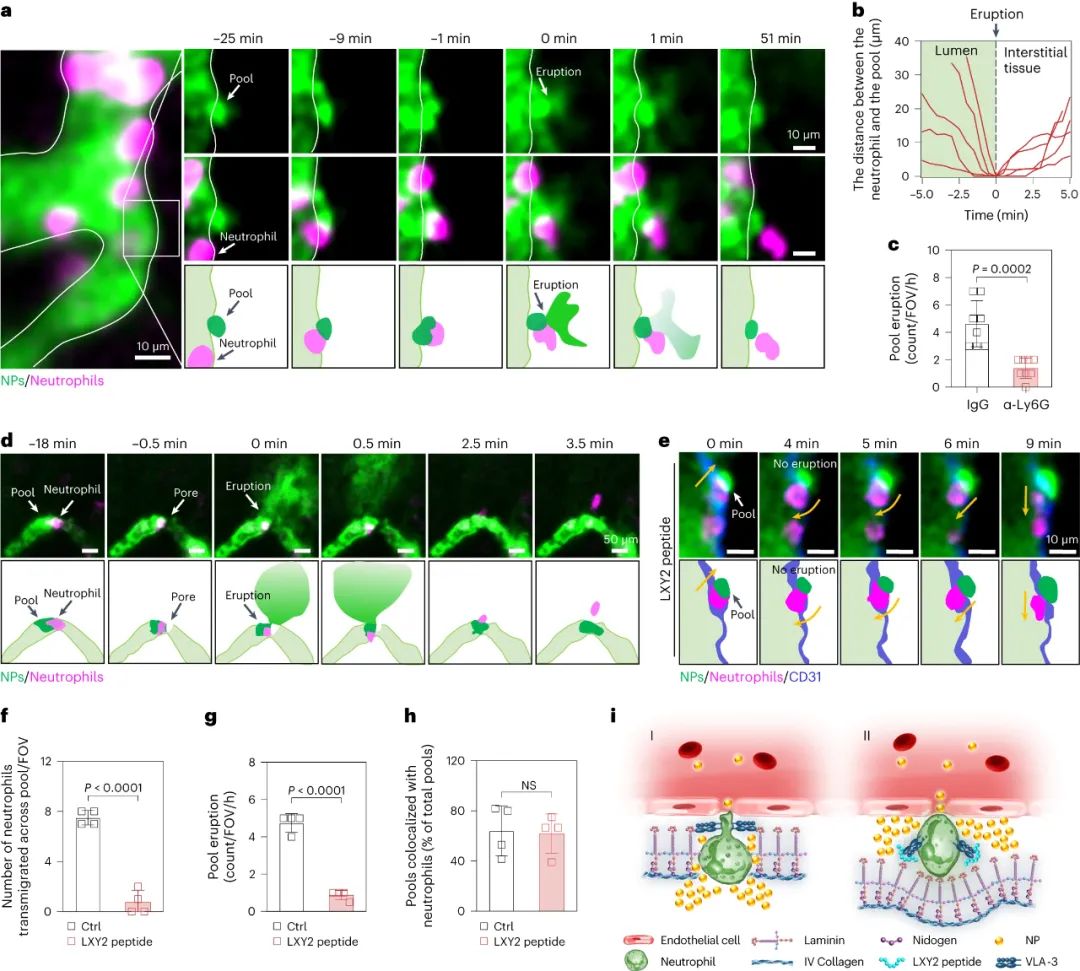
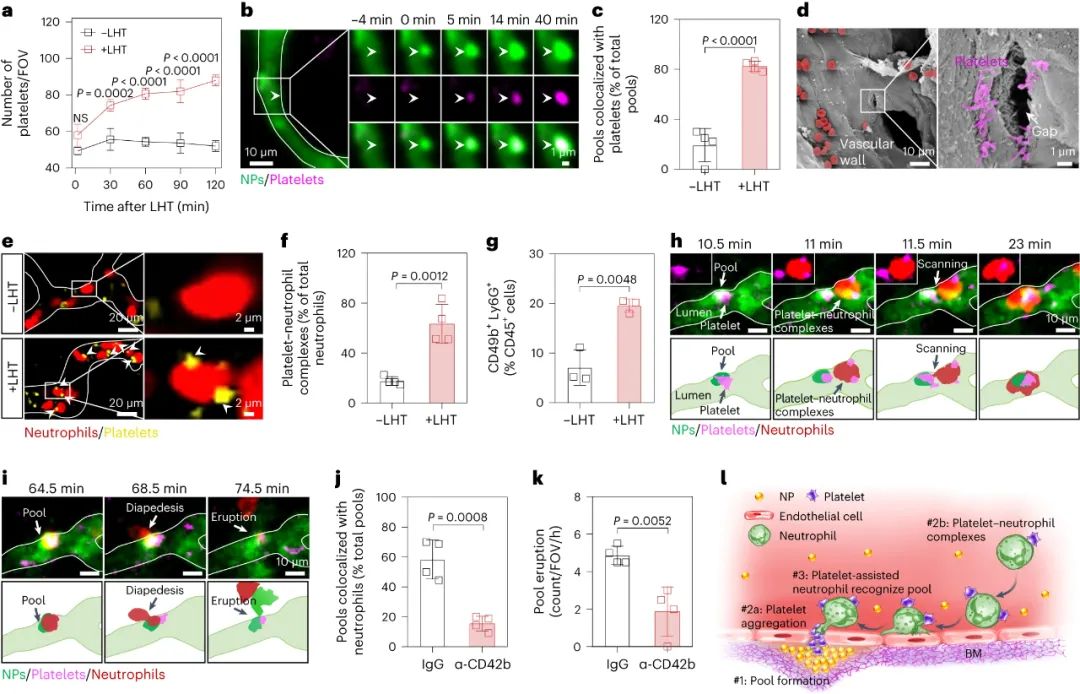
腫瘤血管構成了納米藥物進入腫瘤組織的主要途徑,因此納米藥物的高效遞送在很大程度上依賴于血管系統。目前的研究范式主要基于1986年首次提出的“增強滲透和滯留效應”(EPR, Enhanced Permeability and Retention effect)理論。該理論認為,腫瘤血管內皮細胞屏障是納米藥物滲透到腫瘤組織的最后一道防線,納米藥物可以利用腫瘤血管的高滲透性來跨越這一屏障,從而直接進入腫瘤微環境。然而,臨床前和臨床研究的結果均顯示,納米藥物對腫瘤的遞送效率仍然不盡如人意。某些研究數據甚至表明,納米載體僅能將大約0.7%的藥物有效遞送至腫瘤組織。這一發現不禁引發了疑問:是否存在其他尚未被充分認識的機制,這些機制可能在非內皮細胞屏障層面阻礙了納米藥物的血管外滲透?近期,中國科學技術大學王育才教授及蔣為副教授的研究團隊在《Nature Nanotechnology》雜志在線發表了一篇題為“Breaking through the Basement Membrane Barrier to Improve Nanotherapeutic Delivery to Tumours”的研究論文。利用自主研發的多層次活體顯微成像技術,研究團隊首次明確指出,腫瘤血管外側存在一層致密的基底膜結構,該結構嚴重阻礙了納米藥物的血管外滲透能力,導致納米藥物在腫瘤血管外形成“血池”樣的積累。該研究通過深入的活體顯微成像分析,解析了這種由基底膜構成的“血池”的空間定位、微觀結構以及成因,并進一步揭示了酶降解基底膜能顯著減少“血池”的數量,從而增強納米藥物的滲透效率。研究還進一步證實,通過炎癥誘導的中性粒細胞遷出機制,能在基底膜上短暫形成一個動態“窗口”,從而實現納米藥物火山噴發式的高效滲透,有效提升了納米藥物在腫瘤組織中的富集和治療效果。該研究不僅提出了一種與傳統EPR效應截然不同的納米藥物富集創新機理,還為納米藥物在腫瘤治療方面的應用提供了新的理論支持,并刷新了我們對納米藥物跨血管轉運機制的整體認識,為該領域的理論和應用研究提供了重要的突破。為了動態解析納米藥物與腫瘤血管生物界面的相互作用,研究者首先構建了高時空分辨活體顯微腫瘤血管的成像平臺。利用該成像平臺,研究者驚奇地發現納米顆粒到達腫瘤后,會聚集在腫瘤血管周圍的區域,形成納米顆粒“血池”(圖1)。進一步研究發現,在多種腫瘤模型中均發現這種血池結構,并且這種血池的形成具有納米尺寸依賴性。通過對血池三維成像以及空間定位分析顯示,血池位于血管內皮細胞的外側空間,這說明血池中積累的納米顆粒已經跨過內皮細胞屏障。通過延時成像觀察到血池中納米顆粒無法進一步滲漏到腫瘤組織中。這些結果表明,納米顆粒即使通過跨過內皮細胞屏障,也無法直接滲透到腫瘤組織中,可能存在一個非內皮細胞屏障阻止納米顆粒進一步滲漏,這將嚴重限制納米藥物進入腫瘤組織發揮作用!研究者通過探討血管結構,來解釋血池形成的原因。基底膜是上皮和內皮組織下一層致密的、高度交聯的片狀細胞外基質,主要由IV型膠原構成。研究者利用免疫組化、三維熒光成像、組織電鏡等技術,發現腫瘤血管內皮細胞外側包被一層致密的基底膜,其覆蓋率高達95%。進一步研究者通過活體顯微成像,發現基底膜可以阻止納米顆粒的滲透,使其滯留在內皮細胞下空間從而形成納米顆粒“血池”,進一步發現通過膠原酶降解基底膜顯著減少了血池的形成,并有效增強了納米顆粒的腫瘤滲透。以上結果表明,基底膜是阻止納米顆粒進入腫瘤組織的、被長期忽略的屏障,破壞基底膜屏障可以增加納米顆粒進入腫瘤基質(圖2)。雖然膠原酶可以打開腫瘤基底膜屏障有效增加了納米顆粒的外滲,但酶解作用可能導致基底膜不可逆轉的破壞,增加腫瘤轉移的風險,因此研究者想要發展一種可短暫打開基底膜屏障的安全策略。當組織發生無菌性炎癥,免疫細胞被招募至炎癥部位的過程中,會短暫打開基底膜屏障。受此啟發,研究者首先利用局部熱療(LHT)在腫瘤誘導急性無菌性炎癥,發現腫瘤血管上出現大量血池(圖3)。隨后通過組織電鏡、免疫組化等手段發現,急性炎癥處理使得內皮細胞上的VE-鈣連蛋白經磷酸化后降解,繼而誘導肌動蛋白-肌球蛋白纖維收縮,導致內皮細胞間隙的開放。上述結果證明,在無菌性炎癥處理后,血管內皮細胞間隙被打開,納米顆粒通過內皮細胞間隙進入內皮下空間,從而形成更多血池。圖3. 局部熱療通過打開粘附連接間隙促進更多納米顆粒血池的形成局部炎癥誘導血池中的納米顆粒通過噴發滲漏到腫瘤組織基質研究者探究了急性炎癥處理后能否打開基底膜屏障,實現血池中納米顆粒的血管外滲透。活體顯微成像觀察到,急性炎癥處理后,血池部位出現了劇烈的納米顆粒動態外滲,覆蓋了巨大的腫瘤間質區域,滲透深度約為65微米(定義為血池噴發)(圖4)。這說明急性炎癥處理可以克服基底膜屏障誘導血池噴發,并將血池中的納米顆粒釋放到腫瘤基質中。這種噴發效應發生在急性炎癥處理后30分鐘,并且在整個觀察過程持續出現。有趣的是,誘導急性炎癥處理可以在同一處血池產生多次噴發。以一個血池噴發的典型事例來看,該血池在一小時內產生了三次強度不同的連續噴發。單個血池的噴發過程大多集中在2-10分鐘,噴發次數在1-4次不等。因此,在急性炎癥處理下,血池的噴發效應可以實現納米顆粒在腫瘤基質中更深、更強的滲透與富集。圖4.急性炎癥誘導的血池噴發將“困住”的納米顆粒釋放到腫瘤間質中通過活體顯微成像,研究者發現在急性炎癥反應過程中,中性粒細胞能夠快速響應,通過趨化反應跨血管向腫瘤組織遷移。研究者還觀察到中性粒細胞完整的血管滲出的級聯過程,包括滾動、粘附、爬行和遷移等(圖5)。值得注意的是,在中性粒細胞跨過血池的瞬間,血池發生了噴發。然而,當中性粒細胞被清除后,研究者發現炎癥誘導血池噴發的頻率明顯下降,這證明了中性粒細胞的血管外滲是血池噴發的原因。在血池噴發過程中,血池出現了2-6微米的動態窗孔,該過程持續了2-6分鐘。一旦中性粒細胞完成血管跨越,這些窗孔隨即消失,這進一步說明了中性粒細胞的外滲過程的確打開了血池的基底膜屏障,并誘導了血池的噴發。通過阻斷中粒細胞識別基底膜的功能后,雖然中性粒細胞仍能夠遷移至血池部位,但無法誘導血池噴發。這些結果表明,血池噴發是通過中性粒細胞外滲短暫打開基底膜屏障這一過程實現的。最后,研究者對中性粒細胞遷移至血池的機制進行了深入的研究。研究者發現急性炎癥處理后,大量血小板迅速招募至血池部位,掃描電子顯微鏡結果顯示大量活化的血小板附著在損傷的內皮細胞間隙處(圖6)。此外,研究者觀察到急性炎癥處理后約有64%中性粒細胞與活化血小板形成復合物,這種復合物將有助于中性粒細胞到達炎癥部位。活體成像數據顯示,一旦到達炎癥部位,中粒細胞掃描并識別附著在血池處的血小板,從而精準定位至血池部位,隨后打開基底膜屏障,誘導血池噴發。清除血小板后,招募的中性粒細胞數量明顯減少,由于血小板在血池聚集不足,中性粒細胞無法定位至血池,最終導致血池噴發頻率顯著下降。綜上所述,激活的血小板可以協助中性粒細胞精準到達血池部位并指導其跨越基底膜屏障。圖6. 中性粒細胞依賴血小板招募到血池,進一步誘導血池噴發基于上述結果,該工作率先提出基底膜是一道被長期忽視的,阻止納米藥物跨腫瘤血管滲透的新屏障,解析了由基底膜所構成的納米藥物“血池”樣新結構;并揭示了誘導急性炎癥可以增強納米藥物的腫瘤血管噴發效應。該工作挑戰了經典的EPR效應,提出了納米藥物腫瘤遞送新理論,回答了納米藥物的血管轉運過程等基礎科學問題,在納米藥物遞送領域具有重要意義,為設計高效腫瘤遞送的新型納米藥物提供理論支撐。中國科學技術大學博士后汪沁、博士生梁啟蕊為該論文共同第一作者,中國科學技術大學王育才教授、蔣為副教授與新加坡國立大學David Tai Leong教授為本文共同通訊作者;團隊其他成員及合作者也為本研究做出了重要貢獻。Wang, Q., Liang, Q., Dou, J. et al. Breaking through the basement membrane barrier to improve nanotherapeutic delivery to tumours. Nat. Nanotechnol. (2023). https://doi.org/10.1038/s41565-023-01498-w