建立針對(duì)癌癥衍生表位的免疫反應(yīng)已成為癌癥免疫治療的支柱。釋放 T 細(xì)胞免疫來(lái)引發(fā)抗腫瘤免疫反應(yīng),在抗癌方面取得了重要的臨床進(jìn)展,包括檢查點(diǎn)抑制劑、癌癥疫苗和嵌合抗原受體 T 細(xì)胞 (CAR-T) 療法。結(jié)直腸癌(CRC)免疫治療未能取得療效的原因包括突變負(fù)荷低(導(dǎo)致缺乏突變衍生的新抗原)和腫瘤的免疫抑制環(huán)境。突變負(fù)荷低的腫瘤對(duì)個(gè)性化新抗原疫苗提出了更大的挑戰(zhàn),例如微衛(wèi)星穩(wěn)定 (MSS) CRC 腫瘤患者。MSS CRC通常對(duì)免疫檢查點(diǎn)封鎖具有抵抗力,因此需要?jiǎng)?chuàng)新的免疫調(diào)節(jié)策略。最近的研究表明,腫瘤內(nèi)細(xì)菌存在于腫瘤微環(huán)境中的癌癥和免疫細(xì)胞的細(xì)胞內(nèi),這可能為癌癥免疫治療提供新表位的替代來(lái)源。因此,可以假設(shè)殺死腫瘤中的細(xì)胞內(nèi)細(xì)菌將暴露微生物表位并產(chǎn)生癌癥相關(guān)新抗原的替代來(lái)源。
臨床前研究表明,細(xì)菌引發(fā)的 T 細(xì)胞免疫與癌細(xì)胞的主要組織相容性復(fù)合物 I 類(lèi) (MHC-I) 限制性抗原發(fā)生交叉反應(yīng),這表明微生物特異性 T 細(xì)胞有助于抗腫瘤免疫反應(yīng)。共生擬桿菌屬肽模擬物依賴(lài)心肌肌球蛋白特異性 TH17 細(xì)胞驅(qū)動(dòng)自發(fā)性自身免疫性心肌炎的進(jìn)展。微生物群引發(fā)微生物特異性T細(xì)胞反應(yīng),推測(cè)這些反應(yīng)是為了逃避自我耐受機(jī)制。可以假設(shè)細(xì)菌和宿主共享的同源表位有助于抗腫瘤免疫。
納米技術(shù)是將小分子細(xì)胞內(nèi)遞送至腫瘤部位的有前途的工具。載藥納米顆粒可以特異性消除腫瘤細(xì)胞內(nèi)細(xì)菌的定植。
成果簡(jiǎn)介
鑒于此,北卡羅來(lái)納大學(xué)黃力夫(Leaf Huang)等人測(cè)試了一種策略,通過(guò)遠(yuǎn)程加載技術(shù)將載有銀替硝唑復(fù)合物(LipoAgTNZ)的脂質(zhì)體遞送至細(xì)菌感染的小鼠原位結(jié)直腸癌腫瘤中。在此表明,通過(guò)脂質(zhì)體遞送針對(duì)厭氧細(xì)菌的抗生素來(lái)消除結(jié)直腸癌腫瘤中的細(xì)菌,從而釋放出抗腫瘤 CD8 T 細(xì)胞。

針對(duì)厭氧菌的抗生素可改善癌癥存活率
首先,作者探討了針對(duì)癌癥相關(guān)菌株的特定抗生素(如硝基咪唑和林可霉素)對(duì)結(jié)直腸癌患者的預(yù)后影響。研究采用了對(duì)全國(guó)范圍內(nèi)的結(jié)直腸癌患者進(jìn)行藥物流行病學(xué)數(shù)據(jù)庫(kù)的調(diào)查,發(fā)現(xiàn)在手術(shù)切除腫瘤前后6個(gè)月內(nèi)使用這類(lèi)抗生素的患者,相比于未接受抗生素或接受其他類(lèi)抗生素的患者,其疾病無(wú)復(fù)發(fā)存活率(DFS)較高。研究還發(fā)現(xiàn),這種保護(hù)作用主要出現(xiàn)在術(shù)前使用這類(lèi)抗生素的患者中,術(shù)后使用則沒(méi)有類(lèi)似效果。進(jìn)一步的研究也表明,這種保護(hù)作用在乳腺癌患者中并未觀(guān)察到,暗示了這種特定抗生素對(duì)結(jié)直腸癌及其微生物群落具有特異性作用。總的來(lái)說(shuō),這些研究結(jié)果暗示了特定類(lèi)別的抗生素可能具有降低結(jié)直腸癌復(fù)發(fā)風(fēng)險(xiǎn)的潛力,其效果可能與化療相當(dāng),后者通常能在術(shù)后結(jié)合輔助治療時(shí)降低復(fù)發(fā)風(fēng)險(xiǎn)。盡管在數(shù)據(jù)庫(kù)中患者的微生物群落狀況并不清楚,但針對(duì)厭氧菌的特定類(lèi)別抗生素在臨床上的鼓舞人心的結(jié)果促使了建立一個(gè)明確定義的、受細(xì)菌感染的小鼠模型以進(jìn)行詳細(xì)研究。
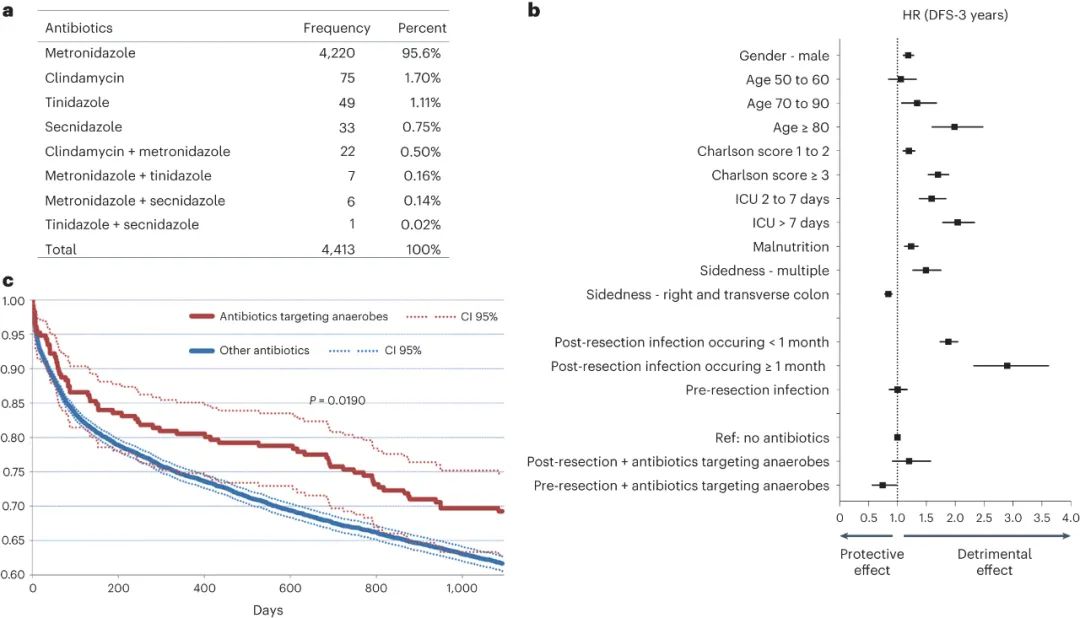
圖|針對(duì)厭氧菌的抗生素對(duì)CRC患者具有保護(hù)作用
細(xì)菌響應(yīng)低氧水平侵入腫瘤細(xì)胞
研究發(fā)現(xiàn)結(jié)直腸癌及其轉(zhuǎn)移中普遍存在具核梭桿菌菌株。實(shí)驗(yàn)證實(shí)了具核梭桿菌能在低氧環(huán)境下侵入腫瘤細(xì)胞。在小鼠實(shí)驗(yàn)中,具核梭桿菌感染導(dǎo)致腫瘤生長(zhǎng)顯著增加,并促使腫瘤轉(zhuǎn)移。腫瘤組織、轉(zhuǎn)移瘤及糞便中均發(fā)現(xiàn)了具核梭桿菌存在。此外,具核梭桿菌感染引起了腫瘤微環(huán)境中抗炎巨噬細(xì)胞和抑制性免疫細(xì)胞的顯著增加,而免疫細(xì)胞(如CD8+ T細(xì)胞)的數(shù)量顯著減少。電鏡和熒光實(shí)驗(yàn)證實(shí)了具核梭桿菌在腫瘤內(nèi)部存在。研究還表明另一種細(xì)菌Escherichia coli Nissle也會(huì)在低氧環(huán)境中侵入腫瘤細(xì)胞。這些研究結(jié)果揭示了微生物與腫瘤微環(huán)境的相互作用,對(duì)于了解腫瘤發(fā)展具有重要意義。
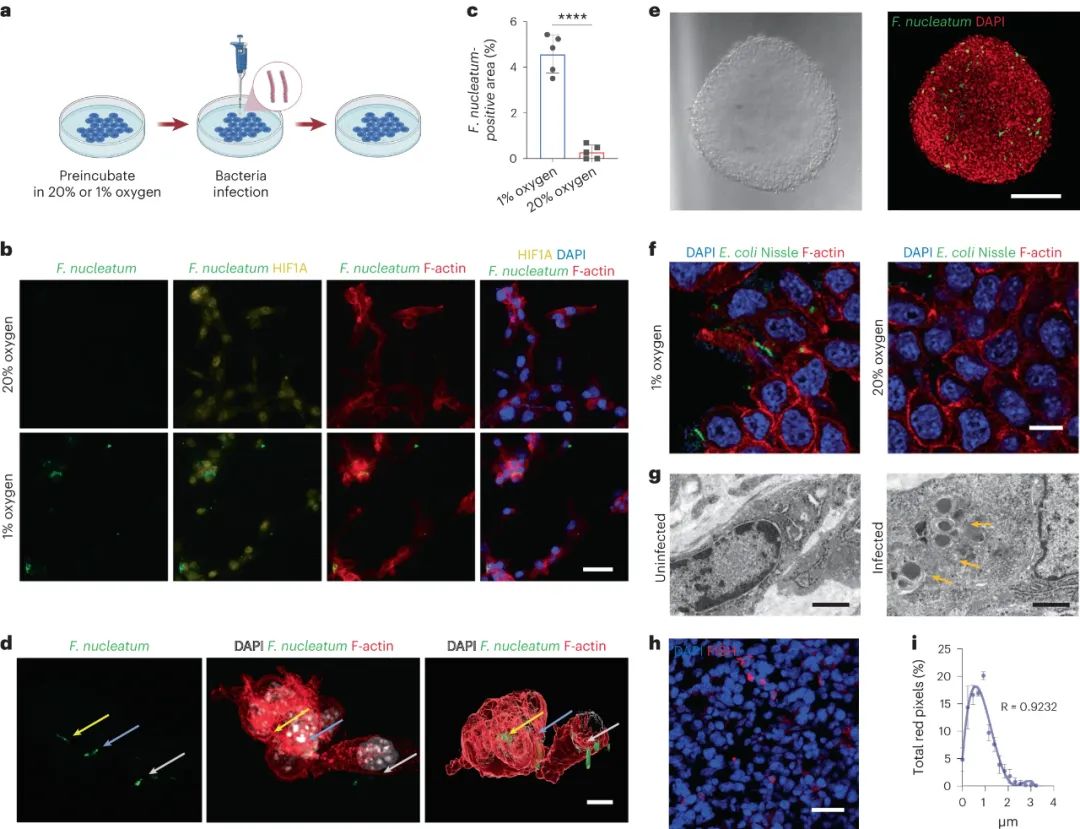
圖|細(xì)菌侵入CT26FL3(Luc/RFP)腫瘤細(xì)胞以響應(yīng)缺氧
脂質(zhì)體抗生素消除腫瘤中的細(xì)菌
該研究探討了一種針對(duì)寄生在腫瘤低氧區(qū)的厭氧菌的藥物遞送系統(tǒng),旨在減少對(duì)腸道共生微生物的損害。硝基咪唑?qū)儆谝活?lèi)抗微生物前藥,只有在厭氧菌中通過(guò)一氧化還原系統(tǒng)活化后才變得活性。氧氣的存在抑制了其產(chǎn)生細(xì)胞毒性衍生物的過(guò)程。硝基咪唑可與多種金屬離子結(jié)合,其中Ag+離子被用作抗菌劑。銀與硝基咪唑形成的復(fù)合物在酸性條件下解離,可釋放藥物。采用的金屬離子作為載體成功將硝基咪唑裝載到脂質(zhì)體中,實(shí)現(xiàn)了在腫瘤低pH環(huán)境下釋放藥物的效果。該藥物遞送系統(tǒng)對(duì)厭氧菌具核梭桿菌具有顯著的抑制作用,且通過(guò)脂質(zhì)體傳遞藥物可提高藥效。此外,實(shí)驗(yàn)證實(shí)該藥物遞送系統(tǒng)在一定濃度范圍內(nèi)對(duì)細(xì)胞和小鼠組織無(wú)明顯毒性作用。
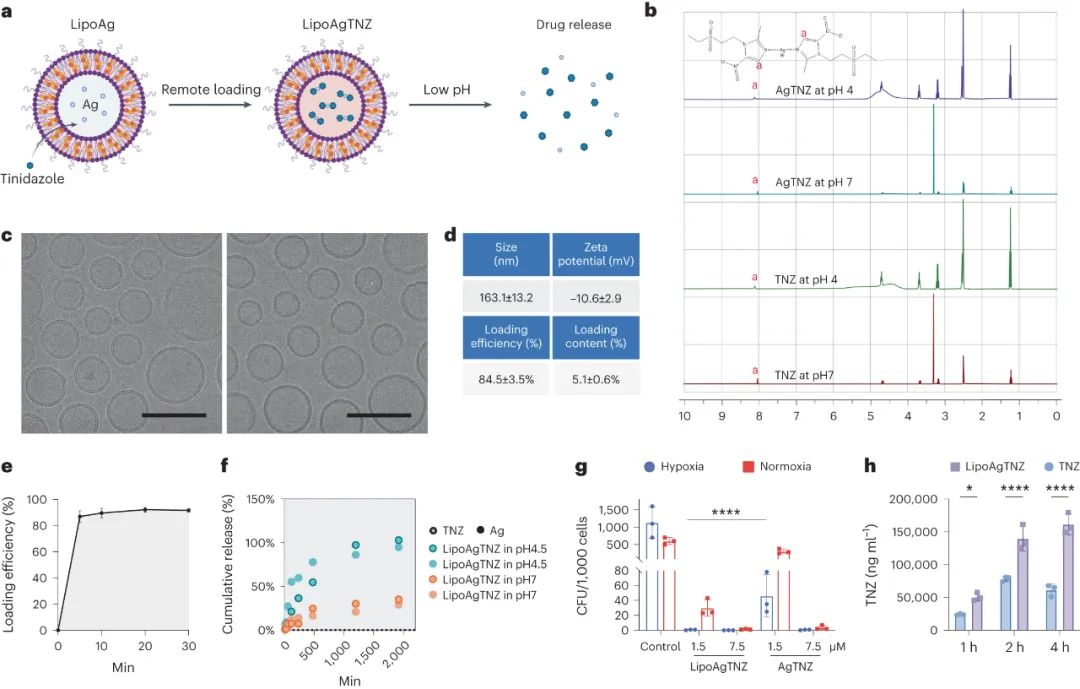
圖|pH敏感抗生素脂質(zhì)體的表征
殺死細(xì)胞內(nèi)細(xì)菌改善免疫監(jiān)視
研究使用感染的結(jié)直腸癌(CRC)小鼠模型測(cè)試了抗生素脂質(zhì)體的治療效果。對(duì)于感染了具核梭桿菌或E. coli Nissle的Balb/C小鼠,抗生素脂質(zhì)體治療顯著抑制了腫瘤生長(zhǎng),特別是LipoAgTNZ在一部分小鼠中實(shí)現(xiàn)了長(zhǎng)期存活。研究還驗(yàn)證了該方法在不同小鼠模型中的有效性。使用抗生素混合療法治療感染的腫瘤減小了腫瘤,但隨后發(fā)生了癌癥復(fù)發(fā)。LipoAgTNZ通過(guò)殺滅腫瘤相關(guān)的細(xì)菌,誘導(dǎo)了抗癌反應(yīng),并在抑制了原發(fā)腫瘤生長(zhǎng)的同時(shí),恢復(fù)了免疫監(jiān)視并抑制了轉(zhuǎn)移的發(fā)展。
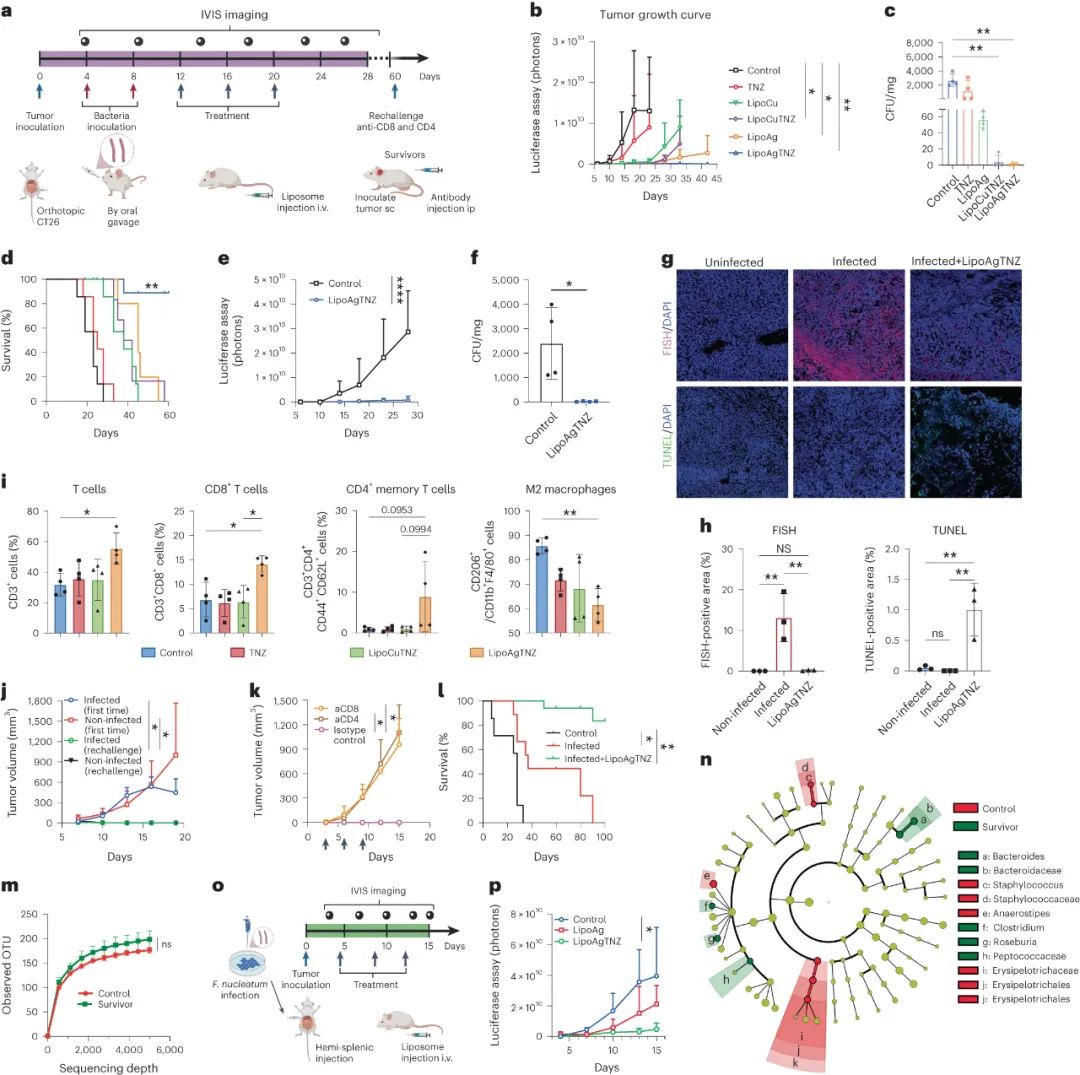
圖|脂質(zhì)體抗生素AgTNZ去除腫瘤中的有核F.nucleum根除CRC
來(lái)自長(zhǎng)期幸存者的 T 細(xì)胞對(duì)感染和未感染的腫瘤均表現(xiàn)出特異性
研究發(fā)現(xiàn),來(lái)自幸存小鼠的T細(xì)胞對(duì)感染和未感染的腫瘤細(xì)胞都產(chǎn)生了應(yīng)答,顯示出一定的特異性。將這些來(lái)自幸存者的T細(xì)胞移植到受體小鼠體內(nèi),發(fā)現(xiàn)它們不僅能有效抑制感染了細(xì)菌的腫瘤生長(zhǎng),也可以抑制未感染的腫瘤生長(zhǎng)。此外,在受體小鼠的腫瘤中也發(fā)現(xiàn)了大量的T細(xì)胞。研究表明,幸存者的T細(xì)胞對(duì)感染和未感染的腫瘤細(xì)胞都具有識(shí)別能力。
此外,研究還發(fā)現(xiàn),細(xì)菌感染降低了某些免疫相關(guān)分子的表達(dá),這可能是感染腫瘤細(xì)胞免疫抑制機(jī)制的一部分。然而,在LipoAgTNZ治療下,通過(guò)殺滅細(xì)胞內(nèi)細(xì)菌,恢復(fù)了這些分子的表達(dá),從而促進(jìn)了免疫原性細(xì)胞死亡,激活了腫瘤細(xì)胞的免疫應(yīng)答。這項(xiàng)研究的結(jié)果表明,通過(guò)消除與腫瘤相關(guān)的細(xì)菌,可以將免疫抑制的微環(huán)境轉(zhuǎn)變?yōu)榭鼓[瘤的免疫激活狀態(tài)。
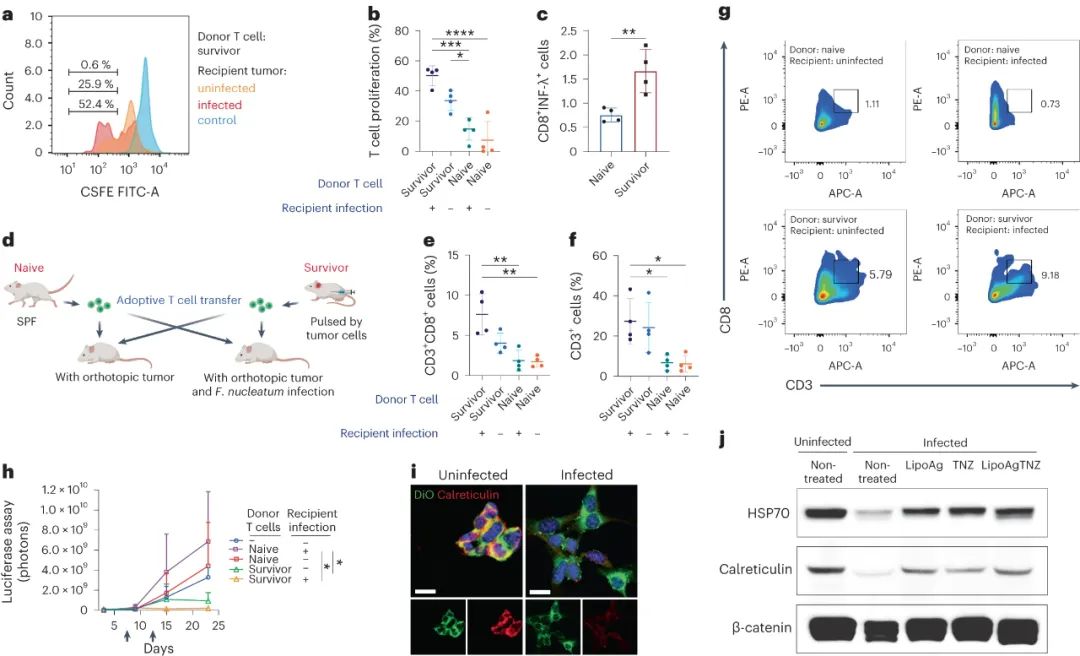
圖|來(lái)自幸存者的T細(xì)胞抑制了感染和未感染腫瘤的生長(zhǎng)
抗生素治療后宿主 T 細(xì)胞特異性靶向細(xì)菌表位
研究發(fā)現(xiàn),LipoAgTNZ引發(fā)了在攜帶結(jié)直腸癌的小鼠中的T細(xì)胞免疫反應(yīng)。通過(guò)分析細(xì)菌死亡產(chǎn)生的表位,研究者發(fā)現(xiàn)細(xì)菌蛋白質(zhì)中含有豐富的細(xì)胞質(zhì)蛋白。為了預(yù)測(cè)潛在的新表位,研究者選擇了數(shù)量上排名前的細(xì)胞質(zhì)蛋白進(jìn)行預(yù)測(cè),并從中挑選出具有高結(jié)合親和力的表位。進(jìn)一步通過(guò)與小鼠基因組比對(duì),發(fā)現(xiàn)了與細(xì)菌共有的同源抗原。研究者從中選定了特定的蛋白質(zhì),其含有可能通過(guò)MHC-I遞呈的序列。這些研究揭示了抗生素治療后,T細(xì)胞主要針對(duì)細(xì)菌-宿主共有的表位,從而對(duì)感染和未感染的腫瘤細(xì)胞產(chǎn)生了重要的免疫反應(yīng)。

圖|腫瘤相關(guān)細(xì)菌的殺傷促進(jìn)了細(xì)菌新表位的免疫識(shí)別
小結(jié):
正在開(kāi)發(fā)的個(gè)性化癌癥疫苗旨在引導(dǎo)免疫系統(tǒng)對(duì)抗個(gè)體腫瘤的獨(dú)特新抗原。除了足夠的免疫功能之外,這個(gè)過(guò)程還依賴(lài)于足夠的新抗原數(shù)量和質(zhì)量。殺死腫瘤相關(guān)細(xì)菌可能會(huì)提供新抗原的新來(lái)源,以促進(jìn)針對(duì)結(jié)直腸癌的同源和新表位介導(dǎo)的細(xì)胞免疫。
該工作源于這樣的觀(guān)察:針對(duì)厭氧菌的抗生素延長(zhǎng)了 CRC 患者和感染小鼠的無(wú)病存活率。在結(jié)腸癌患者中,抗生素帶來(lái)的益處僅限于切除前的攝入量,這表明瘤內(nèi)細(xì)菌的數(shù)量對(duì)增強(qiáng)免疫力可能是成功的關(guān)鍵。這些結(jié)果為使用針對(duì)腫瘤內(nèi)微生物群的靶向抗生素結(jié)合免疫療法來(lái)增強(qiáng)抗腫瘤免疫力的新輔助臨床干預(yù)鋪平了道路。在臨床實(shí)施之前,需要進(jìn)行專(zhuān)門(mén)的前瞻性研究,對(duì)瘤內(nèi)細(xì)菌、腫瘤分期以及抗生素的最佳時(shí)機(jī)和影響進(jìn)行分類(lèi)。
抗生素可以靶向在免疫抑制的腫瘤環(huán)境中建立的瘤內(nèi)促腫瘤細(xì)菌,以誘導(dǎo)癌癥特異性微生物新抗原的釋放。此外,該治療誘導(dǎo)腫瘤中細(xì)胞毒性 CD8+ T 細(xì)胞的浸潤(rùn),該細(xì)胞對(duì)微生物新表位具有特異性。同源表位還表現(xiàn)出抗腫瘤功效,這可能會(huì)導(dǎo)致對(duì)未感染腫瘤的免疫反應(yīng)。因此,殺死腫瘤相關(guān)細(xì)菌可以將免疫冷腫瘤轉(zhuǎn)變?yōu)闊崮[瘤,并啟動(dòng)免疫系統(tǒng)識(shí)別感染和未感染的腫瘤細(xì)胞。癌癥相關(guān)微生物新抗原的發(fā)現(xiàn)為開(kāi)發(fā)創(chuàng)新的抗腫瘤治療或預(yù)防性疫苗策略提供了令人興奮的可能性。
參考文獻(xiàn):
Wang, M., Rousseau, B., Qiu, K. et al. Killing tumor-associated bacteria with a liposomal antibiotic generates neoantigens that induce anti-tumor immune responses. Nat Biotechnol (2023).
https://doi.org/10.1038/s41587-023-01957-8











