陳春英,國家納米科學中心研究員,國家重點研發計劃首席科學家,2023年當選中國科學院院士。
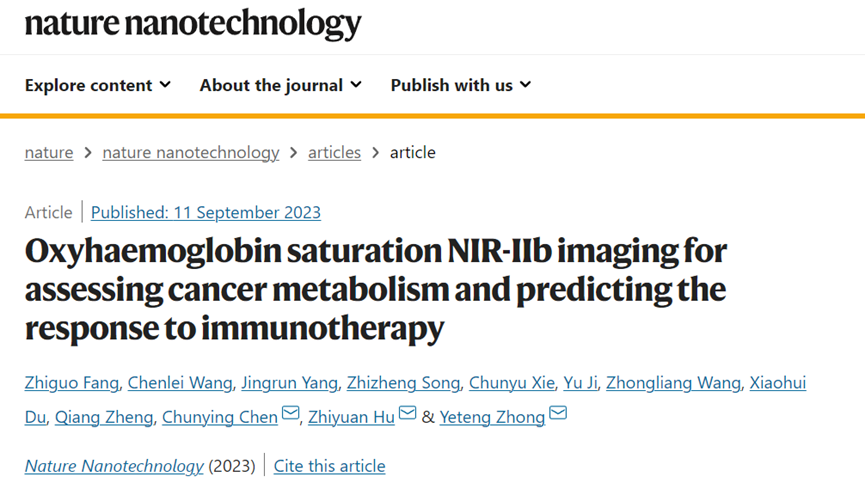
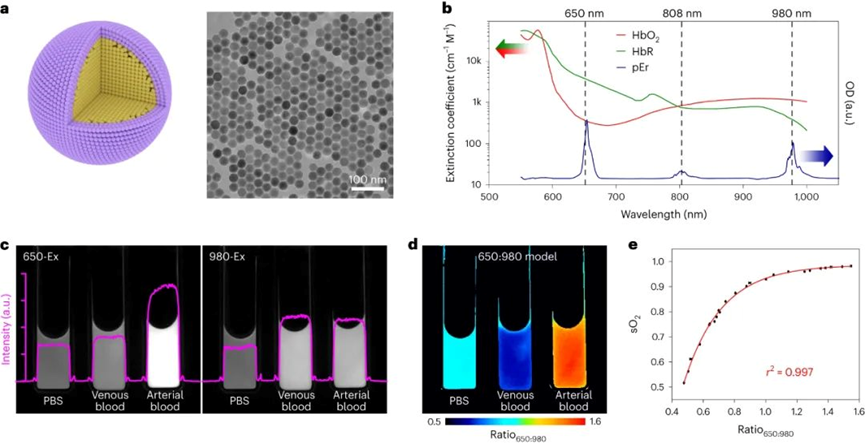
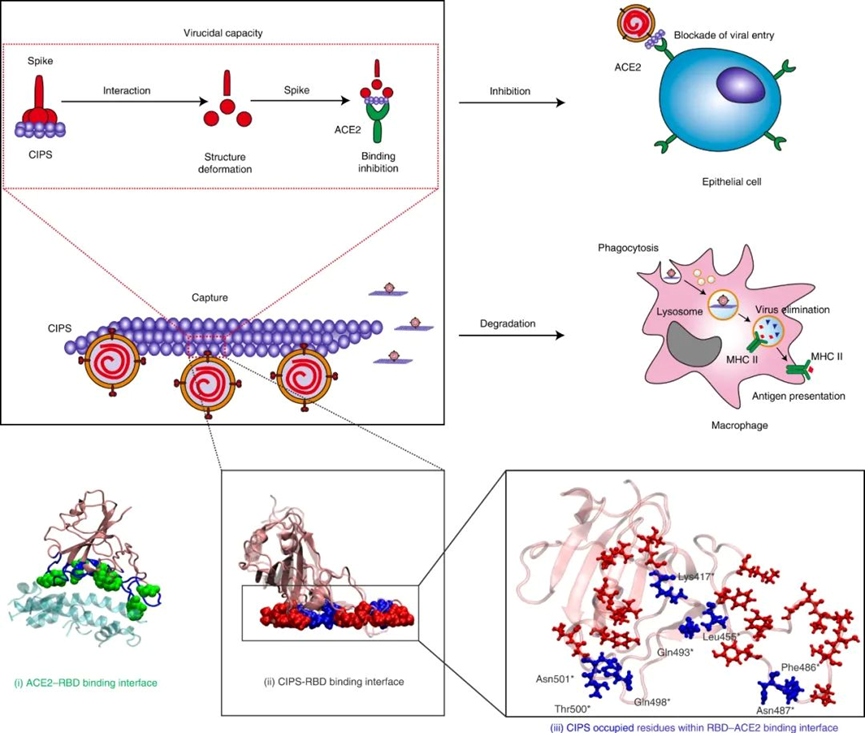
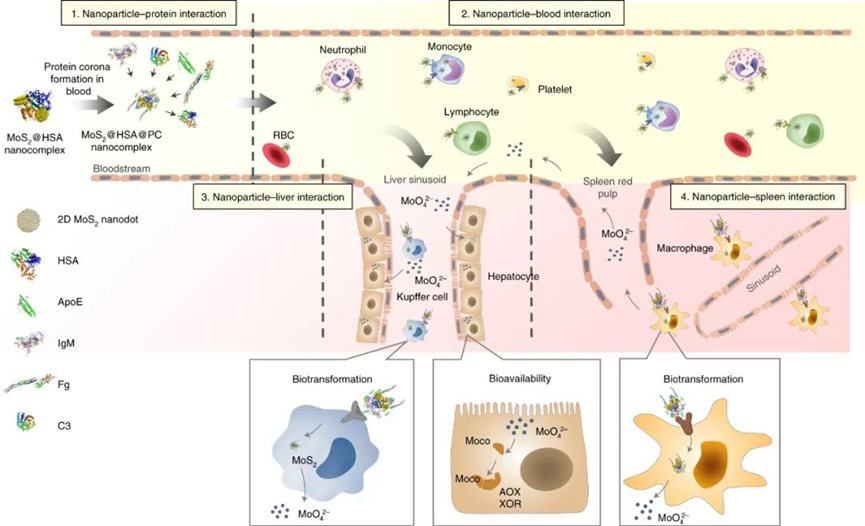
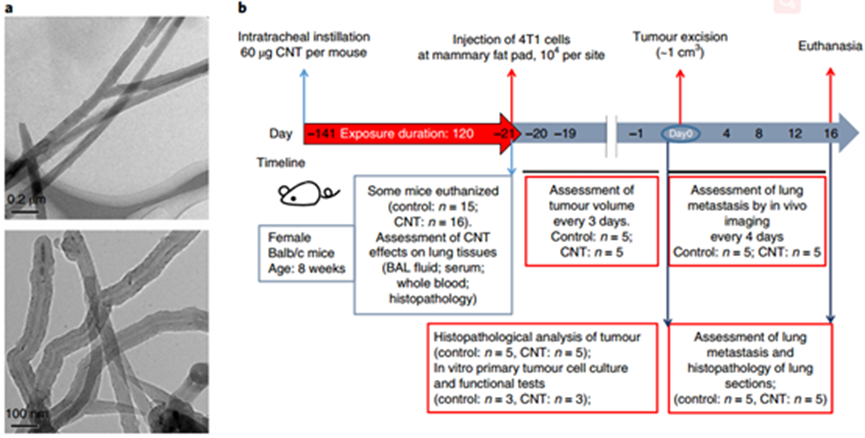
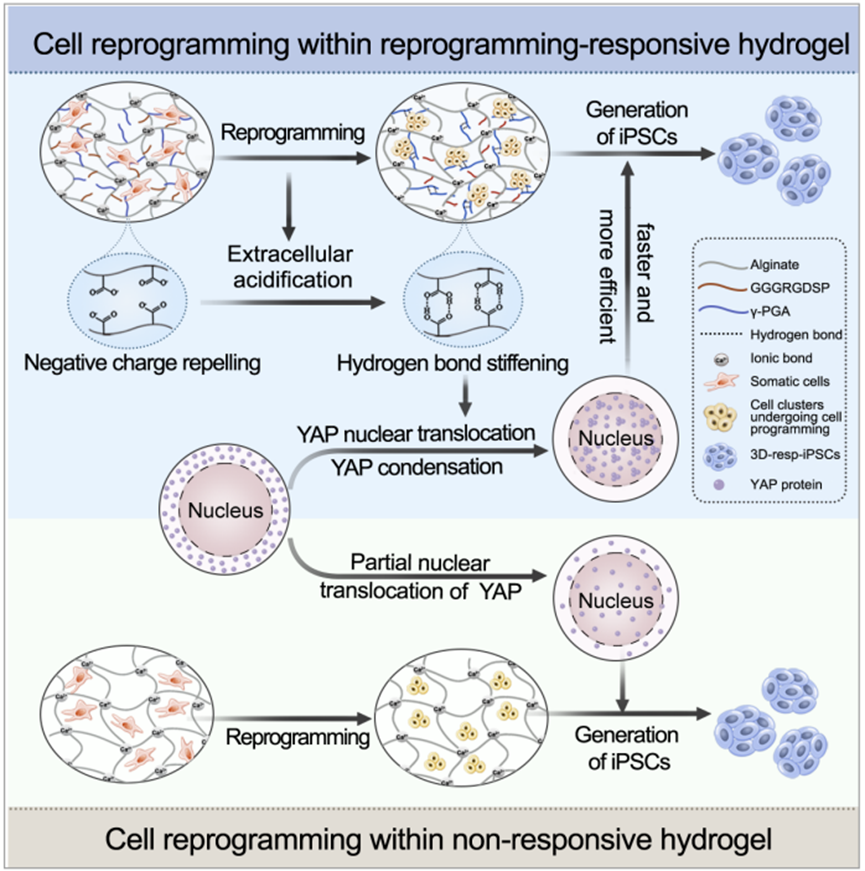
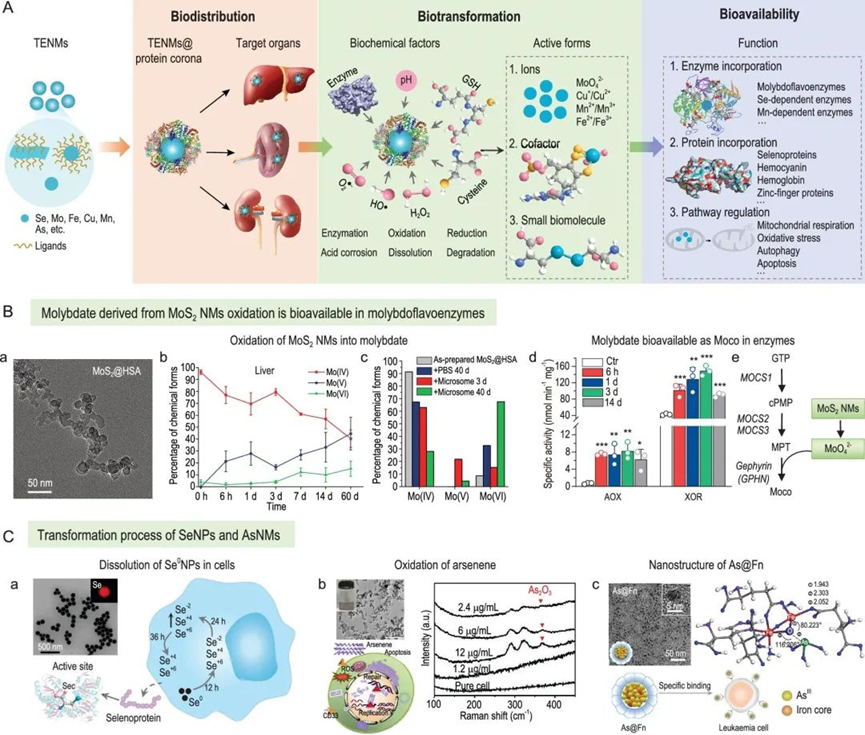
陳春英課題組長期從事納米蛋白冠的分析方法,進而發現了納米顆粒體內命運的隱身效應、遠端效應、生物可利用效應等生物學重要現象,指導納米佐劑與藥物遞送系統等應用研究。已在Nature Nanotechnology、Nature Methods、Nature Communications、PNAS、JACS、Angew Chem等國際學術期刊發表SCI論文390余篇。以下為納米人團隊整理的陳春英課題組近年來發表的代表性研究成果,供大家學習和交流~1.Nature Nanotechnology:氧合血紅蛋白飽和度NIR-IIb 成像用于評估癌癥代謝并預測免疫治療的反應國家納米科學中心鐘業騰、胡志遠、陳春英等人開發了一種受脈搏血氧計啟發的體內動態NIR-IIb-sO2成像技術,以直接可視化和定量評估大腦和腫瘤血管的sO2水平。可以實現在1,500–1,700nm NIR-IIb 窗口的體內動態sO2比率成像,這使我們能夠通過小鼠頭部和皮膚的完整頭皮/頭骨以及腫瘤組織正確評估血液血紅蛋白飽和度,幀速率≥ 30 Hz。腫瘤相關血管sO2水平變化的病理生理機制是復雜的、多因素的,有待進一步研究。然而,對癌癥代謝相關的腫瘤相關血管sO2 水平進行無創動態監測,結合腫瘤 PD-L1 表達狀態的體內評估,可以促進更準確地預測免疫治療反應和結果。Fang, Z., Wang, C., Yang, J. et al. Oxyhaemoglobin saturation NIR-IIb imaging for assessing cancer metabolism and predicting the response to immunotherapy. Nat. Nanotechnol. (2023).https://doi.org/10.1038/s41565-023-01501-42. Nature Nanotechnology:納米膠水,粘住病毒!中國科學院深圳先進技術研究院李洋、李紅昌聯合國家納米科學中心/高能物理研究所陳春英、王黎明和昆明動物研究所鄭永唐等人開發了一種廣譜的抗新冠納米材料-硫代磷酸銅銦(CuInP2S6,CIPS)納米片(NSs),一種超薄二維納米材料,它像膠水一樣粘住新冠病毒,其具有強大的抗病毒能力。研究人員將 2D CIPS NS描述為一種有效的納米膠水,能夠通過結合其 S 蛋白選擇性地捕獲 SARS-CoV-2 病毒,從而抑制宿主細胞的感染。CIPS 是一種安全、生物相容和可生物降解的二維納米材料,能夠抑制感染并促進SARS-CoV-2 的消除。CIPS 與SARS-CoV-2 S 蛋白 RBD 之間的結合比病毒對ACE2 的親和力強約 10,000 倍,這表明 CIPS 捕獲的病毒不會被釋放,也不會感染細胞。值得注意的是,CIPS 結合比最好的 mAb 強 23 到 100 倍,其廣泛的 RBD 結合能力使其對所有測試的 VOC 以及其他冠狀病毒同樣有效。其廣譜功效、儲存穩定性和良好的生物相容性使 CIPS 成為一種很有前途的抗 SARS-CoV-2 候選藥物。CIPS 對 SARS-CoV-2 S 蛋白的捕蠅紙狀和選擇性結合能力也使其特別有希望作為表面涂層材料和去污劑,在實驗室和臨床環境中控制病毒傳播并提高安全性。Zhang, G., Cong, Y., Liu, FL. et al. A nanomaterial targeting the spike protein captures SARS-CoV-2 variants and promotes viral elimination. Nat. Nanotechnol. (2022).https://doi.org/10.1038/s41565-022-01177-23.Nature Nanotechnology:源自納米材料的鉬融入鉬酶并影響其體內活性研究人員評估了體內MoS2納米點的生物動力學和分布,以及MoS2納米點與生物系統(納米粒子-蛋白質、納米粒子-血液、納米粒子-肝臟和納米粒子-脾臟)的基本相互作用。該課題組揭示了ApoE是負責組織之間MoS2 @ HSA納米復合物的運輸。經過對體內納米材料的運輸-轉化-生物利用度鏈的全面研究,證明MoS2 @ HSA納米復合物在肝竇和脾臟紅髓中被截獲,并且MoS2降解產生的氧化成分最終并入肝中的鉬酶中,影響其新陳代謝。因此,本文提出了關于帶有必需微量元素的納米材料的獨特體內命運。Cao, M., Cai, R., Zhao, L. et al. Molybdenum derived from nanomaterials incorporates into molybdenum enzymes and affects their activities in vivo. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00856-w4. Nature Nanotechnology:肺部長期暴露于多壁碳納米管會增強乳腺癌的級聯轉移碳納米管具有類似石棉的纖維結構和物理性質,最近在人類的肺組織中被發現。而關于碳納米管誘導的肺部病理研究大多局限于肺部或鄰近組織的炎癥或腫瘤病變。中國科學技術大學朱濤教授團隊和國家納米科學中心陳春英團隊合作,證明了肺部長期暴露于多壁碳納米管后可顯著增強血管生成和原位乳腺癌的侵襲性,進而導致其向肺部和其他器官的轉移。其機理在于暴露于多壁碳納米管后會刺激產生局部和全身性炎癥,這有助于形成轉移前和轉移性小生境。這一研究結果表明,納米材料誘發的肺部病變會對腫瘤的發生發展產生復雜而長期的影響。Xuefei Lu?, ChunyingChen, Tao Zhu?. et al. Long-term pulmonary exposure tomulti-walled carbon nanotubes promotes breast cancer metastatic cascades. NatureNanotechnology. 2019https://doi.org/10.1038/s41565-019-0472-45. Adv. Mater.:新型動態響應水凝膠可使細胞“重返青春”誘導多能干細胞(iPSC)在疾病建模、個性化醫學和組織工程中有著廣泛的應用。然而,利用傳統方法在體細胞中產生iPSC成本極高。國家納米科學中心聶廣軍研究員和陳春英研究員基于合成生物學策略制造了動態響應水凝膠。(1)這一細胞重塑響應水凝膠具有動態生物響應性,在細胞重塑過程中可及時感知代謝重塑和細胞外酸化,并可通過適當改變其自身機械性質進行響應。(2)該水凝膠的機械性質變化可以合理誘導Yes-associated protein(YAP)生物分子凝聚物的形成,從而可比傳統細胞重塑方法更快、更有效地生成iPSC。 Fei Zhu, et al. Cell Reprogramming-Inspired Dynamically Responsive Hydrogel Boosts the Induction of Pluripotency via Phase-Separated Biomolecular Condensates. Advanced Materials. 2023DOI:10.1002/adma.202211609https://onlinelibrary.wiley.com/doi/10.1002/adma.202211609納米材料(NMs)作為診斷和治療各種疾病的納米藥物具有巨大的潛力。研究人員竭盡全力設計具有新穎納米結構和智能有效載荷的多種納米藥物。但是納米藥物在靶位點發揮作用前后的穩定性如何?我們能做什么來最大限度地提高納米醫療的效率?過去二十年來,這些問題一直困擾著研究人員。鑒于此,國家納米科學中心陳春英研究員等認為納米材料的體內代謝過程是理解納米藥物安全性和有效性(終點)的關鍵因素。對這些過程的澄清可以彌合納米藥物的載體(結構設計)和終點(功效和/或安全性)之間的差距。(1)基于微量元素的NMs(TENMs)是潛在的生物活性物種。TENMs的精確結構設計和蛋白質電暈吸附的控制對于微量元素的傳遞和利用至關重要。(2)TENMs作為活性生物分子的生物利用度可能會導致有益的后果,尤其是在病理條件下。因此,在設計治療性納米平臺時,應更加關注其命運、生物動力學行為和體內生物利用度,以及其藥物功效的潛在機制。Mingjing Cao, Chunying Chen, National Science Review, Volume 9, Issue 10, October 2022, nwac119.https://doi.org/10.1093/nsr/nwac1197. JACS:納米藥物的蛋白冠的化學和生物物理特征國家納米科學中心陳春英研究員對納米藥物的蛋白冠的化學和生物物理特征相關研究進行了綜述。(1)在納米醫學的應用過程中,蛋白冠是一個難以解決的障礙,它是一種在生命系統中由納米粒子自發“收集”的生物分子物種。蛋白冠狀體在組成上是動態的,其可能會提高納米顆粒的水分散性,也有可能會降低納米顆粒的靶向遞送性能。這種非特異性蛋白質組合有多少是由納米顆粒的化學性質及其表面功能化決定的,又有多少是由體內時空變化的生物環境決定的?如何在不顯著影響納米藥物的診療功效的情況下,實現與蛋白冠的“和諧”共存并對其進行有效利用?這些問題也是納米醫學領域在未來的發展過程中所亟需解決的難題。(2)作者在文中詳細介紹了蛋白冠的化學和生物物理特征,并對納米醫學領域所面臨的挑戰和發展前景進行了討論。Jiayu Ren. et al. Chemical and Biophysical Signatures of the Protein Corona in Nanomedicine.Journal of the American Chemical Society. 2022DOI: 10.1021/jacs.2c02277https://pubs.acs.org/doi/10.1021/jacs.2c02277陳春英,中國科學院院士,國家納米科學中心研究員、博士生導師。國家杰出青年科學基金獲得者,中國科學院納米生物效應與安全性重點實驗室副主任,先后擔任國家重點研發計劃“納米科技”重點專項、“納米前沿”重點專項首席科學家。1996年在華中科技大學獲得博士學位,之后在中科院高能物理研究所、瑞典卡羅林斯卡大學諾貝爾醫學生物化學研究所從事博士后研究工作。2002年在中科院高能所納米生物效應與安全實驗室,任課題組長。2006年6月加入國家納米科學中心。先后主持科技部國家重點研發計劃“納米科技”重點專項和“納米前沿”重點專項、國家自然科學基金委國家重大科研儀器研制項目、國家自然科學基金委重大研究計劃重點支持項目、歐盟第六、第七框架計劃(EU-FP6&FP7)、歐盟“地平線2020”計劃、德國聯邦教育與研究部合作項目、丹麥戰略研究委員會項目、丹麥科技與創新局項目、國際原子能機構協調研究計劃(IAEA)等多項國內與國際合作項目。先后當選中國化學會會士、美國醫學與生物工程院會士、英國皇家化學會會士。應邀擔任著名國際組織ISO、WHO和OECD的專家。被Nature Nanotechnology評價為該領域Leading Scientist(引領科學家),并被Nature人物專訪。擔任ACS Nano副主編以及 Science Bulletin, Bioconjugate Chemistry, Engineering, Metallomics, Nano Today, Nanoscale Horizons, Nanoscale, Nanotoxicology, Particle and Fibre Toxicology和Current Drug Metabolism等多個期刊的編委或顧問編委等。兩次榮獲“國家自然科學二等獎(2018年排名第一,2012年排名第二)”;2019年作為納米生物效應與安全性研究集體的“突出貢獻者”獲“中國科學院杰出科技成就獎”;2023年獲“IUPAC化學化工杰出女性獎”;2022年獲“中國科學院大學領雁獎”;2021年獲“中國科學院優秀導師獎”,“全國五一巾幗標兵”,英國皇家化學會“Environment Prize”,美國化學會“Bioconjugate Chemistry講座獎”;2020年獲“發展中國家科學院TWAS化學獎”(2022年頒獎);2019年獲得“中國毒理學杰出貢獻獎”;2018、2017、2014年分別入選Clarivate Analytics公布的“全球高引用科學家”;2017年獲中科院第五屆“十大杰出婦女”;2014年獲第十一屆“中國青年女科學家獎”,入選“國家百千萬人才工程”,獲得“有突出貢獻中青年專家”稱號;2011年被評為“中國標準化杰出人物-創新人物”;2008年獲“北京市科學技術進步獎二等獎(第二獲獎人)”。目前主要從事納米蛋白冠的分析方法及其化學生物學效應、納米材料生物體內行為的檢測方法與機制、納米佐劑與遞送系統研究。研究成果在Nature Nanotechnology、Nature Methods、Nature Communications、PNAS、JACS、Angew Chem等國際學術期刊發表SCI論文390余篇,有37篇入選ESI-TOP 1%高被引論文,研究成果被引用>4.3萬次,H-Index為109(Google學術)。2019年應邀為Nature Nanotechnology撰寫Nanomedicine領域Correspondence文章,評述納米生物醫學研究方法學進展。中國授權發明專利45項,國際授權PCT發明專利1項(美國、歐盟、日本)。主編中英文專著8部,分別由英國RSC、德國Wiley、科學出版社和冶金工業出版社出版。(簡介源自國家納米科學中心官網)