
作為一種腫瘤免疫療法,腫瘤疫苗接種喚起對突變產生的腫瘤抗原具有特異性的T細胞,以實現對腫瘤細胞的免疫識別和消除。在這個過程中,抗原呈遞細胞(APC)向T細胞的有效抗原呈遞是一個基本特征。目前提高腫瘤疫苗接種效力的方法集中在疫苗配方上,包括使用免疫佐劑促進APC的成熟,以及使用納米載體提高APC中的抗原處理效率。作為先天免疫細胞,APC本身的效力通常被認為是一致的,不會影響健康人的疫苗效力。然而,越來越多的證據表明,在不同的情況下,先天免疫細胞的效力是可變的,在不同情況下,這些細胞對免疫反應和免疫療法具有高度影響。先天免疫細胞的長期功能重編程發生在遇到初級免疫刺激后。即使在不同的刺激下,這種改變也會增加后續刺激的反應效力。先天免疫細胞的這種記憶樣能力被稱為“訓練免疫”。經過訓練的免疫是由骨髓中造血祖細胞的表觀遺傳學改變驅動的,因此,在誘導經過訓練的免疫力后,先天免疫細胞的高效力狀態通過具有記憶樣表型的外周先天免疫細胞持續分化和產生而持續數月。可以假設,誘導經過訓練的免疫力是提高腫瘤疫苗接種效果的一種很有前途的策略。
某些促炎刺激物,如 β-葡聚糖、卡介苗 (BCG) 疫苗、氧化低密度脂蛋白和尿酸,已被確定為經過訓練的免疫誘導劑。這些刺激對造血祖細胞的影響是間接的,其中白細胞介素-1 (IL-1) 細胞因子家族,尤其是 IL-1β,是主要的中介物。一些經過訓練的免疫誘導劑可以通過激活體內炎癥小體信號通路引起IL-1β分泌,最終導致骨髓中造血祖細胞的表觀遺傳重塑和譜系轉變。大多數炎性體傳感器,例如包含蛋白 3 (NLRP3) 的Nod樣受體(NLR) 家族 pryin 結構域 (PYD)、包含蛋白 4 (NLRC4) 的 NLR 家族C 末端 caspase 招募結構域 (CARD) 和 caspase-11,都是位于細胞質中。與自由刺激相比,納米結構刺激由于其更容易進入細胞內吞作用和多重激活特性,可能會誘導更強的炎癥小體信號通路激活和IL-1β分泌,從而產生更強大的訓練免疫力。
外膜囊泡(OMV)是源自革蘭氏陰性細菌的天然納米囊泡。由于存在多種病原體相關分子模式(PAMP),例如肽聚糖、脂多糖(LPS)和鞭毛蛋白,納米囊泡具有激活先天免疫信號通路的強大能力。OMV已被認為是疫苗佐劑和載體。盡管 OMV 被哺乳動物細胞內吞,并將 LPS 遞送到胞漿中以觸發 caspase-11 炎癥小體,但 OMV 對訓練后的免疫力的潛在刺激作用仍未被探索。
鑒于此,國家納米科學中心聶廣軍、趙瀟等研究人員利用含有大量病原體相關分子模式的細菌源性外膜囊泡進行預疫苗接種,可以通過訓練有素的免疫力來增強和增強腫瘤疫苗接種。
該研究利用了大腸桿菌來源的外膜囊泡(OMV),通過顯微鏡和純化技術進行了表征。OMV 批次之間一致的形態和蛋白質組成驗證了提取方法。腹腔注射 OMV(150μg)證明了免疫刺激和安全給藥。OMV 注射后 7 天,免疫系統狀態恢復到基線。預先施用 OMV 顯著增強了抗原呈遞細胞對后續腫瘤疫苗接種的反應,擴大了外周免疫器官。觀察到樹突狀細胞和巨噬細胞增加,以及成熟和抗原呈遞標記物增加。
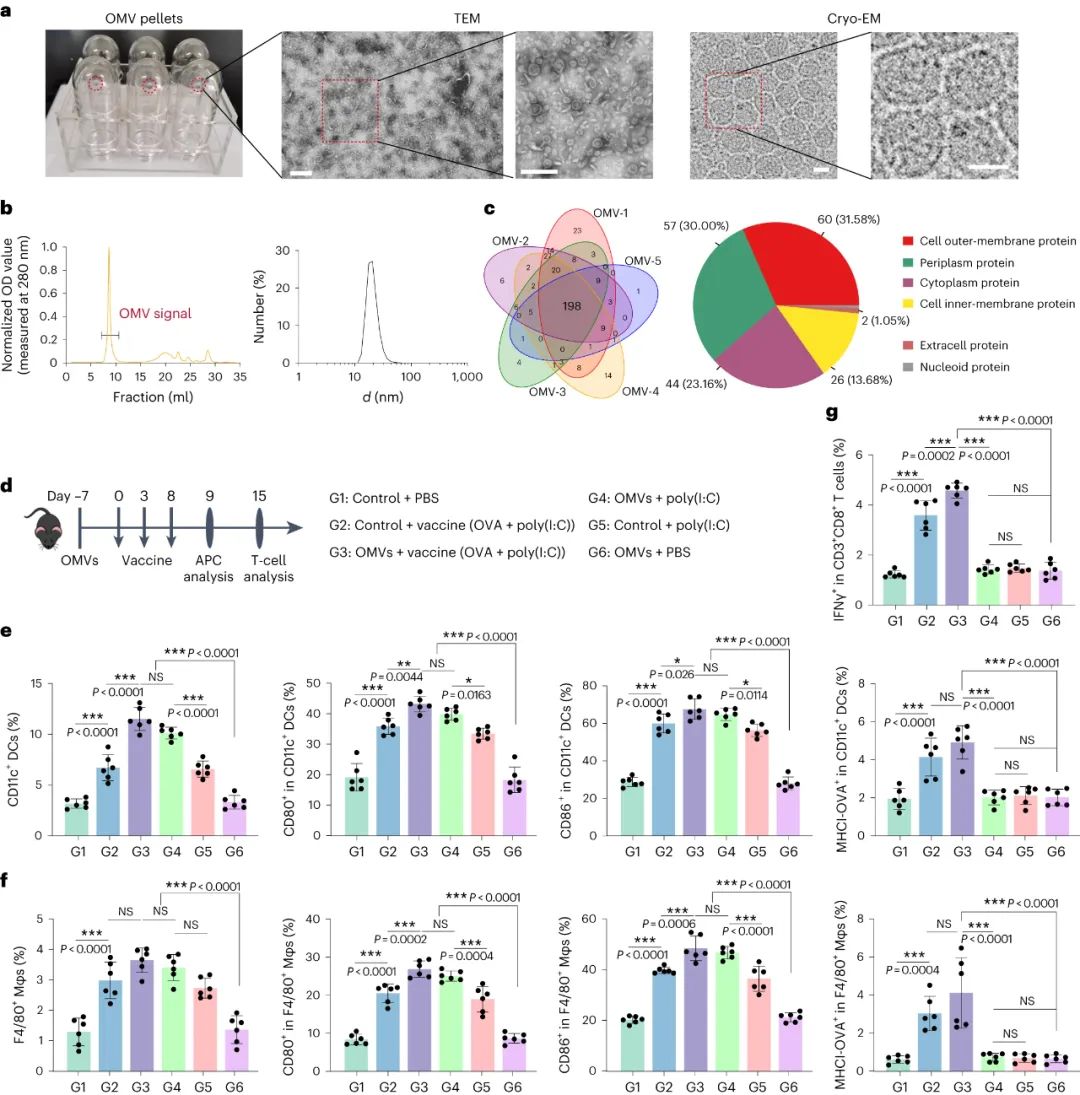
圖|預用OMVs加強腫瘤疫苗接種
對 OMV 訓練小鼠腫瘤疫苗接種后淋巴結中的樹突狀細胞 (DC) 和巨噬細胞 (Mφ) 進行轉錄組測序,結果顯示 DC 中有 283 個差異表達基因,Mφ中有665 個差異表達基因。在 DC 中,256 個轉錄本上調,27 個轉錄本下調;在 Mφ 中,496個轉錄本上調,169 個轉錄本下調。基因本體(GO)富集分析強調了免疫相關途徑,包括補體激活、體液免疫反應、對細菌的防御反應、適應性免疫反應和抗原結合。OMV 訓練小鼠中上調的基因包括與先天免疫激活(Calr3、Rfx5、Psme2b、Atg7、Lamp1、H2-D1、H2-K1)、共刺激(CD80、CD86)、細胞因子(IL6、IFNG、IL1β)相關的基因 DC 和 Mφ 中的 Cxcl10、C3、Tnfaip3)和趨化因子(Icam1、Ccr9、Ccl25、Zap70)。這些發現表明,OMV 給藥廣泛增強了小鼠對后續腫瘤疫苗接種的先天免疫反應。
該研究深入探討了OMV對祖細胞水平的先天免疫和表觀遺傳重塑的影響。轉錄組測序揭示了 OMV 訓練小鼠腫瘤疫苗接種后樹突狀細胞 (DC) 和巨噬細胞 (Mφs) 中基因表達的差異。骨髓分析顯示造血祖細胞亞群發生變化,多能祖細胞 (MPP) 和偏向骨髓的 MPP3 亞群增加。在 OMV 訓練的小鼠中,骨髓祖細胞 (MyPs) 和粒細胞巨噬細胞祖細胞 (GMPs) 增加,而共同骨髓祖細胞 (CMPs) 減少。研究結果表明,OMV 不僅促進骨髓分化,而且還在祖細胞中印記表觀遺傳變化,從而在隨后的腫瘤疫苗接種過程中,在訓練有素的抗原呈遞細胞 (APC) 中有效轉錄免疫相關基因。
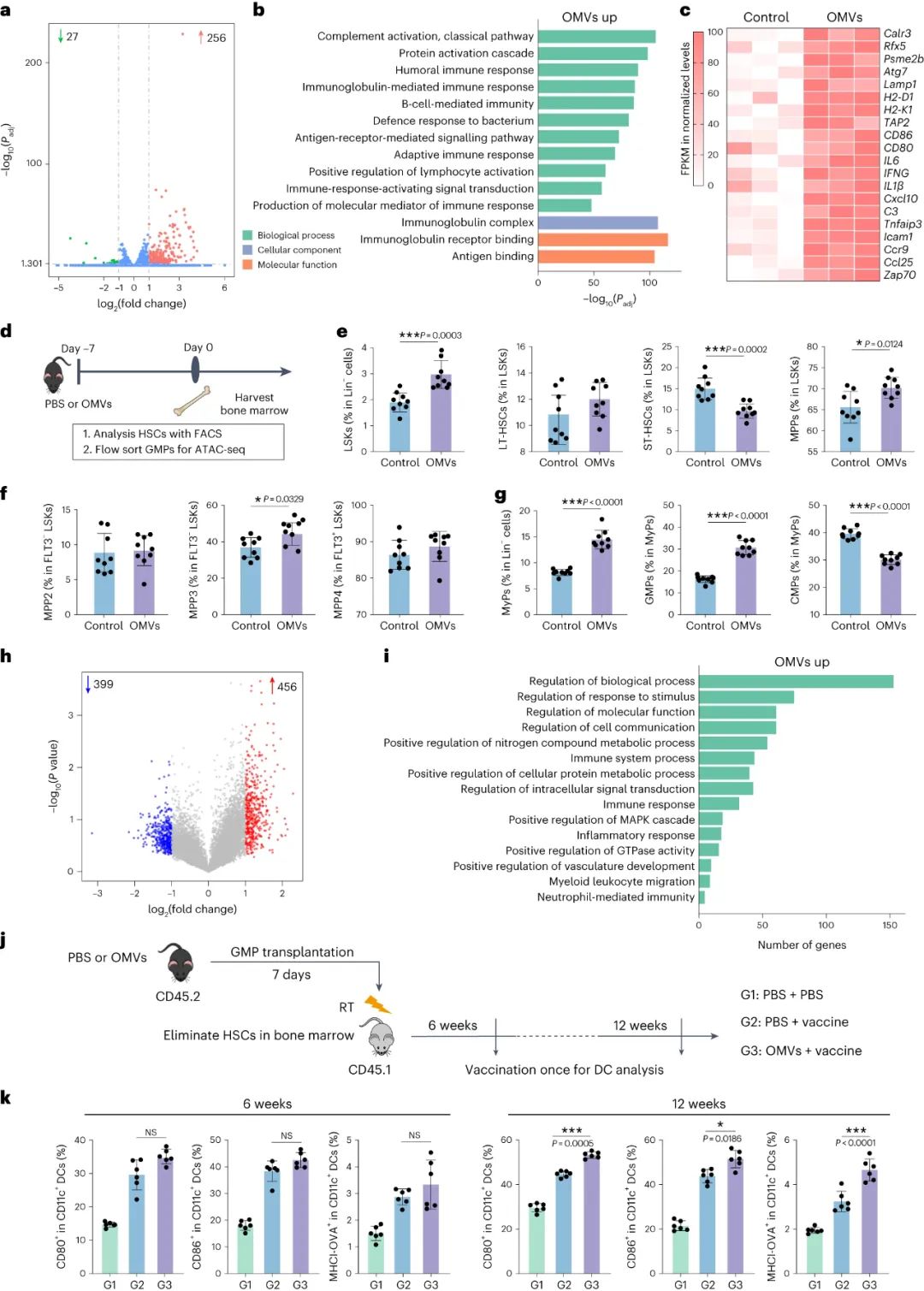
圖|預先施用OMVs誘導腫瘤疫苗接種后DC的轉錄組改變,并導致造血祖細胞的譜系轉變和表觀遺傳學重塑
腹腔注射后 OMV 的體內行為顯示先天免疫細胞快速攝取,無需直接進入骨髓。OMV預給藥后,炎癥細胞因子(尤其是IL-1β)的血清水平顯著升高,骨髓細胞外液也相應升高。IL-1β是公認的訓練免疫誘導劑,使用IL-1受體拮抗劑(IL-1RA)和中和抗體的實驗表明,當IL-1β信號傳導被阻斷時,OMV誘導的造血祖細胞變化,包括骨髓分化偏向,被逆轉。在 OMV 訓練的小鼠中,阻斷 IL-1 受體會阻礙樹突狀細胞和巨噬細胞對隨后的腫瘤疫苗接種的反應增強,從而導致與對照小鼠中觀察到的類似的抗原特異性 T 細胞反應。這些發現強調了 IL-1β 作為 OMV 誘導的骨髓生成變化介質的關鍵作用,以及在隨后的腫瘤疫苗接種過程中訓練的免疫效應。
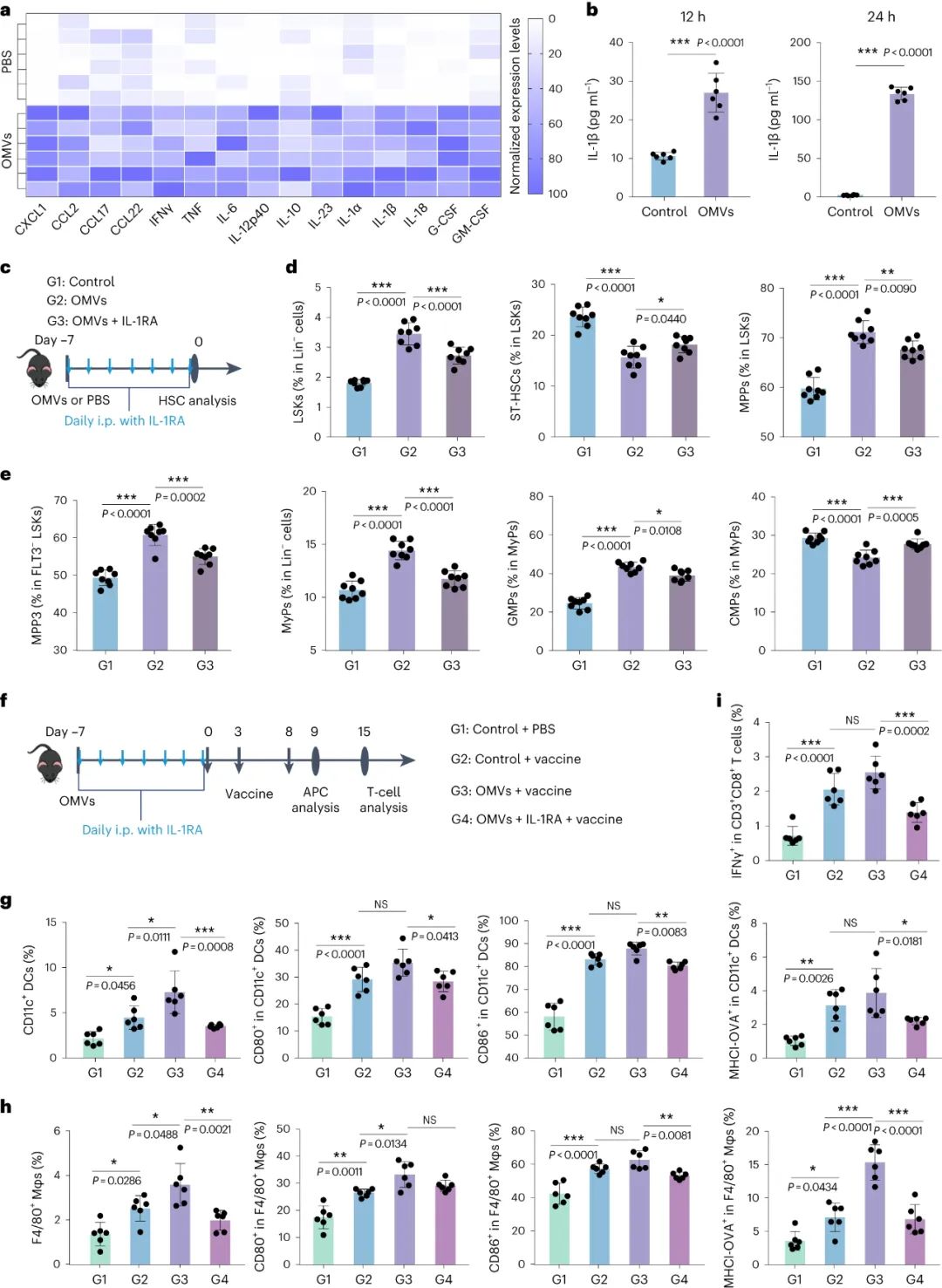
圖|OMVs通過刺激IL-1β分泌誘導骨髓生成改變
IL-1β的產生涉及兩個步驟:IL-1β 轉錄上調的“啟動步驟”和導致 caspase-1 成熟和 IL-1β 分泌的“激活步驟”。用 OMV 處理的骨髓來源細胞的體外實驗顯示出顯著的 IL-1β 產生,表明 NLRP3 炎性體激活。抑制NLRP3或caspase-1可減少OMV誘導的IL-1β 分泌。探索了NLRP3炎性體激活在增強 OMV 預給藥后后續腫瘤疫苗接種反應性中的作用。OMV 治療的小鼠表現出增強的免疫反應,但抑制炎性體激活顯著降低了這些效應,影響了脾細胞中的 APC、短壽命效應細胞、記憶前體效應細胞和抗原特異性 T 細胞。這表明OMV對后續腫瘤疫苗接種誘導的訓練免疫效應主要是通過炎性體信號通路介導的。
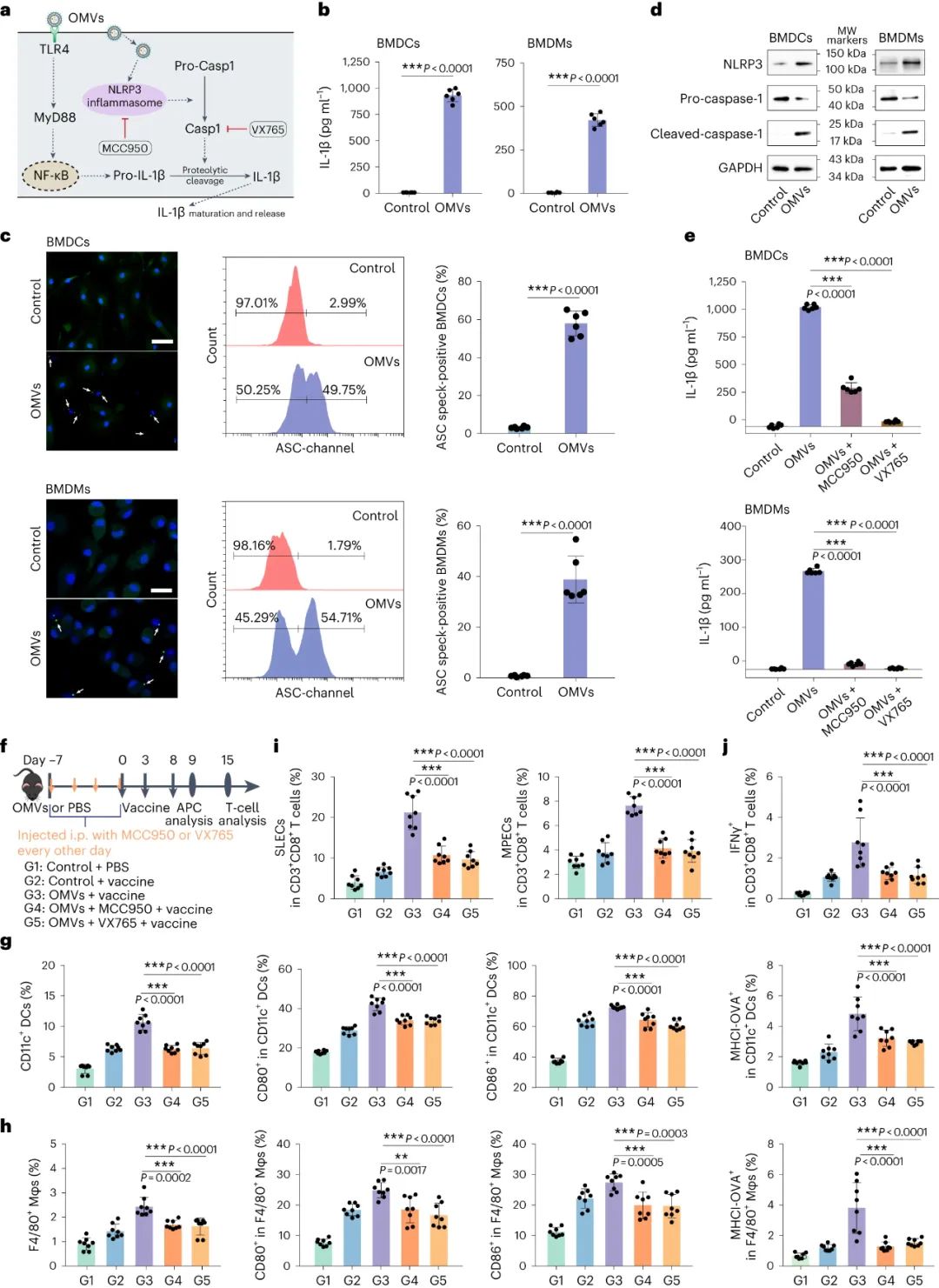
圖|OMVs通過NLRP3炎癥小體信號傳導誘導IL-1β的產生
OMV 表面的脂多糖 (LPS) 激活caspase-11相關的非典型炎癥小體,導致K+流出和典型 NLRP3 炎癥小體激活。OMV 有效地將 LPS 傳遞到 BMDC 和 BMDM的胞質中,觸發 caspase-11 成熟和 IL-1β 產生。OMV 內吞作用的化學抑制可減少 IL-1β 的分泌,證實了 OMV 作為 LPS 遞送納米顆粒載體的作用。比較 OMV 和游離 LPS 預給藥對后續腫瘤疫苗接種的影響,只有 OMV 訓練才能增強APC 和 T 細胞反應,突出了 OMV 在細胞內遞送 LPS 方面的重要性。caspase-11 敲除小鼠中缺乏疫苗增強作用進一步支持了這種差異,強調了 OMV 刺激 caspase-11 依賴性 IL-1β 產生和經過訓練的免疫介導的疫苗增強的獨特能力。

圖|OMVs通過將LPS遞送到胞質溶膠中來激活炎癥小體信號傳導
在肺轉移性B16-OVA和皮下 MC38 腫瘤模型中,預先施用OMV顯著提高了后續腫瘤疫苗接種的治療效果。接受 OMV 訓練的小鼠在接種疫苗后表現出更高的抗原特異性 T 細胞活化、分離的脾細胞更強的細胞毒性作用以及增加的腫瘤浸潤 CD8+T 細胞。對健康小鼠免疫記憶的評估顯示,經過 OMV 訓練的小鼠中效應 T 細胞和中樞記憶 T 細胞明顯增多,從而增強了對腫瘤挑戰的長期抵抗力,減緩了腫瘤生長并延長了生存期。該研究表明,OMV 可以激活經過訓練的免疫力,從而改善抗腫瘤反應和長期保護作用,突顯 OMV 作為增強腫瘤疫苗接種的獨特免疫動員策略的潛力。
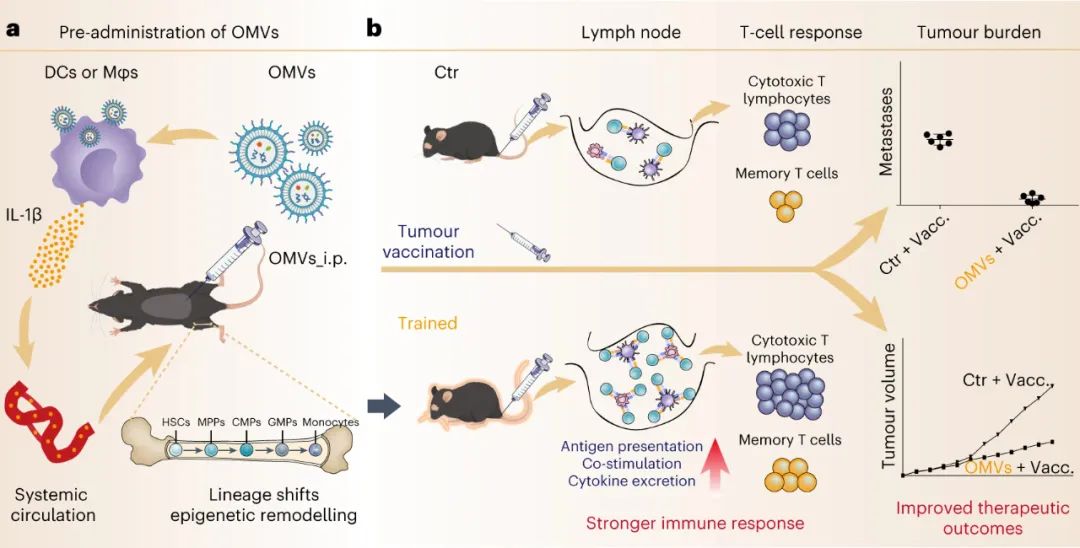
圖|基于OMV誘導的訓練免疫增強腫瘤疫苗接種的免疫動員示意圖
總之,研究人員報告了在腫瘤疫苗接種前一周向小鼠腹腔注射細菌 OMV 可顯著增強抗腫瘤免疫力,其中 OMV 誘導的訓練免疫力是其因果機制。由于其天然的納米結構,OMV被腹膜內先天免疫細胞內吞,同時將PAMP(特別是LPS)輸送到細胞質中,從而激活炎癥小體信號通路,誘導IL-1β分泌。IL-1β進入骨髓導致造血祖細胞的譜系轉變和表觀遺傳學重塑,最終使分化的外周APC對隨后的腫瘤疫苗接種表現出增強的反應性。這種免疫動員策略使用源自細菌的天然納米囊泡來改變基本的先天免疫功能,是積極引導疫苗誘導的適應性免疫反應的一種很有前途的方法。
參考文獻:
Liu, G., Ma, N., Cheng, K. et al. Bacteria-derived nanovesicles enhance tumour vaccination by trained immunity. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01553-6











