
特別說明:本文由米測技術中心原創撰寫,旨在分享相關科研知識。因學識有限,難免有所疏漏和錯誤,請讀者批判性閱讀,也懇請大方之家批評指正。在α-碳中心含有兩個不同碳基取代基的非天然手性α-叔氨基酸廣泛存在于生物活性分子中,這種空間剛性支架正在成為藥物發現領域日益增長的研究興趣。然而,由于立體選擇性構建空間阻礙的四取代立體碳中心的挑戰,手性α-叔氨基酸合成的穩健方案仍然稀缺。有鑒于此,華東理工陳宜峰、曲景平等人報道了鈷催化的酮亞胺與各種未活化的烷基鹵化物(包括烷基碘、烷基溴和烷基氯)的對映選擇性aza-Barbier反應,實現了手性 -叔氨基酯的高對映選擇性和優異的官能團耐受性的形成。在該不對稱還原加成方案中,一級、二級和三級有機親電子試劑均被耐受,這為充分利用對濕氣和空氣敏感的有機金屬試劑的對映選擇性親核加成提供了補充方法。此外,α-酮酯、胺和鹵代烷的三組分轉化代表了羰基的形式不對稱脫氧烷基胺化。 aza-Barbier反應是在還原劑存在下,利用烷基鹵化物對不飽和碳雜原子鍵進行親電加成,是醇和胺合成的一種通用合成方法。該反應形成類似手性氨基酸衍生物的挑戰在于從烷基鹵化物前體原位產生的自由基的對映體面的區分。本工作設想在手性配體誘導的幫助下,選擇鈷催化劑捕獲原位形成的烷基自由基物種,以生成親核手性烷基-Co物種。該策略可以提供區分酮亞胺的對映體面的可能性,從而完成四取代立體中心的構建。烷基自由基與鈷中心的快速結合對于通過避免側外消旋自由基加成序列來實現高對映選擇性至關重要。在此,通過鑒定酮亞胺與未活化的烷基鹵化物的鈷催化親電烷基化加成,描述了用于α-叔氨基酯合成的對映選擇性aza-Barbier反應平臺。
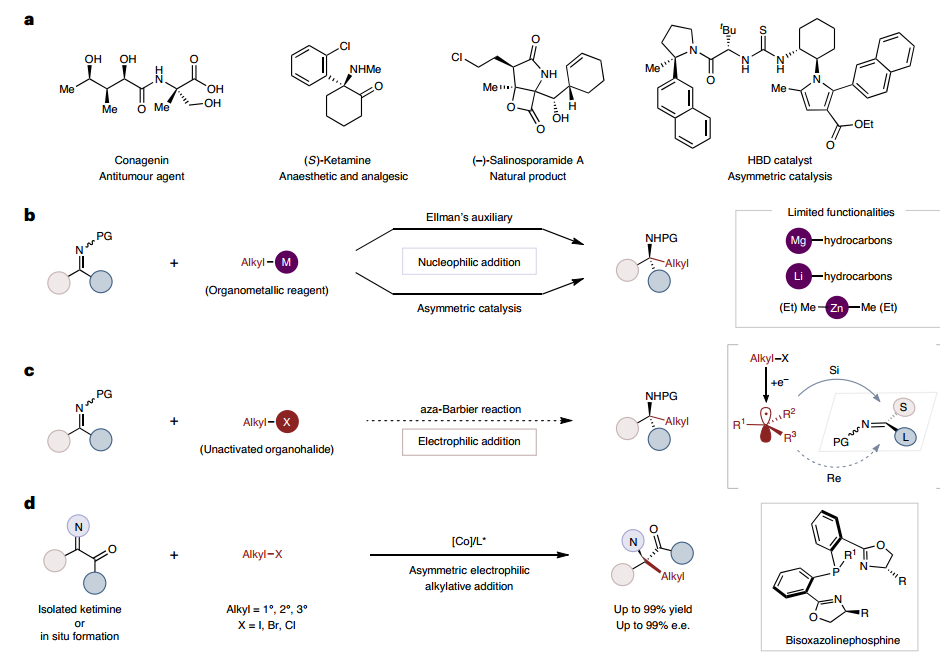
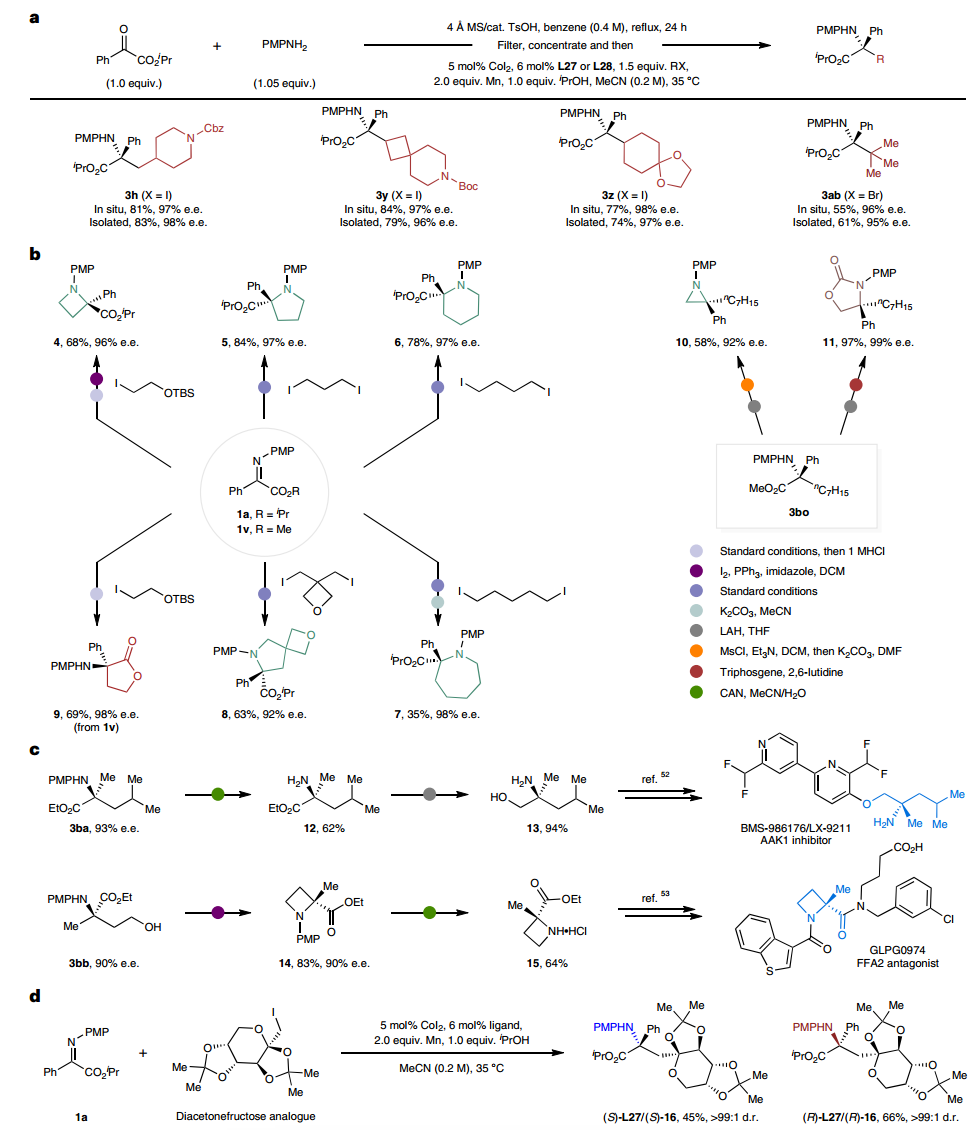
作者選擇模型底物驗證了所提出方案的通用性,該方案在標準條件下與各種伯烷基碘反應良好,以良好的產率和優異的對映選擇性提供相應的手性 α-叔氨基酯,甚至可以進行克級反應。為了進一步證明該方案的實際合成應用,進行了各種轉化。通過酮酯和苯胺縮合原位形成的酮亞胺的共催化aza-Barbier反應提供了α-氨基酯,證實了羰基的正式不對稱脫氧雙官能化烷基胺化。此外,作者還證實了該方案可以有效地構建在α位具有四元立構中心的含氮雜環,通過采用不同的酮亞胺底物與叔丁基(2-碘乙氧基)二甲基硅烷在簡單的條件下可以選擇性地獲得手性氮雜環丁烷和γ-內酯,表明了該方案適用于藥物化學領域。
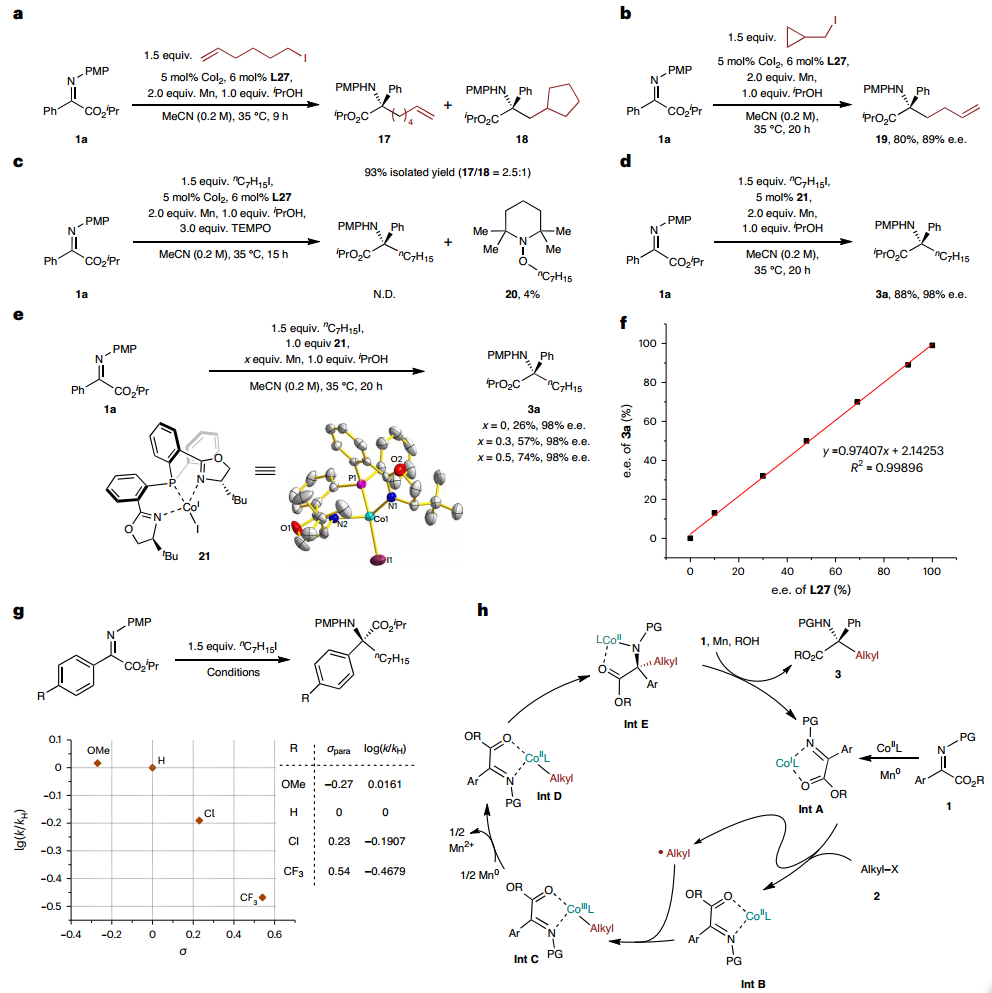
為了更深入地了解反應機理,作者進行了幾項初步的機理研究,表明了單電子轉移(SET)過程在反應過程中產生烷基自由基的可能性,Co(I)絡合物可能是反應的引發劑。作者通過在與Co(I)絡合物的化學計量反應中評估了不同量的Mn還原劑,更深入地了解反應過程中鈷中心的氧化態,表明烷基-Co(III)物質可能不是反應物質。而反應過程中可能會發生Co(I)和烷基-Co(III)物質之間的氣化過程,從而產生用于后續遷移插入步驟的反應性烷基-Co(II)中間體,烷基-Co(II)物質可能是催化循環中的活性Co物質。
Wu, X., Xia, H., Gao, C. et al. Modular α-tertiary amino ester synthesis through cobalt-catalysed asymmetric aza-Barbier reaction. Nat. Chem. (2023). https://doi.org/10.1038/s41557-023-01378-9















