

第一作者:Shang-Zheng Sun
通訊作者:Todd K. Hyster
通訊作者單位:普林斯頓大學
光酶催化(Photoenzymatic catalysts)具有可調控的酶催化位點,因此是具有前景的立體選擇性自由基轉化方法學。當使用黃素蛋白(flavoproteins)用于非天然的光酶催化反應,通常由自由基方式開啟反應。羧酸和有機胺等廣闊的官能團能夠通過氧化反應產生自由基。但是黃素蛋白的激發態通常容易被蛋白的骨架結構淬滅,導致黃素蛋白的激發態壽命非常短暫。
有鑒于此,普林斯頓大學Todd K. Hyster等報道黃素蛋白烯還原酶(flavin-dependent ′ene′-reductases)加入外源的Ru(bpy)32+輔酶,構筑的光酶催化體系在氧化還原中性的條件在氨基酸和乙烯吡啶之間進行偶聯,這種光酶催化反應具有高產率和優異的立體選擇性。而且,通過不同立體結構的酶,得到不同立體結構產物。
反應機理研究發現Ru(bpy)32+結合在蛋白的骨架上,這有助于自由基在酶催化位點形成。這項工作拓展了光酶催化反應的不對稱催化反應類型,提供一種光酶催化產生自由基的新方法。
解決的關鍵問題和技術
通過酶催化的立體選擇性與光催化結合,實現控制自由基中間體的立體反應選擇性。將Ru(bpy)32+光敏分子引入酶,構筑新型光酶催化反應。
背景
使用酶催化探索新型反應
酶催化是一種非常獨特的選擇性催化方法學,酶催化用于催化生命的基本反應。通過多種多樣的突變技術能夠改變多肽骨架結構,因此通常酶催化通常對多肽骨架進行優化。但是,與蛋白結合的輔酶通常用于在催化反應中構成化學鍵。
黃素蛋白輔酶
當探索自然酶催化非自然反應的催化反應,輔酶的催化反應能力是驅動研究的主要動力。人們知道黃素蛋白是多功能的輔酶,不同氧化態的黃素蛋白能夠表現不同的反應機理。在過去的6年間,人們發現黃素氫醌(FMNhq, flavin hydroquinone)和黃素半醌(FMNsq,flavin semiquinone)在基態和激發態都能夠引發單電子自由基還原反應。
天然酶催化自由基反應的局限
由于較高的電極電勢的還原比較困難,因此通常酶催化劑無法兼容比較高的還原電極電勢。此外,由于自由基是受到酶可控制電荷轉移,因此電荷轉移是局域性的,而且酶在催化含有自由基的反應中通常避免生成反應性的自由基物種,因為反應活性自由基物種溶劑損壞蛋白的結構。

圖1.光酶協同催化體系機制
設計光催化-酶催化體系
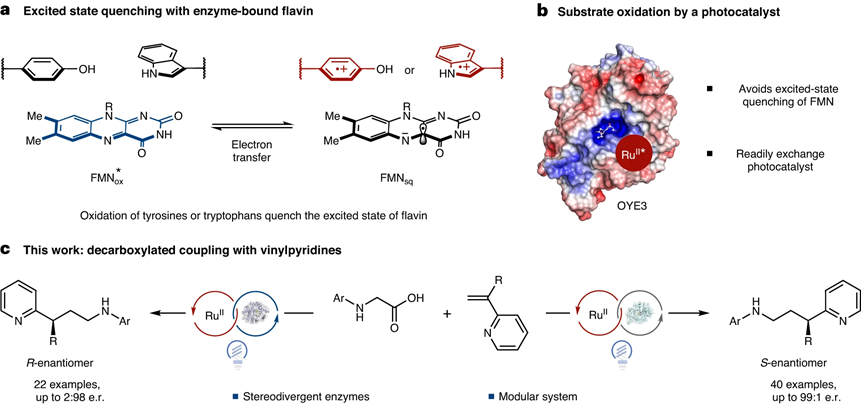
圖2.反應體系設計
我們發展了在蛋白酶催化位點進行控制生成氧化自由基的方法。通過引入Ru(bpy)32+作為輔酶,氨基酸底物發生脫羧反應后,與烯烴吡啶進行烷基化反應,能夠得到92 %的產率和高達99:1的立體選擇性。
要點1. 反應條件優化

圖3.反應優化
以N-苯基甘氨酸(1a)和烯烴吡啶(2a)作為反應物在氧化還原中性環境進行脫羧偶聯。在之前的工作中,作者發現ERED與Ru(bpy)3Cl2結合能夠將烯烴吡啶不對稱還原。因此當將該體系用于本文發展的反應,發現目標產物的產率達到83 %,而且立體選擇性達到80:20。因此,測試了多種同源ERED,發現OYE3在光酶催化反應中實現90 %的產率和S構型產物93:7 er立體選擇性。此外,篩選ERED過程中發現GluER-T36A能夠以70:30 e.r.選擇性生成R型立體結構產物。隨后對其他變體進行考察,發現GluER-T36A-Y343D實現了更高的立體選擇性(89:11 e.r.),同時產率為44 %。
要點2. 機理研究
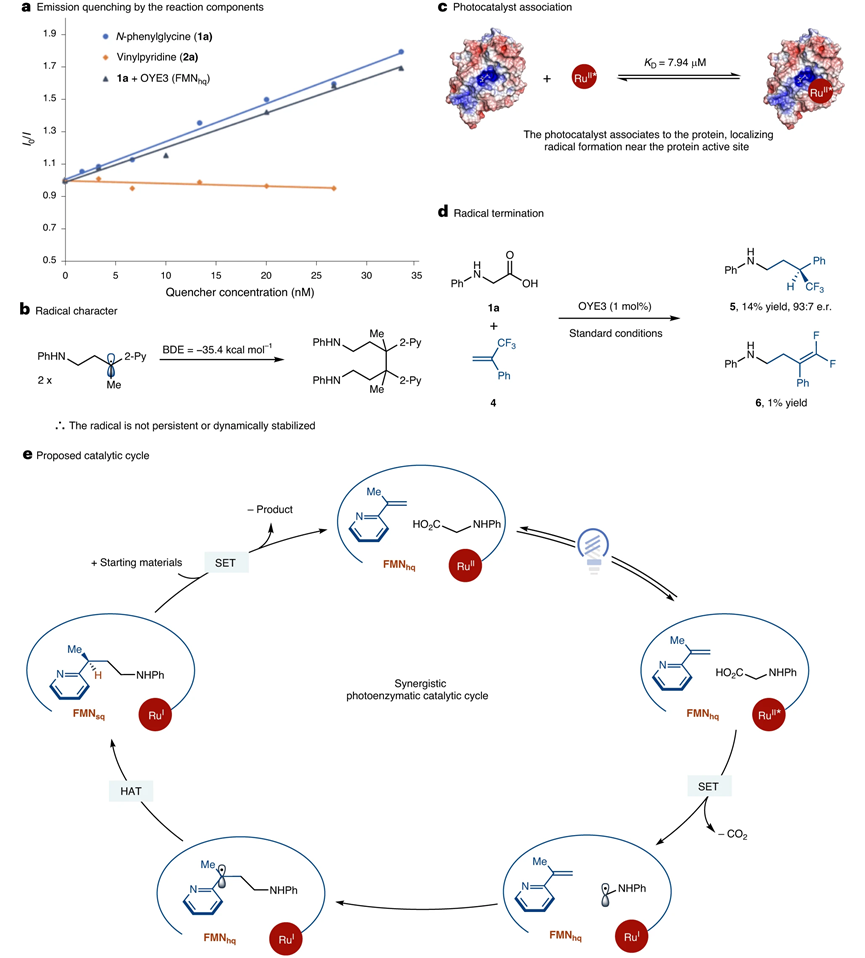
圖4.機理研究
作者通過實驗和理論計算研究體系能夠實現立體選擇性的機理。首先假設ERED通過質子耦合電子轉移方式將底物分子氧化。但是實驗結果發現并非如此,因為蛋白結構的存在并沒有導致氧化脫羧反應步驟的速率加快。而且我們發現蛋白是否存在未對脫羧反應的速率產生影響,說明蛋白沒有加快羧酸氧化反應的速率,并且通過Stern-Volmer淬滅實驗驗證蛋白結構未曾提高脫羧氧化反應的速率。
隨后作者通過實驗判斷C-C自由基偶聯反應是否在溶液中發生。通過DFT理論計算,發現自由基二聚反應釋放的C-C能量為35.4 kcal mol-1,然而產物中C-C鍵的能量為80 kcal mol-1,這說明脫羧產生的自由基不能在溶液中穩定存。
作者還考察自由基在蛋白的活性位點生成的可能性。通過熒光淬滅反應進行驗證,時間分辨熒光淬滅實驗結果顯示OYE3耦合的Ru(bpy)32+淬滅過程為靜態淬滅機理,酶和Ru(bpy)32+之間具有非常強的耦合作用,從而說明自由基是在蛋白附近形成的。
基于以上驗證實驗,提出可信度較高的反應機理。首先光激發Ru(bpy)32+將ERED從FMNox還原為FMNhq。隨后N-苯基甘氨酸和烯烴吡啶結合在蛋白的催化活性位點。Ru(bpy)32+的激發態將氨基酸的羧酸氧化生成α-氨基自由基,同時[Ru(bpy)32+]*還原為Ru(bpy)31+。生成的α-氨基自由基與烯烴吡啶偶聯生成芐基自由基。當使用含有環丙烷官能團的烯烴吡啶反應生成環丙烷開環的產物,說明生成C-C化學鍵的過程是自由基機理。當使用α-三氟甲基苯乙烯進行反應,發現脫氟產物產量僅有1 %,說明通過氫原子轉移方式實現自由基終止反應。
要點3. 底物拓展
作者考察該反應的兼容情況。吡啶官能團的鄰位、間位、對位含有取代基的烯烴吡啶能夠以較好的產率和立體選擇性進行反應(3, 7-17)。除了2-吡啶,該體系也兼容嘧啶(18)、吡嗪(19, 20)、噻唑(25, 26)、3-吡啶(21)、4-吡啶(22),而且產率和立體選擇性較好。
但是OYE3只對α-位點兼容體積較小的官能團,對于體積較大的雜環或者烷基,產物的立體選擇性都有所降低。

圖5.底物拓展
參考文獻及原文鏈接
Shang-Zheng Sun, Bryce T. Nicholls, David Bain, Tianzhang Qiao, Claire G. Page, Andrew J. Musser & Todd K. Hyster, Enantioselective decarboxylative alkylation using synergistic photoenzymatic catalysis, Nat Catal(2023)
DOI: 10.1038/s41929-023-01065-5
https://www.nature.com/articles/s41929-023-01065-5











