1.AM:納米顆粒結合TLR7/8激發劑用于抗腫瘤的局部免疫療法
局部治療是指將腫瘤微環境從免疫抑制轉變為促免疫原化來引起全身抗腫瘤免疫應答。在腫瘤微環境中,樹突狀細胞(DCs)的激活是產生T細胞抗腫瘤反應的關鍵。而使用激發劑去激發多種模式識別受體的治療對于激活DCs非常有效,但同時也會產生嚴重的免疫相關不良反應。Nuhn等人報道了一種高效TLR7/8激發劑和納米粒子結合,在不影響抗腫瘤治療效果的前提下,二者相結合的局部治療可以有效激活前哨淋巴結中的DCs,促進腫瘤抗原特異性CD8 T細胞的增殖。此外,結合了PDL1抗體檢查點抑制和Flt3L(一種激活骨髓中的DCs的生長因子)的良好治療效果也從實驗中得到了證實。這一研究為提供空間性控制的免疫激活用于局部腫瘤治療提供了新的思路。
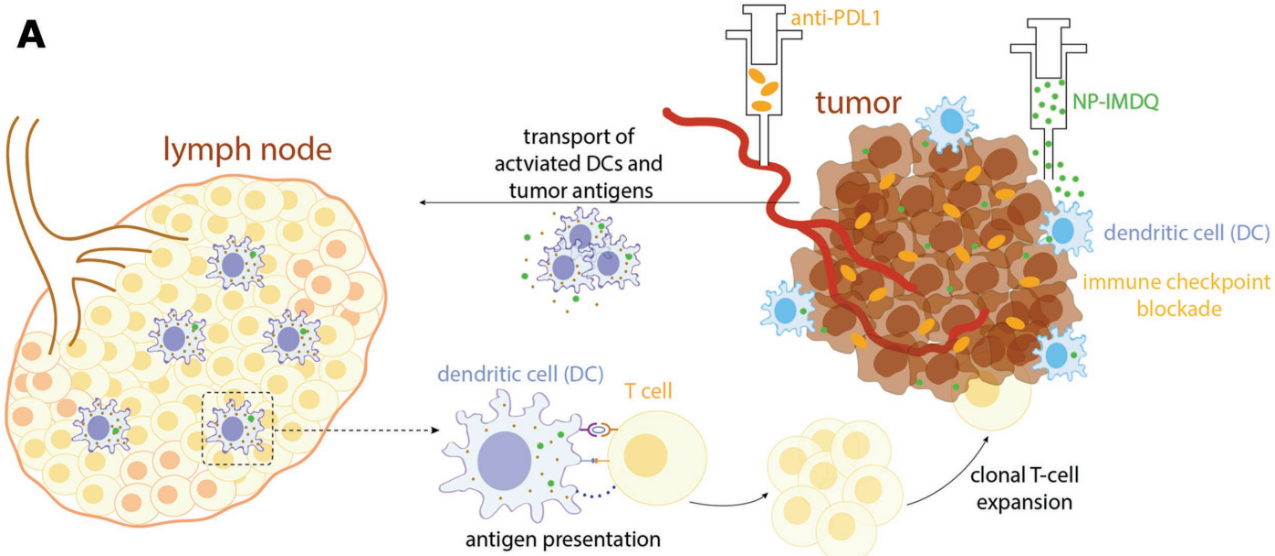
Nuhn L, Koker S D, et al.Nanoparticle-Conjugate TLR7/8 Agonist Localized Immunotherapy Provokes Safe Antitumoral Responses[J]. Advanced Materials, 2018.
DOI: 10.1002/adma.201803397
https://doi.org/10.1002/adma.201803397
2. Nat. Med.:CAR19治療急性淋巴細胞白血病中的靶抗原丟失遺傳機制
Orlando等人鑒定了CD19的基因突變和CD19在嵌合抗原受體(CAR)治療復發時雜合性的喪失。這種突變通常存在于絕大多數耐藥腫瘤細胞中,并被預測會導致一個不具有功能或無跨膜結構域的截斷蛋白產生,從而導致表面抗原的丟失。CD19的這種不可逆轉的喪失也說明今后應該采用另一種靶向性或組合性的CAR治療方法來提高療效。
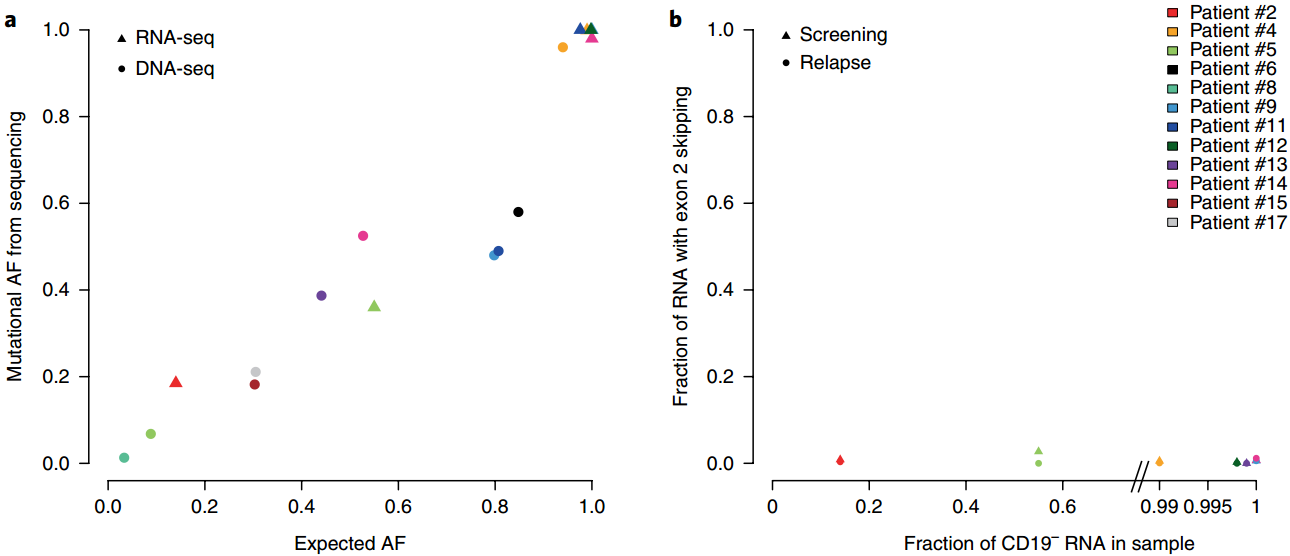
Orlando E J, Han X, et al.Genetic mechanisms of target antigen loss in CAR19 therapy of acutelymphoblastic leukemia[J]. Nature Medicine, 2018.
DOI:10.1038/s41591-018-0146-z
https://doi.org/10.1038/s41591-018-0146-z
3. AM:模擬T細胞的納米顆粒用于治療HIV的傳染
為了改善對人類免疫缺陷病毒(HIV)的治療和預防,開發有效的針對廣譜病毒感染的治療策略是非常重要的。在最近的細胞膜包覆技術的啟發下,CD4+T細胞膜被收集并涂在聚合核表面。由此產生的T細胞膜涂層納米顆粒(TNPs)具有對HIV結合至關重要的T細胞表面抗原。TNPs作為病毒攻擊的誘餌,可以將病毒從它們預定的宿主目標中轉移出來,從而中和HIV病毒。這個誘騙策略有助于克服HIV的遺傳多樣性。研究表明,TNPs會有選擇性地與gp120結合,這是一種HIV病毒的重要包膜糖蛋白。因此TNPs可以有效地中和了單核血細胞和人類單核細胞衍生的巨噬細胞的病毒感染。這一研究證明利用天然T細胞的功能的TNPs作為一種新的治療藥物來對抗HIV感染具有巨大的潛力。
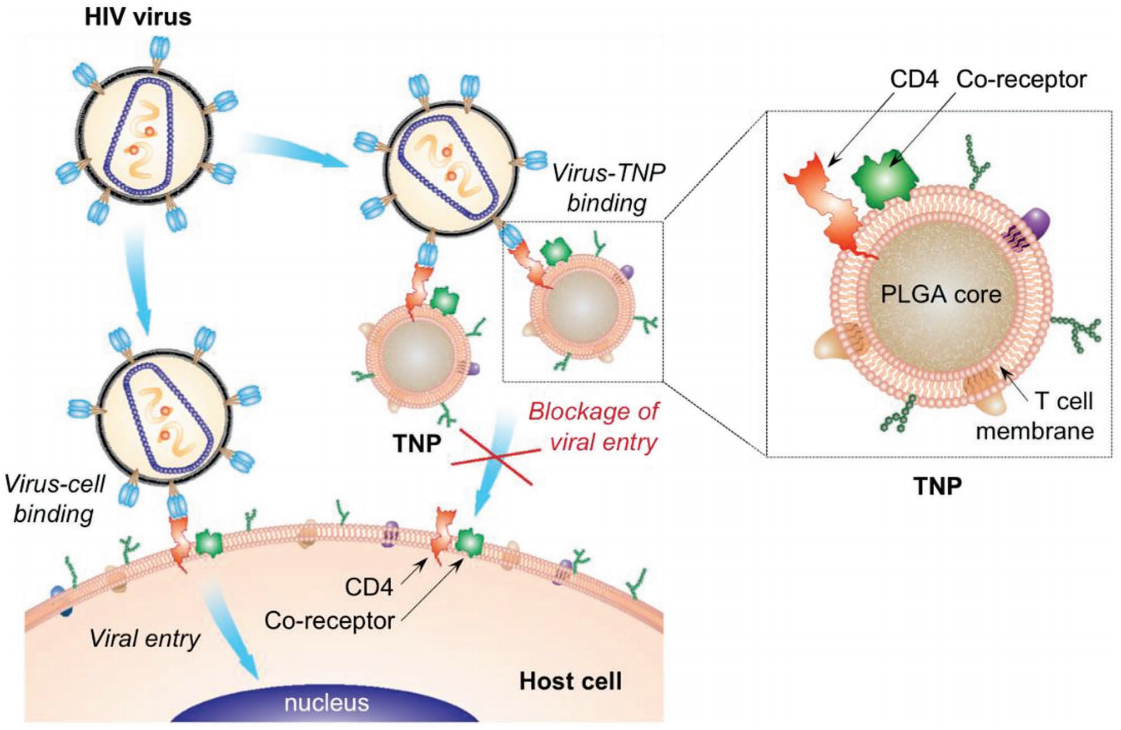
Wei X,Zhang G, et al. T-Cell-Mimicking Nanoparticles Can Neutralize HIV Infectivity[J]. Advanced Materials, 2018.
DOI:10.1002/adma.201802233
https://doi.org/10.1002/adma.201802233
4. Nat. Commun.:編輯RNA衍生表位作為癌癥抗原發揮作用并引發免疫反應
除了基因組突變以外,在mRNA序列中引入核苷酸同樣可以使得蛋白質的序列變化。這種對RNA的編輯有助于改善對不同類型的人類疾病包括癌癥的治療。Zhang等人報告了由RNA編輯產生的縮氨酸確實是由人類白細胞抗原(HLA)分子自然呈現的。實驗的證據表明,在人類腫瘤中會產生特異性針對被編輯的肽的效應CD8+T細胞,并攻擊正在呈現這些表位的腫瘤細胞。這些發現表明,對RNA的編輯擴展了HLA呈現的自我抗原的種類,并且這些抗原可以被免疫系統識別。
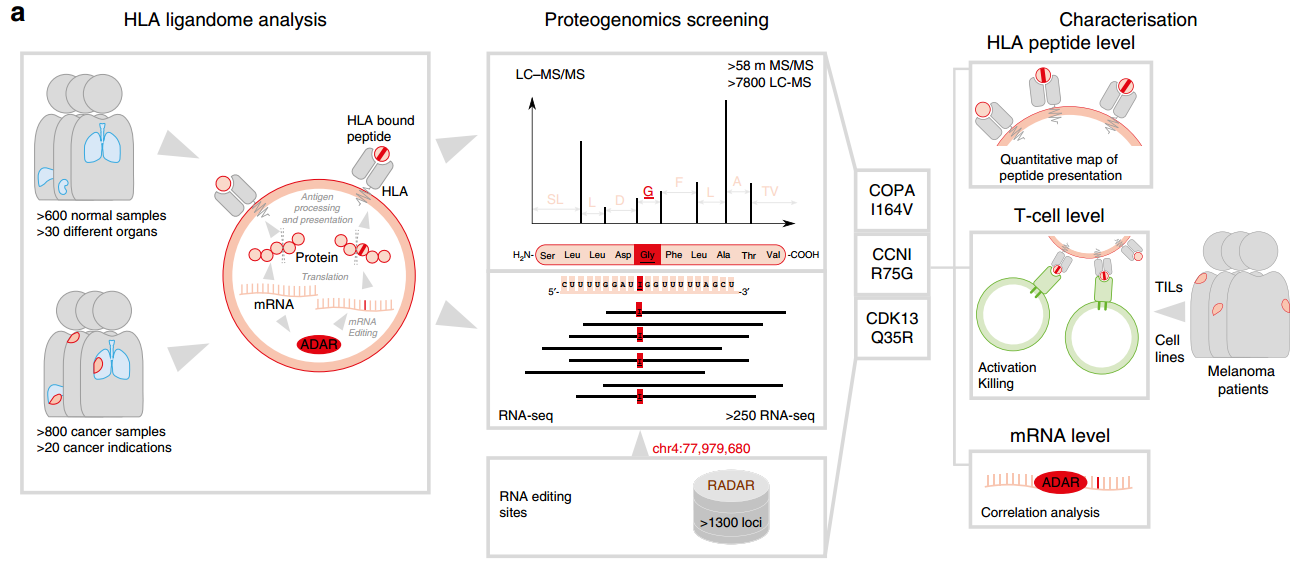
Zhang M, Fritsche J, et al. RNA editing derivedepitopes function as cancer antigens to elicit immune responses[J]. Nature Communications, 2018.
DOI: 10.1038/s41467-018-06405-9
https://www.nature.com/articles/s41467-018-06405-9
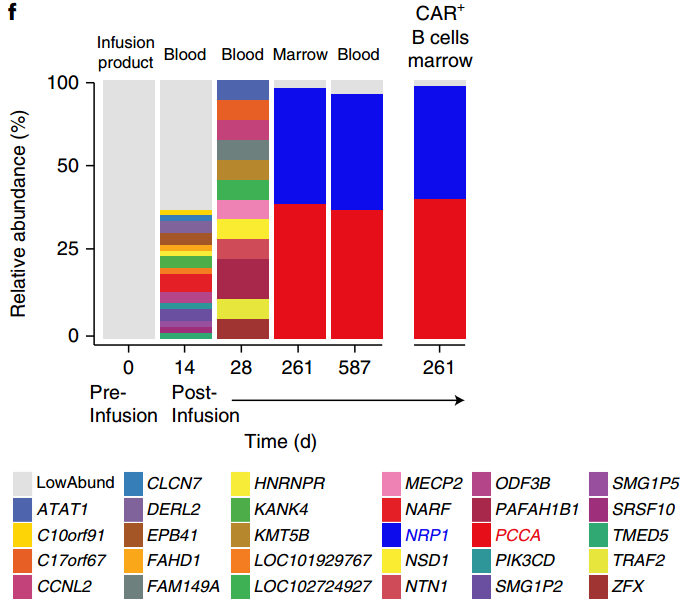
5. Nat. Med.:單個白血病B細胞轉導對嵌合抗原受體T細胞療法的抵抗力
Ruella等人報告了一例CD19-白血病患者在注射靶向CD19的嵌合抗原受體(CAR)T細胞(CTL019) 9個月后復發,該細胞會異常表達抗CD19的CAR。實驗發現,這是由于在T細胞制造過程中,CAR 基因無意中被引入到單個白血病B細胞中,其產物在cis中與白血病細胞表面的CD19表位結合,掩蓋了CTL019對其的識別病由此產生耐藥性。
Ruella M, Xu J, et al.Induction of resistance to chimeric antigen receptor T cell therapy bytransduction of a single leukemic B cell[J]. Nature Medicine, 2018.
DOI:10.1038/s41591-018-0201-9
https://doi.org/10.1038/s41591-018-0201-9
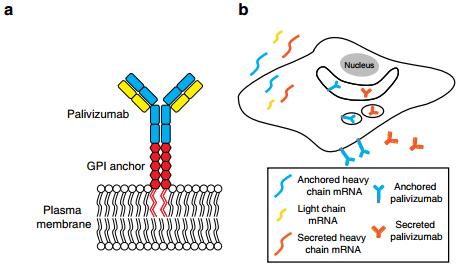
6. Nat. Commun.:基因工程mRNA表達的抗體可預防呼吸道合胞病毒感染
肺是臨床上重要的傳染性病原體(呼吸道合胞體病毒RSV)的重要預防靶點。Tiwari開發了一種基于mRNA的方法,即通過氣溶膠直接在肺部表達中和抗體以防止RSV感染。實驗首先使用帕利珠單抗使RSV F數減少90.8%,并且發現膜錨定的帕利珠單抗可以防止轉染細胞中的感染,分別減少了99.7%和89.6%的體外和體內的RSVF。最后實驗表達一種錨定的高親和力的RSV抗體(RSVaVHH和sVHH)證明了RSV aVHH而不是RSV sVHH可以在轉染后7天內顯著抑制RSV,并且證明了RSV aVHH在肺中可以至少存在28天。這一研究表明在肺部表達膜錨定的中和抗體是一種有前途的肺部預防病毒的方法。
Tiwari P M,Vanover D, et al. Engineered mRNA-expressed antibodies prevent respiratory syncytial virus infection[J]. Nature Communications, 2018.
DOI:10.1038/s41467-018-06508-3
https://www.nature.com/articles/s41467-018-06508-3
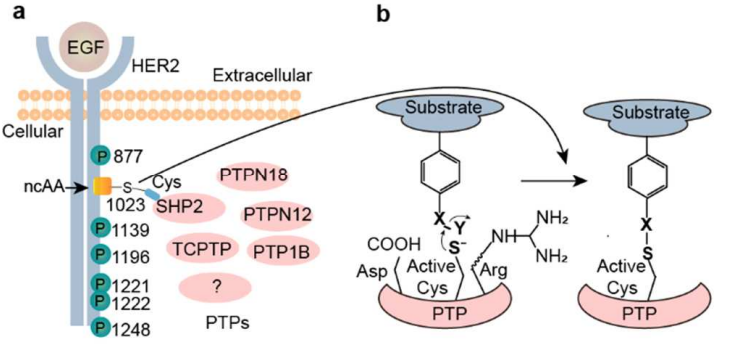
7. JACS:細胞中酪氨酸磷酸酶和底物相互作用的蛋白質組學鑒定
蛋白質酪氨酸磷酸酶(PTPs)在細胞信號通路中扮演著重要的角色,但是在活細胞中識別未知的PTPs仍然是很大挑戰。Tang等人合成了一系列以酪氨酸為基礎的PTP抑制劑,其特點是可以在具有擴展遺傳密碼的細胞中對基質蛋白進行位點的特異性編碼。實驗通過對化學反應性的研究確定了最優活性氨基酸探針。以HER2為例,實驗首次提供了在活的人類細胞中HER2y 1023和SHP2交聯的直接證據。此外,利用蛋白質組學分析發現PTP1B是一種新型的HER2磷酸酶,這可能有助于解釋PTP1B在治療HER2陽性乳腺癌中所起的作用。
Tang H,Dai Z, et al. Proteomic identification of protein tyrosine phosphatase andsubstrate interactions in living mammalian cells by genetic encoding of irreversible enzyme inhibitors[J]. Journal of the American Chemical Society,2018.
DOI:10.1021/jacs.8b06922
https://pubs.acs.org/doi/10.1021/jacs.8b06922
8. JACS:一鍋法合成介孔硅材料用于抗菌
Dubovoy等人合成了新型的介孔硅材料用于作為抗菌藥物的輸送系統(DDS)。該材料具有高的密度、寬的孔隙通道以及高的表面積。通過藥物釋放研究表明,在沒有對材料進行額外的表面修飾的情況下,該材料可以對BAC實現控制釋放。并且這種釋放在酸性(pH 4.0、5.0、6.5)和中性(pH 7.4)溶液中的機制有著顯著的差異。微生物化驗結果表明,這一材料在合適的濃度下會使得金黃色葡萄球菌和沙門氏菌的活性明顯下降。這一發現將有助于擴大BAC作為消毒殺菌劑的使用范圍和潛力。

Dubovoy V,Ganti T, et al. One-Pot Hydrothermal Synthesis of Benzalkonium-Templated Mesostructured Silica Antibacterial Agents[J]. Journal ofthe American Chemical Society, 2018.
DOI:10.1021/jacs.8b04843
https://pubs.acs.org/doi/10.1021/jacs.8b04843
9.AM綜述:DNA折紙納米材料用于藥物體內遞送
近幾十年來,為有效的藥物輸送而設計的新型納米材料如雨后春筍。隨著DNA納米技術被逐漸開發出來,用于構建復雜的三維納米結構和人工分子裝置來在納米尺度上操作,從而可以產生各種多樣化的功能和多領域應用。特別是,DNA-折紙納米材料具有合理設計的尺寸和精確的空間定位性以及顯著的生物相容性,是一類很好的藥物遞送載體材料。Jiang總結了最近成功的利用自組裝DNA-折紙納米材料作為藥物載體的工作,并且討論了這一領域所面臨的機遇和挑戰。
Jiang,Q., Liu, S.L. et al. Rationally Designed DNA-Origami Nanomaterials for Drug Delivery In Vivo. Advanced Materials, 2018.
DOI:10.1002/adma.201804785
https://doi.org/10.1002/adma.201804785











