
向大腦輸送納米顆粒一直是改善腦部疾病和損傷的診斷和治療結果的技術開發的重要領域。到目前為止,大多數使用納米粒子進行大腦應用的研究都集中在遞送方面——將納米粒子到達感興趣的部位并達到預期的效果定義了許多研究的范圍。一般來說,基于納米的遞送策略旨在克服全身遞送中的高度選擇性血腦屏障,并引導大腦微環境以靶向并增加特定腦細胞內的攝取。這種對遞送的關注,而不是遞送成功(或失敗)后發生的情況,忽略了將納米粒子用于大腦應用的一個關鍵組成部分:清除。
近日,上海交通大學高小玲、上海中醫藥大學陳紅專、加拿大瑪格麗特公主癌癥中心鄭剛等人試圖填補這一知識空白并回答一個重要問題:納米顆粒到達大腦后會發生什么?
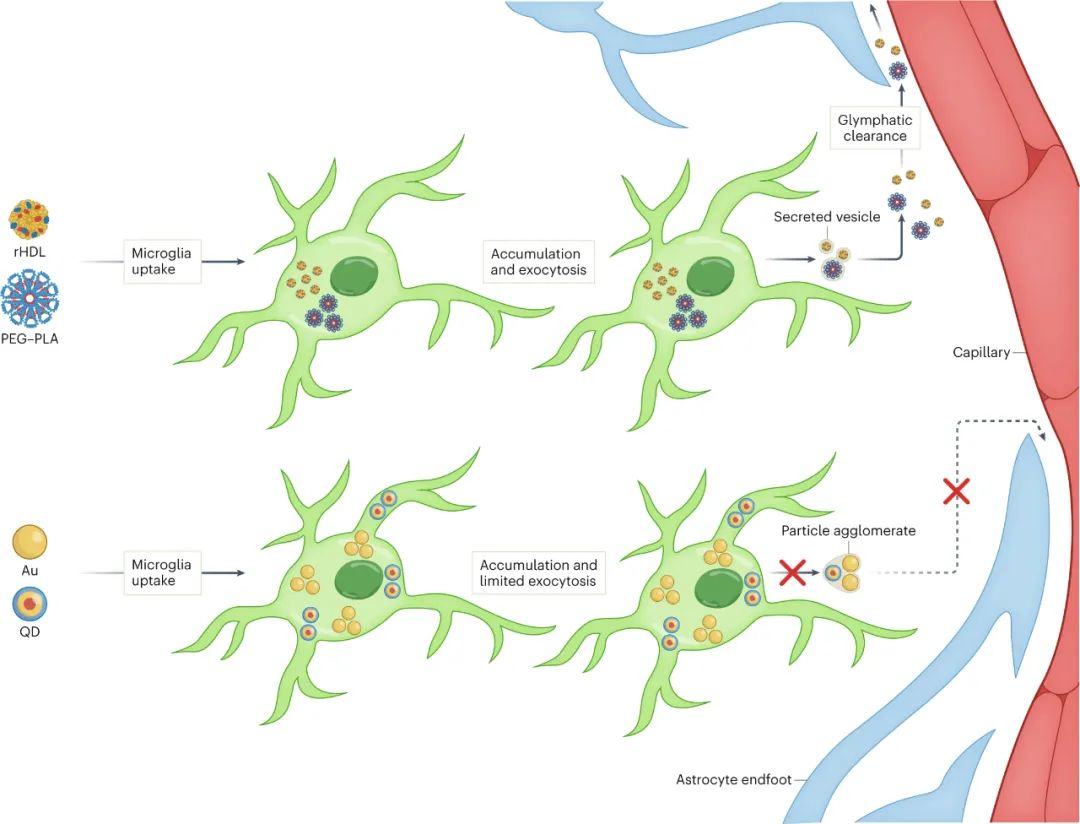
圖|納米顆粒在大腦中的命運
了解納米顆粒在大腦(人體最受保護的器官之一)中的命運和停留時間對于納米顆粒的臨床使用非常重要:之前的文獻表明,納米顆粒在大腦中的積累和毒性可以改變細胞信號傳導、細胞對壓力的反應和細胞命運。例如,可用于診斷、治療或診斷應用的無機納米材料在大腦中持續停留并可能引發神經毒性,可能阻礙聚合物或脂質顆粒等有機材料可能使用的清除機制。
為了確定納米顆粒從大腦中清除的機制,研究人員配制了兩種有機納米顆粒——重組高密度脂蛋白(rHDL)和聚乙二醇-b-聚乳酸納米顆粒(PEG-PLA)——并使用了兩種類型的無機納米顆粒——帶和不帶PEG的量子點和金納米顆粒。有趣的是,他們的結果表明,納米顆粒從大腦中的清除可能取決于成分,而不是任何單一的物理化學特性,例如尺寸、zeta 電位、表面功能化和硬度,所有這些因素都會影響納米顆粒向特定器官和細胞的輸送。
大腦的清除可以通過血管旁途徑進行,通常稱為類淋巴途徑,它是大腦中主要的廢物清除系統,驅動腦脊液和間質液之間的可溶性蛋白質和代謝物交換。利用小鼠活體成像,研究人員發現,rHDL 和 PEG-PLA 納米顆粒在海馬內注射后均迅速從大腦中消除,盡管rHDL 和 PEG-PLA 納米顆粒的平均直徑顯著不同(分別為 21.4 nm 和 107.5 nm)和通過 zeta 電位測量的平均表面電荷(分別為 -11 mV 和 -28 mV)。相比之下,聚乙二醇化量子點(平均直徑 23.4 nm,-24 mV)和金納米顆粒(9.9 nm,-19 mV)保留在大腦實質中,與血管旁空間的間隙最小。清除率的差異是驚人的:在相同劑量下,即使給藥后 8 小時,大腦中殘留的有機納米顆粒也不足 15%;對于無機納米顆粒,給藥后48小時保留了超過70%的注射劑量。這些觀察結果在所有測試劑量中都是一致的,即使增加納米粒子劑量略微降低了清除率。
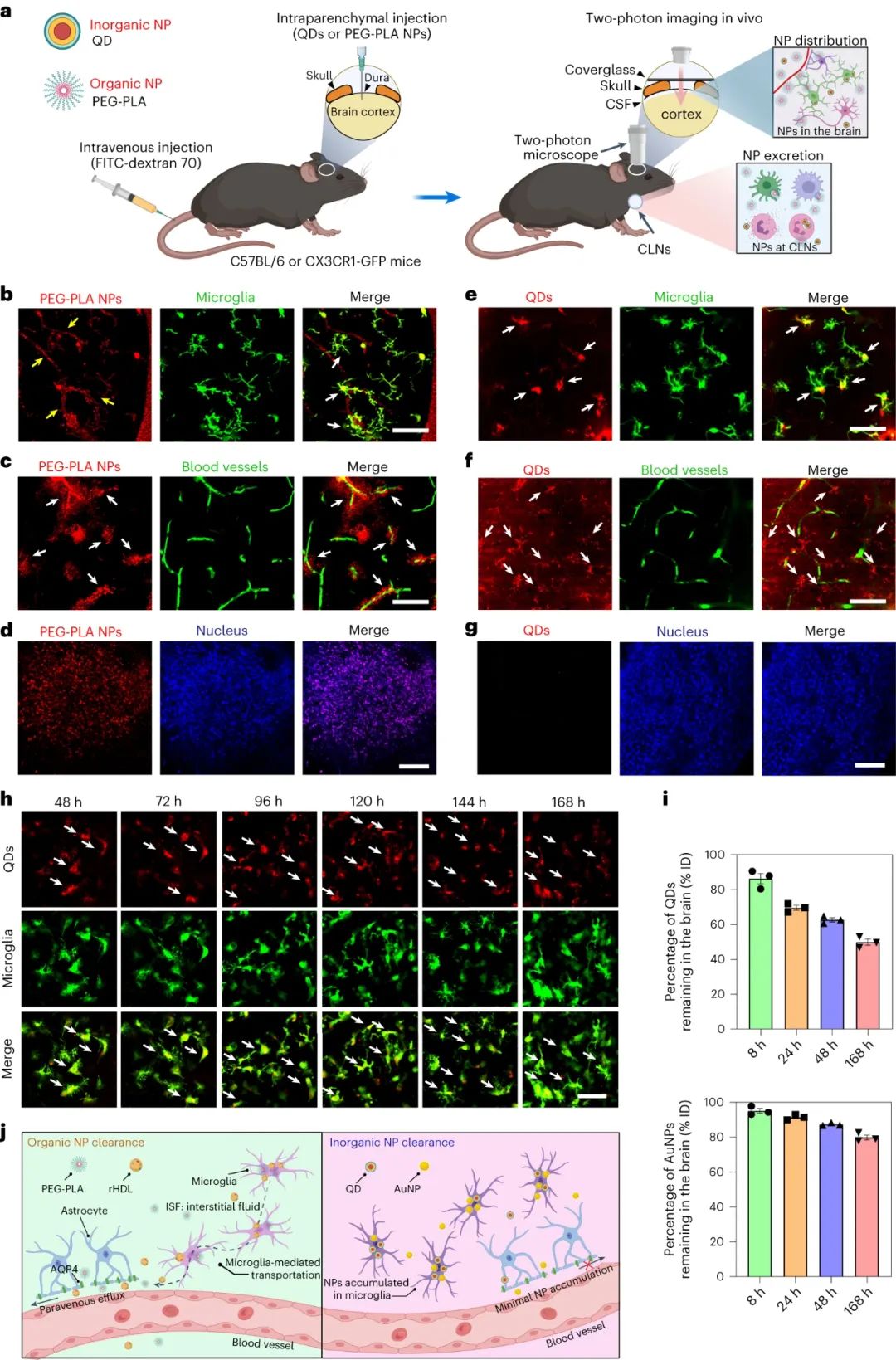
圖|無機和有機NPs表現出不同的腦分布和清除率分布
未被清除的無機顆粒被隔離在小膠質細胞中,小膠質細胞是大腦中的吞噬細胞,通常被描述為大腦的常駐免疫細胞。在過去的幾十年里,我們對小膠質細胞的了解迅速發展,并且小膠質細胞經常成為納米顆粒治療策略的目標,因為它們在維持體內平衡以及對大腦疾病或損傷的反應中發揮著明顯的作用。研究人員在體外證明,有機和無機納米顆粒都在小膠質細胞中內化,但從早期內體或溶酶體運輸到晚期內體或溶酶體的無機納米顆粒的胞吐速度比有機納米顆粒慢約10倍。
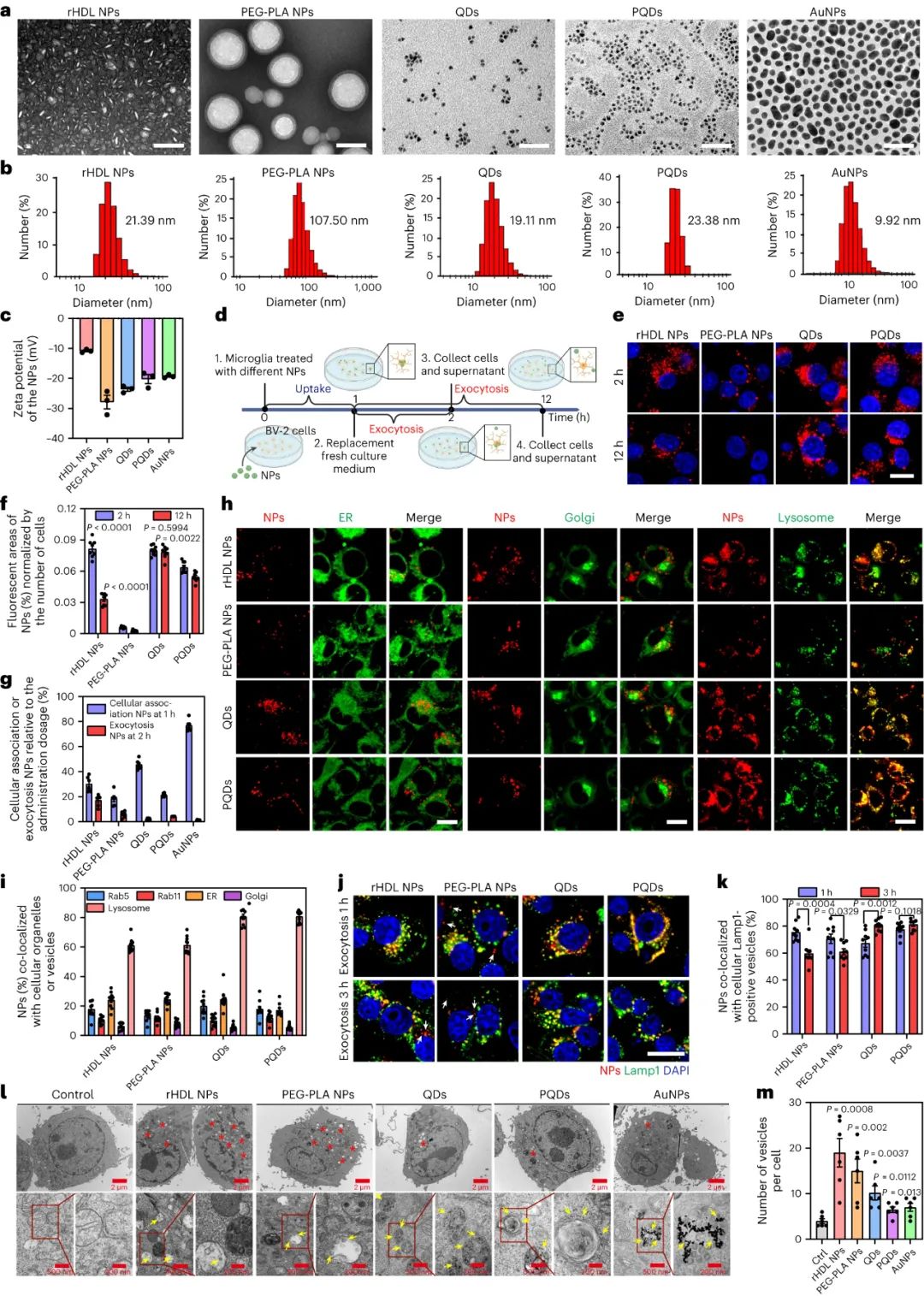
圖|無機和有機納米顆粒在小膠質細胞中表現出不同的細胞內轉運和胞吐作用模式
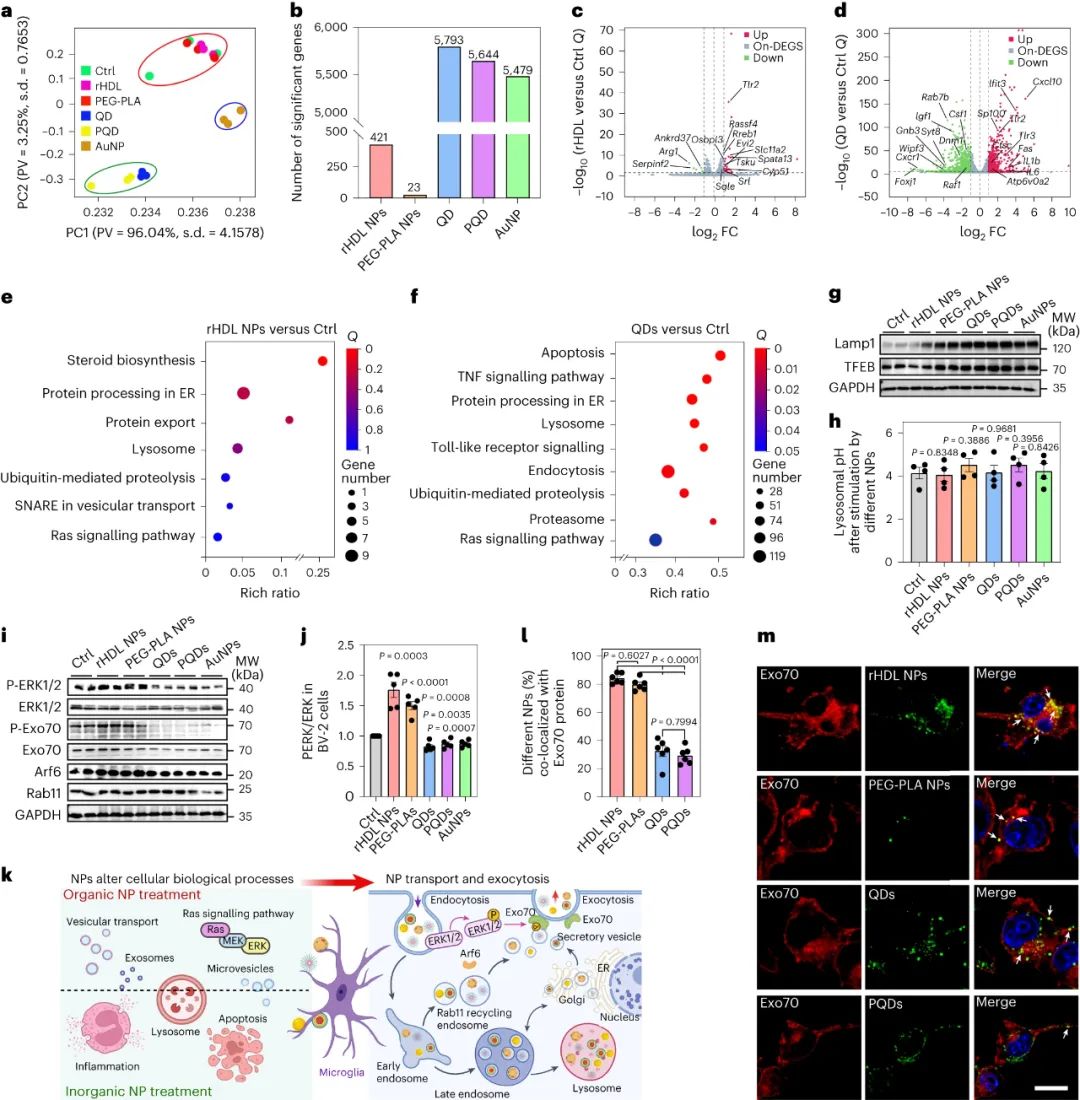
圖|NP 治療改變小膠質細胞信號傳導和胞吐作用過程
根據納米材料成分分離這種改變速率的機制具有挑戰性,但研究人員使用RNA序列分析和敲除模型來探索通過小膠質細胞進行納米顆粒運輸和從大腦清除的途徑。
無機納米顆粒內化到小膠質細胞中,驅動了與細胞凋亡、炎癥和溶酶體加工相關的小膠質細胞基因表達的變化,以及ERK1/2 信號通路的增加,從而導致細胞外囊泡 (EV) 生物合成和分泌的減少。
在暴露于有機納米粒子的細胞中,EV 分泌上調,導致小膠質細胞中更快的胞吐作用和更少的有機顆粒積累;事實上,通過非競爭性中性鞘磷脂酶抑制劑治療或敲除 Rab7 表達來阻止小膠質細胞中 EV 的釋放,會導致所有納米顆粒的累積加劇。在體內,抑制EV釋放導致rHDL顆粒在大腦中的更大積聚,并減少對血管旁空間中rHDL粒子的檢測,盡管當ERK1/2激活通過帕莫酸處理上調時,抑制的EV釋放可以逆轉。ERK1/2激活還通過增強量子點和金納米顆粒以及氧化鐵(臨床上最普遍的無機納米顆粒)的小膠質細胞EV釋放,減少了納米顆粒的積累,增加了清除率。
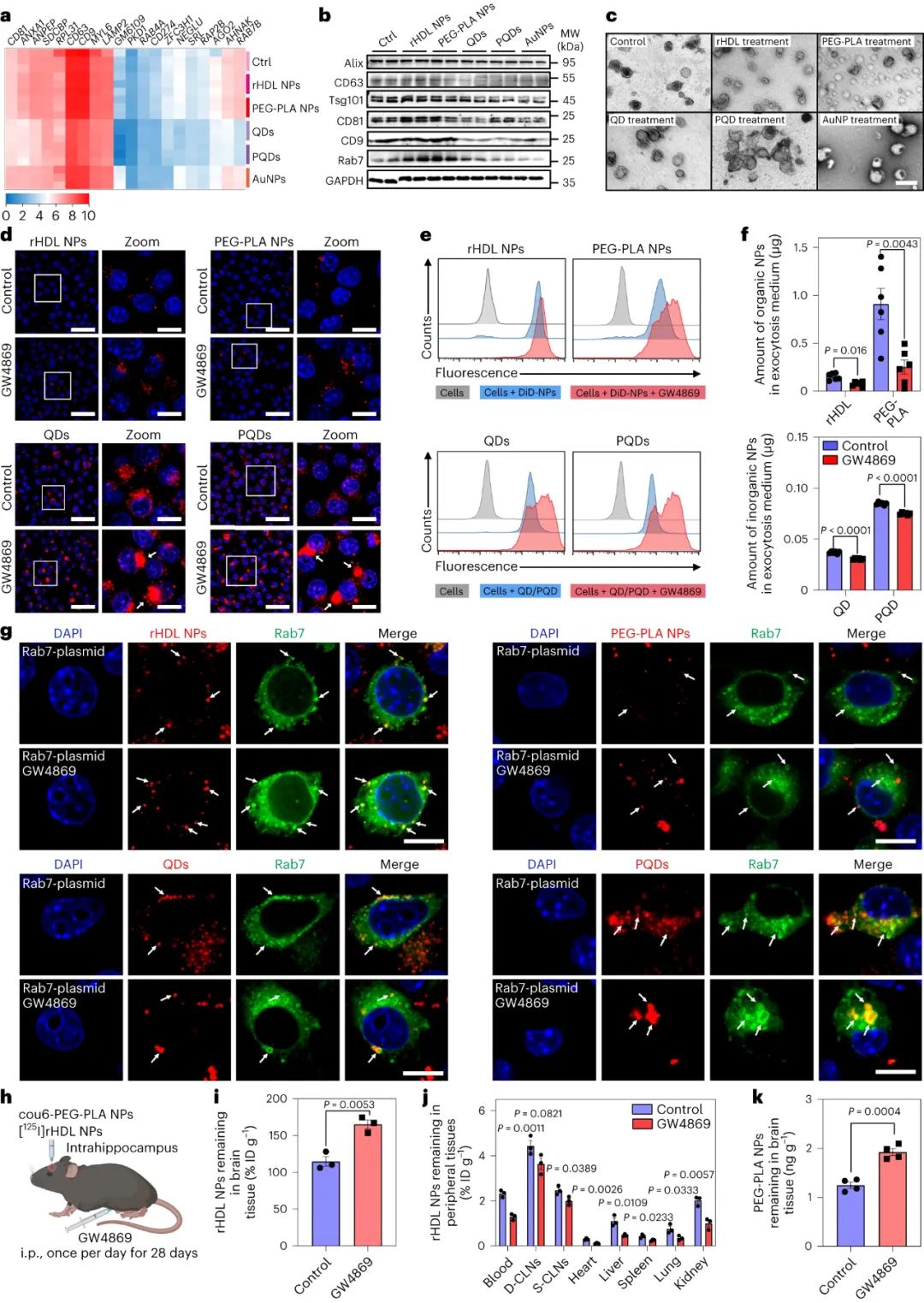
圖|小膠質細胞 EV 的釋放對于 NP 的消除至關重要
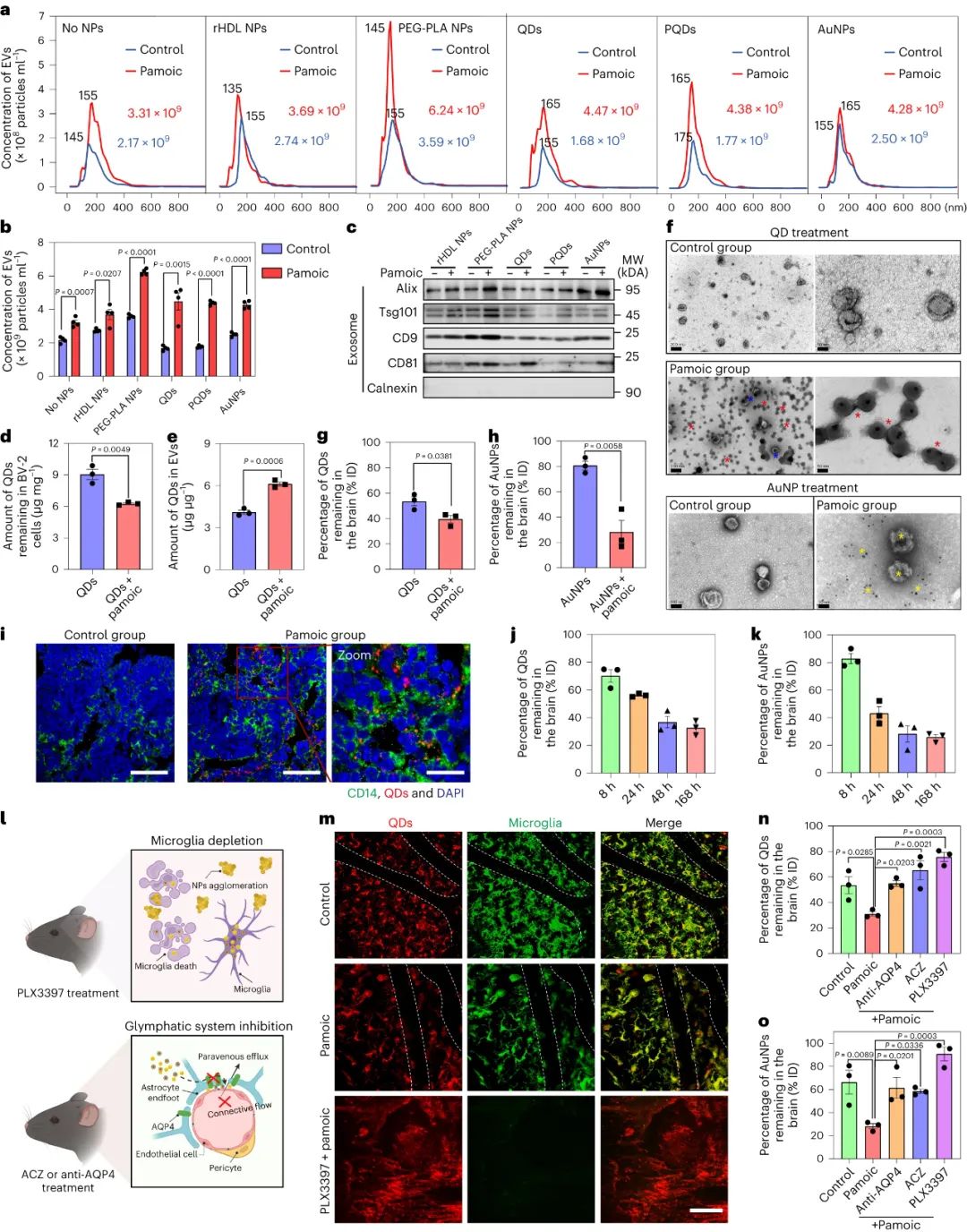
圖|ERK1/2 激活促進 NP 從大腦中清除
總的來說,該廣泛而嚴格的結果為納米顆粒遞送至大腦領域中納米顆粒命運和清除的重要問題提供了機制見解。盡管該研究報告了使用的許多不同納米顆粒系統的物理化學特性,分離每種性質對納米顆粒在大腦中運輸的單獨貢獻仍然是該領域需要解決的一個持續挑戰,因為改變一種物理化學性質可能會從本質上改變另一種。
此外,許多中樞神經系統疾病的臨床治療策略不會像本研究中使用的那樣使用腦內給藥,這就需要繼續進行研究,以了解不同的給藥途徑是否足以改變納米顆粒的組成或表面表現,從而改變小膠質細胞EV分泌在納米顆粒清除中的作用。盡管如此,研究人員使用的研究結果和技術的結合可以應用于任何納米顆粒系統,其結果也為在疾病存在或治療后比較納米顆粒的保留和清除建立了基線。
參考文獻:
Gao, J., Song, Q., Gu, X. et al. Intracerebral fate of organic and inorganic nanoparticles is dependent on microglial extracellular vesicle function. Nat. Nanotechnol. (2023).
https://doi.org/10.1038/s41565-023-01551-8











