2017年,萊斯大學(xué)James M. Tour和Ciceron Ayala-Orozco等人在Nature上報道了使用Feringa型單向旋轉(zhuǎn)分子馬達(dá),該馬達(dá)帶有轉(zhuǎn)子和定子,可以被紫外線(UV)或可見光激活,打開細(xì)胞膜中的孔隙,導(dǎo)致快速壞死死亡。與單向運動的分子相比,沒有鉆孔作用的分子在類似洗衣機(jī)的運動中翻轉(zhuǎn)或表現(xiàn)出隨機(jī)旋轉(zhuǎn),在穿過細(xì)胞膜方面效率低下。膜擾動后迅速出現(xiàn)膜起泡和壞死。改變馬達(dá)的結(jié)構(gòu)在空間上減緩了跨膜的運輸,而將肽添加到分子馬達(dá)中允許將分子靶向特定細(xì)胞。這項研究為分子馬達(dá)在生物工程中的應(yīng)用提供了新的機(jī)會。

雖然紫外線和可見光只能穿透人體組織(皮膚、肌肉和脂肪)數(shù)百 μm至 1 mm,但650-900 納米的近紅外 (NIR) 窗口(也稱為光學(xué)治療窗口)非常適合在體內(nèi)應(yīng)用中,由于血紅蛋白和水的光吸收極小,加上對人體組織的大量滲透,達(dá)到約 10 cm。先前已利用 Feringa 型馬達(dá)的雙光子近紅外激活來誘導(dǎo)快速細(xì)胞壞死,但該技術(shù)需要大量激光產(chǎn)生的光子通量,因此穿透深度很淺,約 0.5 mm,覆蓋面積僅限于較小規(guī)模的領(lǐng)域,對于廣泛的臨床轉(zhuǎn)化來說不切實際。在這種方法中,需要兩個 710 nm 的光子同時撞擊分子,并通過虛態(tài)結(jié)合成 355 nm 的能量,這是一個低概率且效率低的過程,然后激活 Feringa 型電機(jī)的旋轉(zhuǎn)。盡管人們付出了巨大的努力來將分子馬達(dá)的旋轉(zhuǎn)頻率調(diào)整到更高的波長,但可以在近紅外頻率下旋轉(zhuǎn)的分子馬達(dá)尚未見報道。
鑒于此,萊斯大學(xué)James M. Tour和Ciceron Ayala-Orozco等人在Nature Chemistry上報道了利用單光子近紅外光誘導(dǎo)的一種對細(xì)胞的分子機(jī)械作用。研究人員發(fā)現(xiàn),當(dāng)研究人員激活細(xì)胞膜相關(guān)分子的振動模式時,它會導(dǎo)致整個分子在亞皮秒時間尺度上一致振動,從而誘導(dǎo)細(xì)胞快速死亡。細(xì)胞相關(guān)分子手提鉆 (molecular jackhammers, MJH) 表現(xiàn)出這種協(xié)調(diào)一致的全分子振動驅(qū)動作用 (VDA),其機(jī)械作用不同于基于 Feringa 和 Dube 設(shè)計的紫外-可見光激活單向旋轉(zhuǎn)分子鉆。

在典型的光子分子吸收中,分子的單個鍵或一小部分振動或許多鍵以不協(xié)調(diào)的方式振動。然而,還有另一種激發(fā)分子的方法,其中實現(xiàn)了整個分子振動或集體振動,其范圍更長且一致,傳播到分子的整個長度或?qū)挾取.?dāng)振動模式和電子模式(有時分別稱為聲子和等離激元模式)耦合時,這兩種模式一起導(dǎo)致振動耦合,或者可以稱為分子等離激元-聲子耦合。在合適的分子結(jié)構(gòu)中分子等離子體激元初始激發(fā)后,由于電子與原子核的相互作用,集體電子振蕩在飛秒時間尺度內(nèi)迅速衰減。這導(dǎo)致電子-聲子阻尼過程引起原子核同時集體振蕩,即集體振動,通常在亞皮秒時間尺度內(nèi)。這是通過振動弛豫內(nèi)部轉(zhuǎn)換過程中的非輻射衰變發(fā)生的。總之,通過吸收適當(dāng)能量的光,分子的集體電子激發(fā)與分子的振動模式混合以誘導(dǎo)電子振動模式。振動模式類似于分子的超快呼吸模式,其中整個分子在其長度和寬度上一致振動,因為可能分別發(fā)生縱向或橫向集體振動。
研究人員表明,當(dāng)合適的振動模式支持的分子與細(xì)胞膜結(jié)合時,它可以以任何部分分子振動或紊亂振動都無法引起的方式和速率迅速損害細(xì)胞膜的完整性。通過光熱療法加熱分子可以引起分子中的許多振動,但這些振動是不協(xié)調(diào)的,因此沒有足以快速打開細(xì)胞膜的一致的縱向或橫向振動。因此,光熱療法需要高功率和延長時間來減緩細(xì)胞凋亡。相反,細(xì)胞相關(guān)分子的 VDA 即使在非常低的能量下也會導(dǎo)致快速壞死。研究人員利用這些經(jīng)典結(jié)構(gòu)的 VDA 殺死細(xì)胞的速度比光熱或光動力療法快 10-50 倍,濃度比通常使用的低 10 倍,功率比通常使用的低 10-50 倍(80 mW?cm?2 而非 1–4?W?cm?2)。
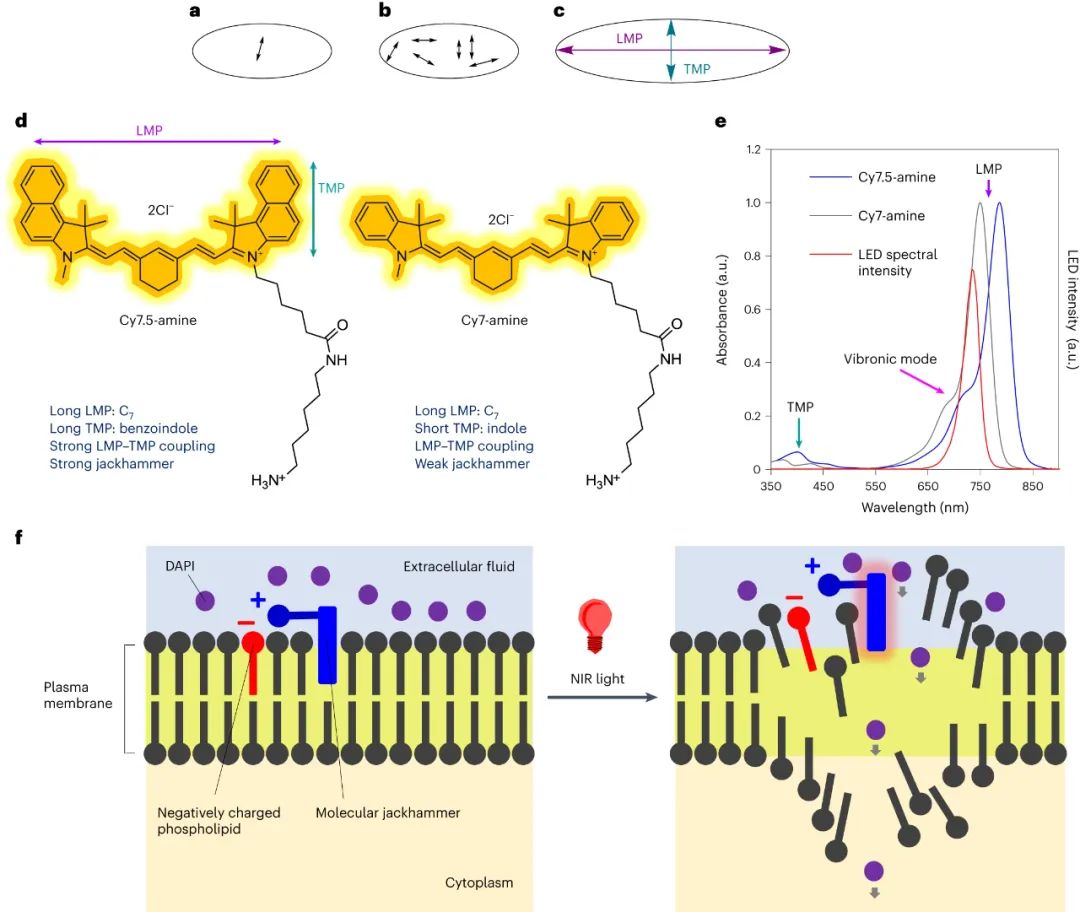
圖|MJH的概念及其工作機(jī)制
氨基花青的振動激發(fā)
花青結(jié)構(gòu)以奇數(shù)多烯連接基連接含氮雜環(huán)為特征,表現(xiàn)出獨特的光物理性質(zhì)。吸收光譜顯示可見光近紅外光譜中的主帶具有較高能量的肩峰。與 Cy7-胺相比,Cy7.5-胺具有額外的芳環(huán),導(dǎo)致吸收紅移約 40 nm。高能肩歸因于分子等離子體激元與近對稱花青中主要集體振動激發(fā)的耦合。時間相關(guān)密度泛函理論 (TD-DFT) 證實了花青中的縱向和橫向分子等離子體。Cy7.5-胺在 730 nm 處的吸收光譜對應(yīng)于具有分子等離子體典型的電荷密度共振的強(qiáng)電子振動模式。TD-DFT 計算準(zhǔn)確地描述了較長波長,但高估了較短波長的貢獻(xiàn)。通過 TD-DFT 確定的 1,310?cm?1振動頻率。這些亞皮秒級的集體整體分子振動是太赫茲時間尺度(41?THz)的振蕩,即比Feringa型馬達(dá)引起的兆赫茲(2–3?MHz)旋轉(zhuǎn)快七個數(shù)量級。
區(qū)分機(jī)械作用與光熱和光動力效應(yīng)
使用波長為730?nm的近紅外光LED,有選擇性地激發(fā)了細(xì)胞膜結(jié)合的Cy7.5-胺中的振動模式,導(dǎo)致A375黑色素瘤細(xì)胞膜通透性增加。與Cy7-胺不同,730?nm光能激活Cy7.5-胺,導(dǎo)致細(xì)胞立即發(fā)生通透。該實驗中,對含有2?×?105個細(xì)胞的細(xì)胞懸浮液進(jìn)行1?μM Cy7.5-amine和730?nm LED照射10?min,導(dǎo)致99.6%的A375細(xì)胞通透化。Cy7-胺在相同條件下無法使細(xì)胞通透。這表明730?nm的光可以激發(fā)Cy7.5-胺的振動模式,導(dǎo)致細(xì)胞膜通透化和細(xì)胞壞死。Cy7-胺雖然在水中的消光系數(shù)更高,但在相同濃度下不能使細(xì)胞通透。這結(jié)果排除了光熱效應(yīng)的可能性,并表明光動力療法也不太可能是原因。
還研究了食品和藥物管理局批準(zhǔn)的帶有烷基磺酸鹽添加劑的吲哚菁綠 (ICG)。ICG 在 730 nm 處具有振動吸收肩,并且磺酸鹽不會與脂質(zhì)雙層中的磷脂相互作用。在測試 Cy7.5-胺的相同條件下,ICG 并未對細(xì)胞進(jìn)行透化。這表明 Cy7.5-胺的有效細(xì)胞殺傷作用是胺懸垂物對快速細(xì)胞締合和隨后的 VDA 的協(xié)同作用。這可能導(dǎo)致能量從這些全分子激發(fā)結(jié)構(gòu)轉(zhuǎn)移到細(xì)胞膜,最終破壞脂質(zhì)雙層,使細(xì)胞膜透化。
機(jī)械破壞細(xì)胞膜的機(jī)制
通過對巨大單層囊泡(GUVs)中脂質(zhì)雙層的機(jī)械破壞,研究人員研究了MJH的作用機(jī)制。機(jī)制步驟包括:
(1)MJH Cy5.5-胺結(jié)合到脂質(zhì)雙層,
(2)激活的VDA解離與MJH緊密接觸的磷脂區(qū)域,產(chǎn)生空位或孔洞,
(3)剩余的磷脂通過疏水尾部的相互作用重新組織,填補(bǔ)空位,使GUVs縮小,
(4)激活的VDA持續(xù)產(chǎn)生孔洞,直到GUVs在某一點破裂(約30?s)。
與ROS的光動力療法效應(yīng)不同,研究人員觀察到GUVs的收縮而非脂質(zhì)雙層的擴(kuò)張。相比之下,較弱的MJH Cy5-胺在2?μM時不能產(chǎn)生足夠的VDA來解離GUVs。這與A375細(xì)胞的結(jié)果一致,提示MJH通過VDA產(chǎn)生的機(jī)械作用破壞脂質(zhì)雙層。

圖|A375細(xì)胞隨時間的細(xì)胞膜透性
MJH介導(dǎo)的體內(nèi)抗腫瘤活性
最后,研究人員使用Cy7.5-amine治療小鼠黑色素瘤(B16-F10和A375)顯示了顯著的治療效果。在B16-F10瘤內(nèi),Cy7.5-胺結(jié)合730?nm光(150?mW?cm?1,5分鐘)使腫瘤溫度上升約5?°C,顯著減小了B16-F10瘤的大小。在A375無黑色素瘤的裸鼠模型中,采用300?mW?cm?2的730?nm光照射5分鐘,結(jié)合腫瘤內(nèi)注射8?μg Cy7.5-amine,可在7個月時實現(xiàn)50%的存活率,其中20%的裸鼠單獨使用Cy7.5-胺亦無腫瘤。這表明Cy7.5-胺在不激活時也能通過緩慢的細(xì)胞毒性機(jī)制(可能是凋亡)發(fā)揮治療作用。
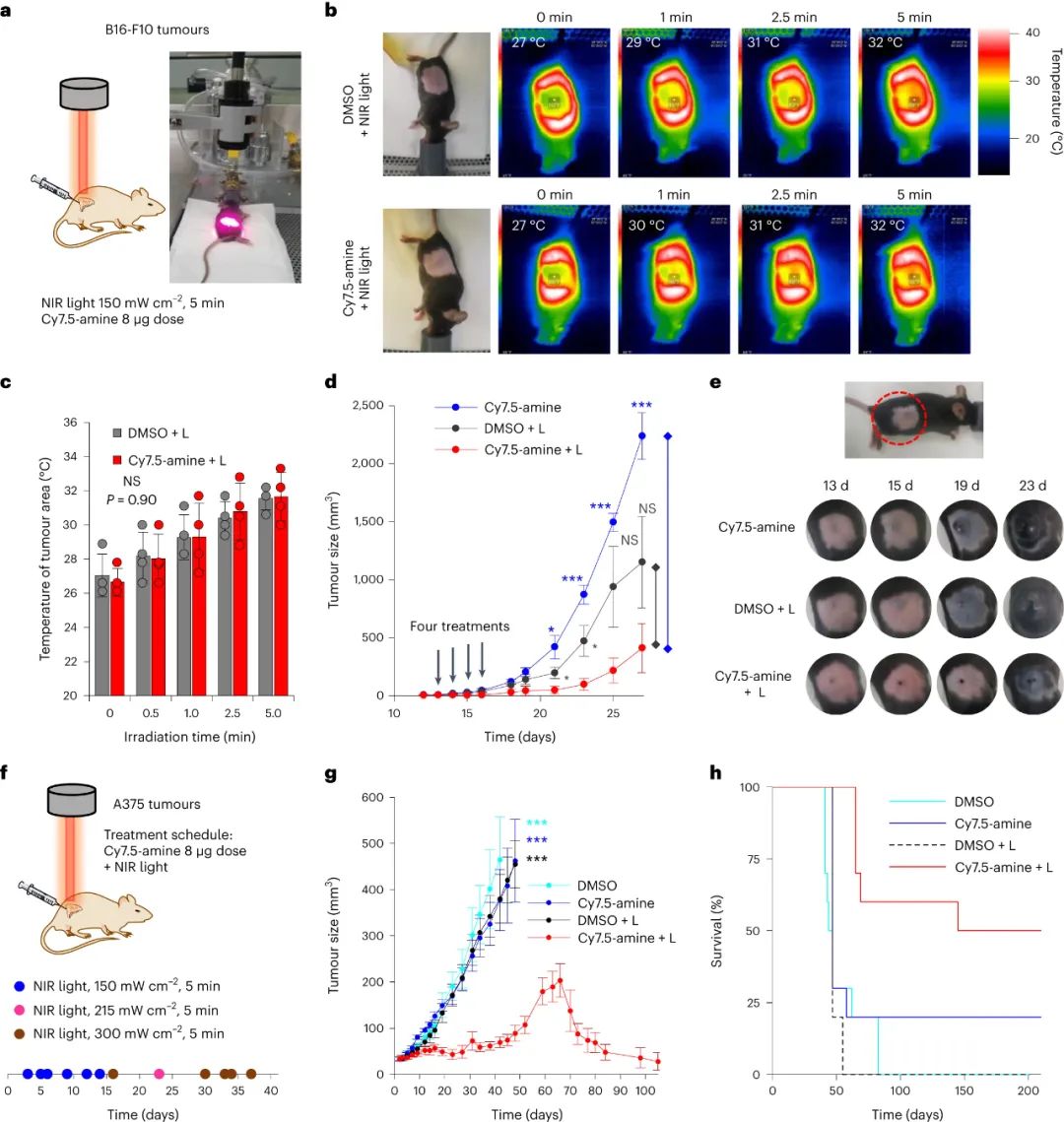
圖|MJH Cy7.5-胺治療小鼠腫瘤的療效
小結(jié):
低濃度 MJH 中的 VDA 是一種使用低強(qiáng)度NIR 光(12?J?cm?2,80?mW?cm?2,持續(xù) 2.5 分鐘)使癌細(xì)胞膜透化并導(dǎo)致高效壞死細(xì)胞死亡的有效方法。Cy7.5-胺的 VDA 的半數(shù)抑制濃度(IC50) 為 250?nM,非常適合癌癥治療的快速臨床轉(zhuǎn)化研究。研究人員在有機(jī)小分子中發(fā)現(xiàn)了一種易于近紅外獲取的分子等離子體(振動耦合),該有機(jī)小分子具有生物相容性、在水中穩(wěn)定且對細(xì)胞膜的透化具有高度活性。此外,不需要通過電化學(xué)方式向這些小分子添加或去除電子來使它們具有電子振動模式活性。因此,這項研究展示了分子尺度上獨特的機(jī)械作用,可以根除細(xì)胞,也可能使用佐劑治療細(xì)胞。該課題組現(xiàn)在正在鑒定和合成其他小分子,這些小分子可以增強(qiáng)細(xì)胞結(jié)合和 VDA 的這種特征組合。其他應(yīng)用可能包括酶活性位點的選擇性調(diào)節(jié)、蛋白質(zhì)通道的調(diào)節(jié)或具有藥理學(xué)意義的超分子生物組裝體的結(jié)構(gòu)和或功能的調(diào)節(jié)。
參考文獻(xiàn):
1. Ayala-Orozco, C., Galvez-Aranda, D., Corona, A. et al. Molecular jackhammers eradicate cancer cells by vibronic-driven action. Nat. Chem. (2023).
https://doi.org/10.1038/s41557-023-01383-y
2. García-López, V., Chen, F., Nilewski, L. et al. Molecular machines open cell membranes. Nature 548, 567–572 (2017).
https://doi.org/10.1038/nature23657











